77564 S0020 (3)
/
K
H
R
O
II 0
C
M
©
\
+ (EtO)2PO M
©
H
EtOOC
H
Schemat 1.3.5
I 'si iv kwasów los fenowych można łatwo otrzymać w reakcji Arbuzowa z trie loksyfostiny i lialogcnku alkilu, np. bromooctanu etylu (schemat 1.3.6).
(liiO)3P + BrCH2COOEt
- (EtO)2PCH2COOEt + EtBr
II
O
Schemat 1.3.6
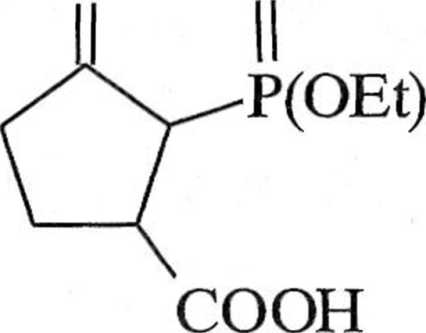
Reakcja Hornera-Wadswortha-Emmonsa nadaje się szczególnie dobrze do otrzymywania «,/J-nienasyconych estrów, a,/hnienasyconych ketonów i podobnych związków nienasyconych. Produkt uboczny reakcji — pochodna kwasu fosforowego — jest rozpuszczalny w wodzie i dzięki temu łatwy do usunięcia. Przykładem może być synteza sarkomycyny (8), antybiotyku cyklopentanoidowego |4, 5|. W tej syntezie /j-oksofosfonian 5 poddaje się cyklizacji na pochodną cyklo-pentanonu 6, z której otrzymuje się trans-3-karboksy-2-dietoksyfosforylocyklopen-lanon (7). Reakcja Hornera-Wadswortha-Emmonsa z użyciem formaldehydu prowadzi do racemicznej sarkomycyny (8) (schemat 1.3.7).
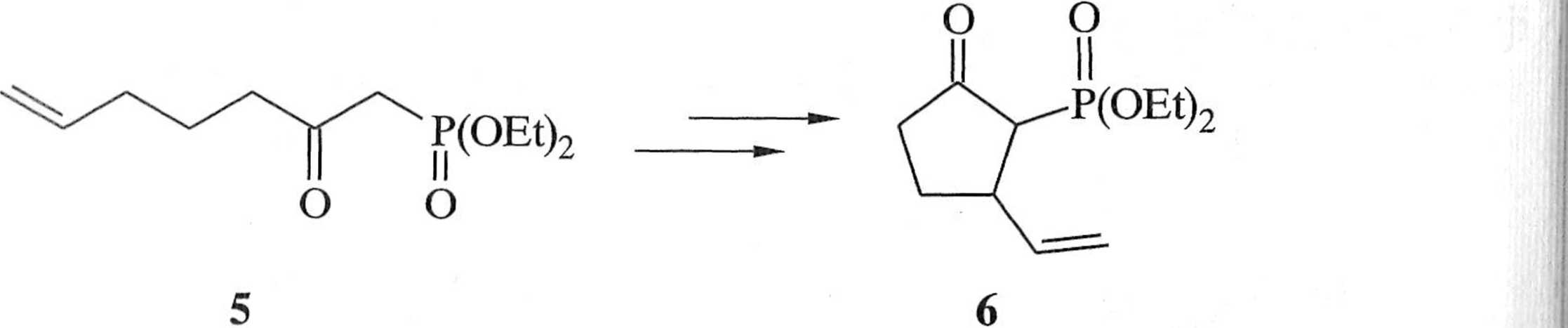
1. 03, MeOH, -70 °C
2. Me2S
^ 3. CrC^/H^SOą

O
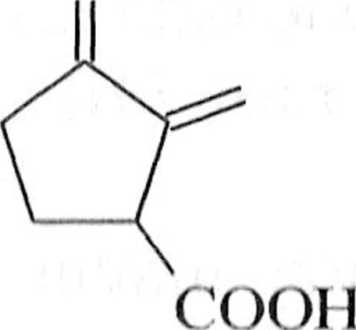
L NaH, THF 2. CH20
l<e;ikcj;i Wi!lig;i i jej modyfikacje znalazły zastosowanie w niezliczonych syn i. .mc li związków pochodzenia naturalnego, np. z grupy karotenów. Syntezę /i-ka mii nu przedstawia schemat 1.3.8.
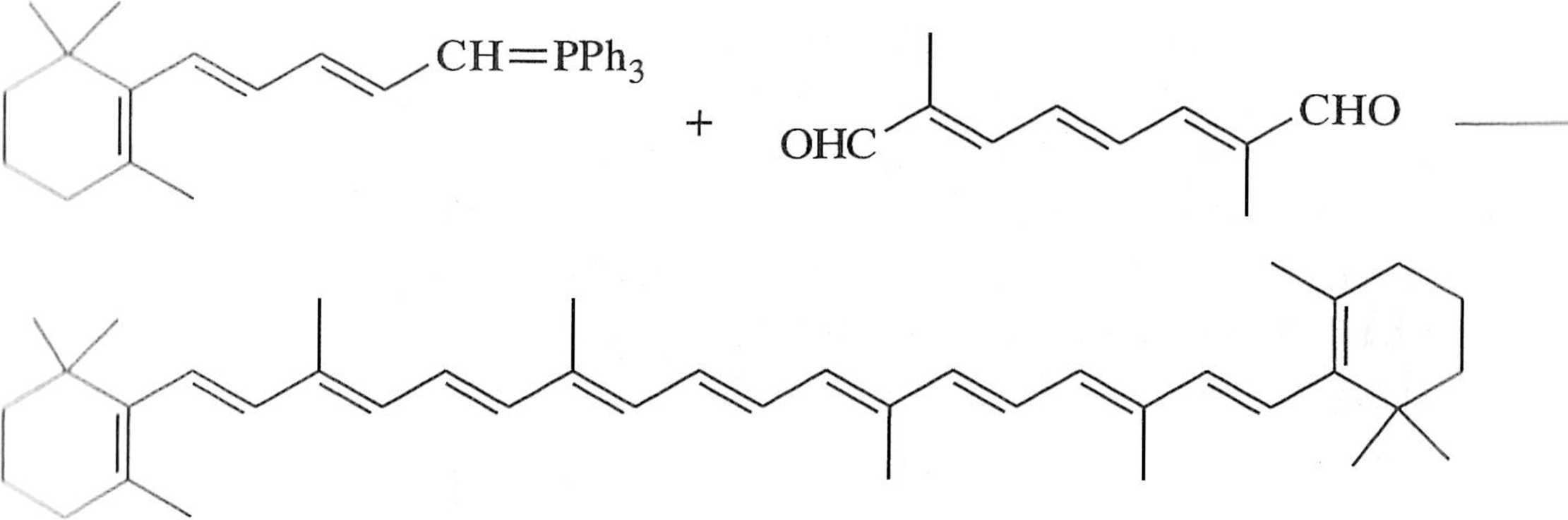
Schemat 1.3.8
/.nane są również warianty asymetrycznej reakcji Wittiga [6]. W takich reak . i n h ulworzone alkeny wykazują chiralność osiową (np. 10), asymetryczna in .lulu |a zaś jest efektem użycia chiralnego pomocnika R* dołączonego do rcagen u lypu I lornera-Wittiga (np. 9), schemat 1.3.9 m.
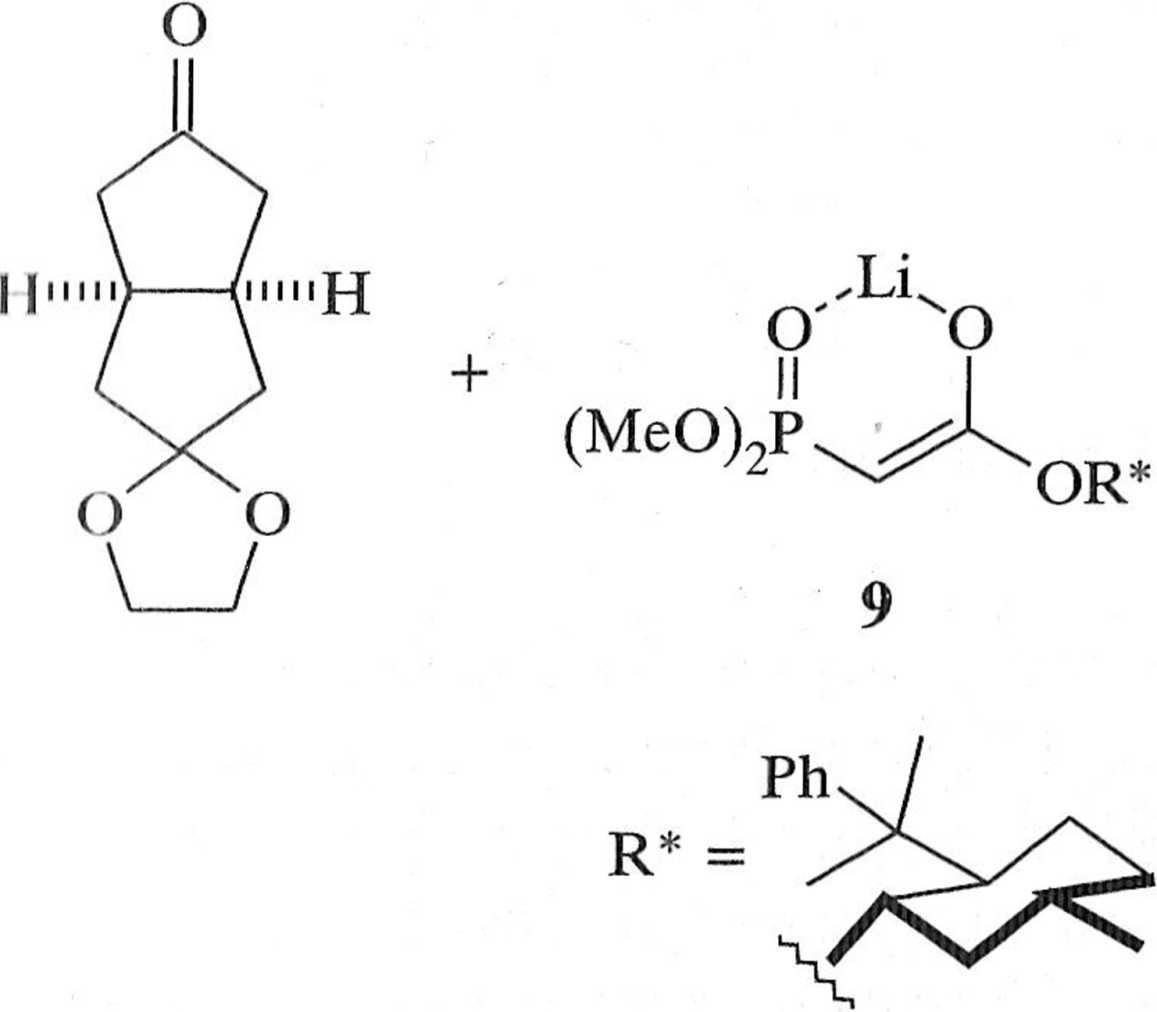
Schemat 1.3.9
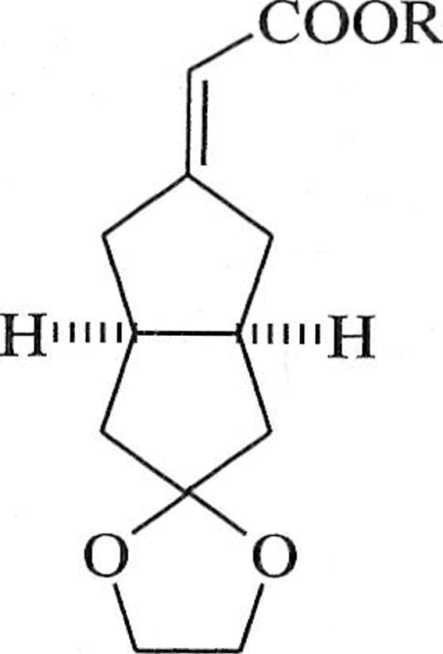
wyd. 93%, e.e. 90% 10
Reakcję Wittiga można przeprowadzić bez użycia rozpuszczalników, wyelio a /. Irifenylofosfiny, bromku alkilowego i aldehydu. Wskutek mechanicznego 11 ■ i h ahniania składników w młynku kulowym w obecności węglanu potasu nasię 111111' generowanie ylidu z następującą reakcją Wittiga. Produktem reakcji jest po . In uIna /i-stilbenu (schemat 1.3.10) [8].
W opisanym dalej eksperymencie reakcja Wittiga została połączona z reakcją ■ Iiliydroksylowania w celu otrzymania wyższych cukrów, o łańcuchu przedłużonym o dwa atomy węglu (schemat 1.3.1 I) |9|.
Wyszukiwarka
Podobne podstrony:
S0020 (3) I Solnktywiut twor/.onio wiązań węgiel wygml O© u i :i o()(’( i iP(OEt), + o / K H R O II
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
S0040 (2) I Soloktywno twor zonio wiązań węgiol wygml /. TJ. Wallów, B.M. Novak, ./. Org. Chan., 199
S0018 (3) I *nlok(ywno twor/onio wigzciń węgiel węgiel T;il)d;i 1.2.3. Substraly i produkty enancjo
S0040 (2) I Soloktywno twor zonio wiązań węgiol wygml /. TJ. Wallów, B.M. Novak, ./. Org. Chan., 199
81254 S0018 (3) I *nlok(ywno twor/onio wigzciń węgiel węgiel T;il)d;i 1.2.3. Substraly i produkty e
S0017 (3) I SoloMywno łworzonio wiązań węgiel węgiel Tabela 1.2.1. Sub,straty i produkty reakcji ald
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
37444 S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów all
S0011 (2) I Soloklywnr twor/onie wigzciń węgiel węgiel Ważnym wariantem reakcji Dielsa-Aldera jest r
S0017 (3) I SoloMywno łworzonio wiązań węgiel węgiel Tabela 1.2.1. Sub,straty i produkty reakcji ald
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
więcej podobnych podstron