35754 Image11 (43)

1
1
26
Rozwiązania zadań ze zbioru "MENDLA
T = 302J■ *
T = 302K
Odp.: Temperatura gazu wynosi 302AC.
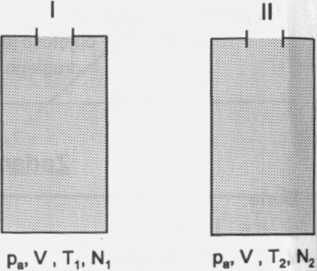
Zadanie 554 str.110
Dane: Szukane:
m2 „
ti =2 7°C T1 = 273K +27K= 300K ~ =?
t2 = 450°C T2 = 273K + 450K = 123K
Ciśnienie p i objętość V w obu przypadkach są takie same.
mi - masa początkowa gazu rr»2 - masa końcowa gazu M oznacza średnią masę jednej cząsteczki powietrza.
Początkowo w naczyniu znajduje się Ni cząsteczek, więc:
mi = Ni•M
Z równania gazu doskonałego dla sytuacji początkowej otrzymamy: pa • V
Ti
= Ni • k /: k
Ni =
Ni =
Pa • V Ti
Pa • V
k • Ti Po podstawieniu:
Pa • V
m! =
k-Ti
M
i podobnie
m2 =
Pa • V
k • T -2
M
Teraz możemy obliczyć stosunek mas:
M
M
-i = EU
mi
k-T,
skracamy M.
Rozwiązania zadań ze zbioru "MENDLA" rng _ Pa • V k • Ti rrn k • T2 pa • V
mg _ Ti mi _ T2 m2 300 K mi “ 723 K
— = 0,415 mi
Odp.: Po podgrzaniu w naczyniu pozostanie 0,415 początkowej masy powietrza.
pi = 28
mol
fl2=32™/
R = 8,31
K ■ mol
Temperaturę mieszaniny wyznaczymy z równania Clapeyrona:
/• T
p • V = n • R • T/: (n • R)
T =
n- R
Oba gazy znajdują się w kuli o średnicy d, więc:
|
7t • |
r3 |
11 rolo. | |
|
v_4 |
K • |
fd> | |
|
V'3 |
l5/ | ||
|
v4 |
K ■ |
d3 8 |
Ti • d
3
6
V =
Wyszukiwarka
Podobne podstrony:
Image10 (43) 24 Rozwiązania zadań ze zbioru "MENDLA" n« 100 J- mol J~ n = 100 moli Odp.: W
Image11 (42) 76 Rozwiązania zadań ze zbioru "MENDLA" Zgodnie z przemianą izotermiczną dla
20238 Image17 (31) 123 Rozwiązania zadań ze zbioru "MENDLA " 123 Rozwiązania zadań ze zbio
57710 Image19 (31) 127 Rozwiązania zadań ze zbioru "MENDLA" Rozwiązania zadań ze zbioru
71485 Image12 (41) 28 Rozwiązania zadań ze zbioru "MENDLA" Ilość moli n mieszaniny azotu i
więcej podobnych podstron