Image10 (43)

24 Rozwiązania zadań ze zbioru "MENDLA"
n« 100 J-
mol
J~
n = 100 moli
Odp.: W przemianie bierze udział 100 moli gazu doskonałego.
Dane:
p = c-V,
c - stała
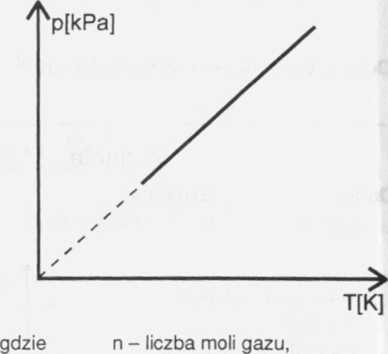
W danej przemianie ciśnienie gazu p jest wprost proporcjonalne do temperatury bezwzględnej T gazu, więc p = c V, gdzie c jest współczynnikiem proporcjonalności.
Z równania stanu gazu doskonałego otrzymamy:
p-V T ="
R /T,
R - uniwersalna stała gazowa.
P
V =
V = n • n - R
/: p
Otrzymane V podstawiamy do związku podanego w zadaniu: p = c V
stąd
n-R-T ,
T" Ap
p- = c • n • R • T p = Vc • n • R • VT
Wielkości c, n, R są stałymi, więc pierwiastek z iloczynu tych stałych możemy zastąpić nową stałą A = Vc n R.
Ostatecznie otrzymamy:
p = A • VT - ciśnienie jest proporcjonalne do pierwiastka z temperatury bezwzględnej.
Podobnie wyznaczamy V(T) korzystając z równania Clapeyrona:
p-V T =n
lecz
p =c • V
stąd C'Y— = n- R /T
T
c . V2 = n ■ R • T /: c V2 = ^ . T
VT
Wielkości n, R, c, są stałymi
i, więc i
jest także stałą.
Oznaczamy ją literą B, czyli Po podstawieniu mamy:
V = B • VT - objętość jest również wprost proporcjonalna do pierwiastka drugiego stopnia z temperatury bezwzględnej.
Zadanie 553 str.110
Dane: Szukane:
p = 0,5 • 105Pa T = ?
V = 150drr? = 0,150m3 N = 1,8 • 1024
k = 1,38 • 10“ 23 7 - stała Boltzmana k
Z równania gazu doskonałego otrzymamy: = N • k AT
p • V = N • k • T /: (N • k)
N-k
0,5 • 105 Pa - 0,15 nr?
T =
T =
1,8-1024 -1,38-10-23p
A
7500-^ • m3 rrr
N ■ m = J
Wyszukiwarka
Podobne podstrony:
35754 Image11 (43) 1 1 26 Rozwiązania zadań ze zbioru "MENDLA T = 302J■ * T = 302K Odp.: Temper
20238 Image17 (31) 123 Rozwiązania zadań ze zbioru "MENDLA " 123 Rozwiązania zadań ze zbio
57710 Image19 (31) 127 Rozwiązania zadań ze zbioru "MENDLA" Rozwiązania zadań ze zbioru
71485 Image12 (41) 28 Rozwiązania zadań ze zbioru "MENDLA" Ilość moli n mieszaniny azotu i
Image10 (41) 109 Rozwiązania zadań ze zbioru "MENDLA Wyznaczone p podstawimy do równania p V =
Image12 (40) 78 Rozwiązania zadań ze zbioru "MENDLA" Pa • Iq • S S • (Pa + b ■ p -g) b ■
więcej podobnych podstron