Image10 (41)

109 Rozwiązania zadań ze zbioru "MENDLA
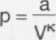
Wyznaczone p podstawimy do równania p V = n-R-T.
Stąd — V = n-R-T VK
Po przekształceniu:
a ■ V1 “K = n • R • T /: a
a-T
Vi-K_n- R
Pierwiastkujemy obustronnie otrzymane równanie.
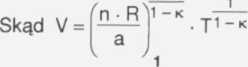
„ n • n ' -k
wyrażenie g jest stałe ponieważ n jest ilością moli gazu, R jest stałą
gazową i a jest również wielkością stałą. Oznaczymy tę stałą literą A, więc:

Ostatecznie otrzymamy zależność objętości V gazu od jego temperatury T
w postaci V = A • T1 -«
Zadanie 617 str.124
Dane:
Vi = 6drrP pi =2-106 Pa
Szukane:
P2 = ?
t2 = ?
ti = 27°C stąd Ti = 273K + 27 K = 300K V2 = Odm3 k= 1,4
Gaz poddano przemianie adiabatycznej, więc: pi • V? = p2 • V5 /: V5 V?

stąd P2 = Pi • —
p2 = 2-106Pa • 21*4
p2 = 2-21,4 • 106Pa = 2 -2,64 ■ 10b Pa p2 - 5,28 • 106 Pa = 5280000 Pa = 5280 kPa Znając ciśnienie p2 możemy obliczyć T2 z równania gazu doskonałego.
pi • Vi _ P2 • V2 Ti ' T2
pi • Vi • T2 = p2 • V2 • Ti /: (pi • Vi)
T2 =
, lecz
P2 = Pi
P2 • V2 • Tl P1 • V1
T2 =
|
P1 • |
fv0 |
K • v2 • Tl |
|
V / P1 |
•Vi |
T lVl'
T2 = lvi
t2 =
T2 =
vK-1
•Ti
/6 dm3
■ 300K
3 dm3
\ /
T2 = 20a ■ 300K= 1,32 -300K T2 «396K
Pi-106 Pa Vi = 2 m3 V2 = 8 m3
Ap = P2-P3
P2 - ciśnienie gazu po przemianie izotermicznej P3 - ciśnienie gazu po przemianie adiabatycznej
Zgodnie z prawem przemiany izotermicznej
Wyszukiwarka
Podobne podstrony:
71485 Image12 (41) 28 Rozwiązania zadań ze zbioru "MENDLA" Ilość moli n mieszaniny azotu i
Image12 (41) 28 Rozwiązania zadań ze zbioru "MENDLA" Ilość moli n mieszaniny azotu i tlenu
Image11 (41) 111 Rozwiązania zadań ze zbioru "MENDLA Stąd p2 = pi • Vi = P2 • V2 /: V2 P1 • Vi
Image12 (41) 28 Rozwiązania zadań ze zbioru "MENDLA" Ilość moli n mieszaniny azotu i tlenu
Image18 (30) 40 Rozwiązania zadań ze zbioru "MENDLA S - pole przekroju cylindra Z równania Clap
20238 Image17 (31) 123 Rozwiązania zadań ze zbioru "MENDLA " 123 Rozwiązania zadań ze zbio
57710 Image19 (31) 127 Rozwiązania zadań ze zbioru "MENDLA" Rozwiązania zadań ze zbioru
więcej podobnych podstron