70209 S0016 (3)
1, Selektywne Iwoi/nnio wiązań węgiel węgiel
Kalalizalorami enancjoselektywnej reakcji aldolowej mogą być zarówno kwa-I rwisa w tym kompleksy BINOLu z metalami ziem rzadkich [16], jak i chi-,,<• zasady Lewisa [17]. Zasady Lewisa bazujące na chiralnych fosforotriami-11, (|6 19) zastosowane zostały przez Denmarka jako katalizatory reakcji mię-v o irichlorosililoenolem 20 a różnymi aldehydami. Produkty — aldole 21 olizymywane były z wysokimi nadmiarami enancjomerycznymi i wysokimi wy-lnoseiami chemicznymi (schemat 1.2.9). Należy nadmienić, że niekatalityczna r.|a lej reakcji jest również możliwa, aczkolwiek wymaga dłuższych czasów pro-idzcnia procesu, a produkty otrzymywane w tej wersji mają konfigurację syn [18].
1, Selektywne Iwoi/nnio wiązań węgiel węgiel
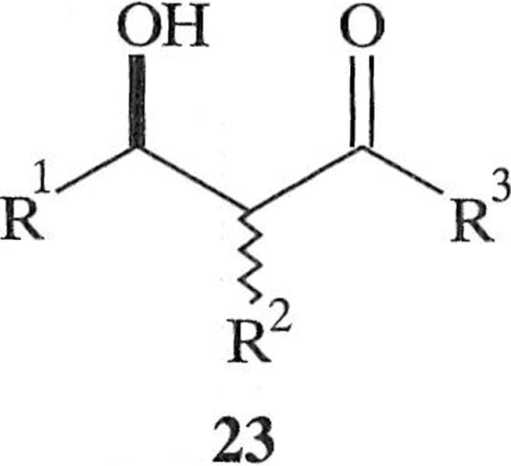
Schemat 1.2.10
Me3SiOH
Schemat 1.2.11
|
OSiMe3 |
Ph2BOH | |
|
r'cho + |
R3 |
SDS PhCOOH |
|
woda | ||
|
R2 | ||
|
22 | ||
R* = Ph, 4-C6H4Cl, 1-naftyl, 2-naftyl, trans-PhCH=CH R2= Me, —(CH2)3—
R3= Et, i-Pr, Ph
Kc akcja aldolowa w różnych wariantach może być również efektywnie prowadzona w środowisku wodnym. Udział chiralnych kwasów Lewisa ogranicza iwoi zenie produktów ubocznych, ale problemem jest konkurencyjna hydroliza < > Niklowanych enolanów, stosowanych jako substraty [19].
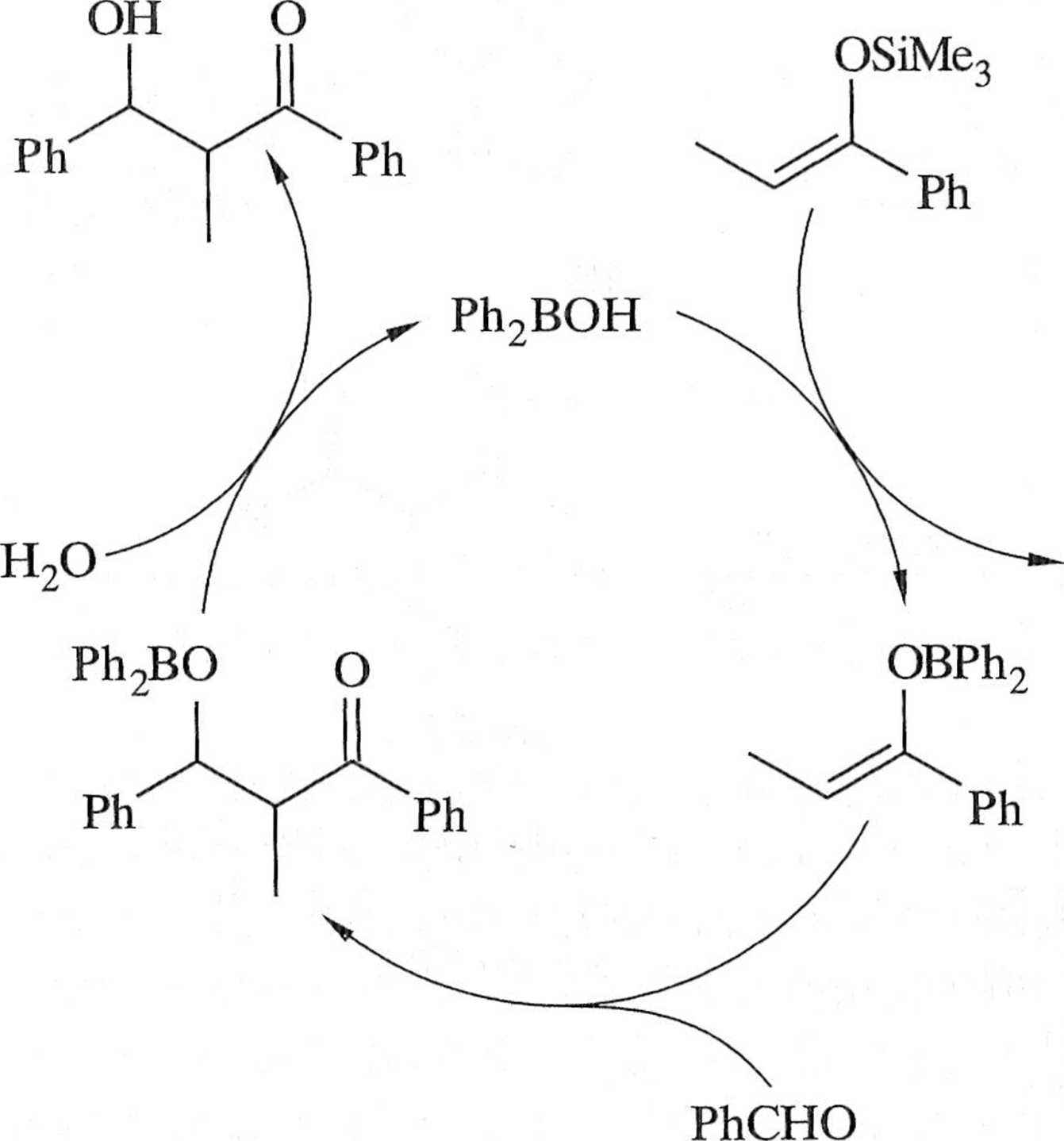
Pomysłową modyfikację tego typu reakcji aldolowej zaproponował Kobayashi i współpracownicy, stosując — oprócz kwasu Lewisa (Ph2BOH), surfaktant — doderylo,sulfonian sodu (SDS) i katalityczną ilość kwasu benzoesowego (schemat l '10). Reakcja przebiega w micelach utworzonych przez SDS, według postulo-w mego przez Kobayashiego mechanizmu przedstawionego na schemacie 1.2.11. l w. is di fenyloboronowy umożliwia generowanie enolanu boru z enolanu sililowe-i n kwas benzoesowy zaś zapewnia odpowiednie pH środowiska, co jest istotne n i ciupie hydrolizy wiązania bor-tlen, następującej po etapie addycji [20].
Reakcja aldolowa jest również częstym etapem reakcji domino (patrz podli t/dzial 7.4).
Część eksperymentalna
Regioselektywna reakcja aldolowa kontrolowana termodynamicznie (schemat 1.2.5) [7]
rum dura reprezentatywna: Benzaldehyd (1,0 ml, 10 mmol) i heptan-3-on (1,4 ml, m mmol) rozpuszcza się w 20 ml bezwodnego odgazowanego toluenu (1). Na-ii, pnie przy mieszaniu magnetycznym dodaje się kroplami chlorek tytanu(IV) (ii i I ml, 1,0 mmol). Mieszanie kontynuuje się przez 16 godzin w temperaturze pokojowej, po czym dodaje się 50 ml eteru dietylowego i całość przemywa się ihI.j lak długo, aż warstwa wodna będzie miała pH = 7. Warstwę organiczną su-\ .k, nad Na2S04, po czym odparowuje się rozpuszczalniki. Za pomocą widm 11 NMR i 1 !C NMR określa się stosunek regioizomerów 9 i 10 oraz diastereose-i. I |ywność,v yn/anti-9.Inne substraty zostały wyszczególnione w tabeli 1.2.1.
A-.ymetryczna, diastereoselektywna, bezpośrednia reakcja aldolowa z użyciem chi rolnego propionoamidu 13 (schemat 1.2.7) [11]
l * , okrąglodennej kolby o pojemności 25-50 ml wprowadza się 13 (1 g, 3,8 mmol) i 4 i bezwodny tetrahydrofuran (11,5 ml). Do tego roztworu dodaje się świeżo .i. .lylowanej trietyloaminy (1,06 ml, 7,64 mmol) i odpowiedniego aldehydu il I mmol) (I) (tabela 1.2.2). Kolbę z zawartością umieszcza się w łaźni chłodzącej i lały ('(),/propan-2-ol) i ochładza do -78°C. W tej temperaturze do roztworu pmwadza się kroplami przy mieszaniu magnetycznym chlorek tytanu(IV) (0,44 ml, mmol) w ciągu 10 minut ( alose miesza się przez cztery godziny, pozwalając
k
Wyszukiwarka
Podobne podstrony:
-o i tlen włączamy: o wiązania wegiel-wodór, zachodzi reakcja hydroksylacji i
-o i tlen włączamy: o wiązania wegiel-wodór, zachodzi reakcja hydroksylacji i
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
więcej podobnych podstron