ZADANIA TEORETYCZNE
XL OGÓLNOPOLSKIEGO KONKURSU CHEMICZNEGO
IM. PROF. ANTONIEGO SWINARSKIEGO
I ETAP
Wersja I
ZAD. A (0 - 15 pkt)
1. W 200,0 cm3 nasyconego roztworu wodorotlenku cynku znajduje się 1,7x10-6 mola jonów cynku. Iloczyn rozpuszczalności tego wodorotlenku wynosi ...............
2. Żelazo łączy się z tlenem w stosunku masowym 7:3. Tlenek żelaza ma wzór ……………
3. W reakcji egzoenergetycznej energia substratów jest ……….od energii produktów.
4. W 250,0 cm3 roztworu znajduje się 3,5 g wodorotlenku potasu. Stężenie molowe tego roztworu wynosi ……………
5. Na powierzchni wody wapiennej pozostawionej w otwartym naczyniu po pewnym czasie pojawia się warstewka substancji stałej. Sądzisz, że następuje to na skutek reakcji z
A) tlenem.
B) parą wodną.
C) tlenkiem wegla(IV).
D) tlenkiem węgla(IV) i parą wodną.
6. Związek otrzymany w wyniku spalania żelaza w chlorze rozpuszczono w wodzie i zadano roztworem wodorotlenku sodu obserwując wytrącenie się osadu. Osad stanowił
A) FeO. B) Fe2O3. C) Fe(OH)2. D) Fe(OH)3.
7. Które równanie reakcji przedstawia proces zachodzący w ogniwie Mg/Mg2+//Cu2+/Cu ?
A) 2Cu+ + Mg2+ 2Cu2+ + Mg. B) Cu + Mg2+ Cu2+ + Mg.
C) 2Cu + Mg2+ 2Cu+ + Mg. D) Cu2+ + Mg Cu + Mg2+.
8. Proces polegający na łączeniu się wielu cząsteczek organicznych w jedną dużą makrocząsteczkę nazywamy ……………
9. Addycja wody (hydratacja) do pent-1-enu prowadzona w obecności nadtlenków daje:
A) 2-metylobutan-1-ol. B) pentan-3-ol. C) pentan-2-ol. D) pentan-1-ol.
10. Pewien związek organiczny jest substancją słabo rozpuszczalną w wodzie. Ulega reakcji z wodnym roztworem wodorowęglanu sodu oraz reakcjom nitrowania i estryfikacji. Związkiem tym może być
A) benzenol. B) kwas mlekowy. C) kwas winowy. D) kwas benzoesowy.
ZAD. B (0- 10 pkt)
Mieszanina zawiera siarczan(IV) i siarczan(VI) sodu. Odważono dwie próbki po 0,4400 g mieszaniny, rozpuszczono w wodzie i zakwaszono kwasem chlorowodorowym.
Pierwszą próbkę miareczkowano roztworem zawierającym 4,4100 g dichromianu(VI) potasu w 1 dm3, zużywając 21,60 cm3 tego roztworu.
Drugą, po utlenieniu jonów siarczanowych(IV), zadano nadmiarem roztworu chlorku baru. Wytrącony osad po przeprowadzeniu właściwych czynności analitycznych osiągnął stałą masę równą 0,7015 g.
Napisać jonowe i cząsteczkowe równanie reakcji zachodzącej z dichromianem(VI) potasu.
Obliczyć procentową zawartość obu soli w mieszaninie oraz procent zanieczyszczeń.
ZAD. C (0 - 10 pkt)
Poniżej przedstawiono schemat przemian jakim ulega pierwiastek X:
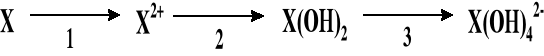
Pierwiastek X tworzy tlenek o wzorze XO, w którym stanowi 80,25%.
Ustalić jaki to pierwiastek.
Zapisać jonowe równania reakcji (1,2,3).
Zaproponować doświadczenie pozwalające zidentyfikować gazowy produkt reakcji 1. Przedstawić rysunek i zapisać obserwację.
Podać jaki charakter kwasowo-zasadowy wykazuje wodorotlenek pierwiastka X? Zapisać odpowiednie jonowe i cząsteczkowe równania reakcji.
ZAD. D (0 - 10 pkt)
Na zmiareczkowanie 100,0 cm3 nasyconego roztworu chlorku ołowiu(II) zużyto 12,70 cm3 nasyconego roztworu azotanu(V) srebra o stężeniu 0,250 mol/dm3. Obliczyć wartość iloczynu rozpuszczalności chlorku ołowiu(II).
ZAD. E (0 - 10 pkt)
1 dm3 roztworu chlorku potasu o stężeniu 1 mol/dm3 poddano elektrolizie z użyciem elektrod platynowych. W czasie 1 h przez elektrolizer przepuszczano prąd o natężeniu 5,07 A.
Obliczyć stężenie molowe chlorku potasu i wodorotlenku potasu po zakończeniu elektrolizy zakładając 100% wydajność prądową.
Podać równania reakcji zachodzących na katodzie i na anodzie oraz określić typy tych reakcji.
Obliczyć objętość wydzielonych gazów w przeliczeniu na warunki normalne.
ZAD. F (0 - 15 pkt)
Toluen (A) reaguje z manganianem(VII) potasu w środowisku obojętnym dając związek B, który po zakwaszeniu tworzy połączenie C. Związek C wchodzi w reakcje zarówno z roztworem wodorowęglanu sodu jak i roztworem wodorotlenku sodu tworząc substancję D, która stosowana jest jako środek konserwujący w przemyśle spożywczym. Związek C ogrzewany z etanolem w środowisku kwaśnym przekształca się w połączenie E o przyjemnym zapachu. Ogrzewanie związku C z dymiącym kwasem azotowym(V) w obecności stężonego kwasu siarkowego(VI) prowadzi do związku F zawierającego 39,62% C, 1,89% H i 13,20 % N.
Zapisać równanie reakcji toluenu z manganianem(VII) potasu.
Obliczyć wzór elementarny oraz określić i uzasadnić wzór rzeczywisty związku F.
Podać wzory strukturalne oraz nazwy systematyczne związków C, D, E i F.
Określić typy reakcji A B, C D, C E, C F.
Obliczyć masę związku E jaka powstanie z 92 g toluenu jeśli wydajności przemian A B, B C i C E wynoszą odpowiednio 60, 90 i 70%.
Wersja II
ZAD. A (0 - 15pkt)
1. W 400 cm3 nasyconego roztworu wodorotlenku miedzi(II) znajduje się 3,4x10-8 mola jonów miedzi(II). Iloczyn rozpuszczalności tego związku wynosi ……………
2. Stosunek masowy siarki do tlenu wynosi 2:3. Tlenek siarki ma wzór ……………
3. W reakcji endoenergetycznej energia substratów jest ………. …od energii produktów.
4. W 250,0 cm3 roztworu znajduje się 5,0 g wodorotlenku sodu. Stężenie molowe tego roztworu wynosi …............
5. W nowoczesnym budownictwie bardzo często wykorzystuje się odpowiednio przygotowane płyty gipsowe. Przerwy między płytami wypełnia się masą szpachlową, której głównym składnikami jest tzw. gips palony o wzorze (CaSO4)2.H2O. Twardnienie masy szpachlowej następuje na skutek
A) odłączania wody.
B) przyłączania wody.
C) przyłączania tlenku węgla(IV).
D) przyłączania tlenku wegla(IV) i wody.
6. Związek otrzymany w wyniku spalania miedzi w chlorze rozpuszczono w wodzie i zadano roztworem wodorotlenku potasu obserwując wytrącenie się osadu. Osad stanowił
A) CuO. B) Cu2O. C) Cu(OH)2. D) CuOH.
7. Które równanie reakcji przedstawia proces zachodzący w ogniwie Zn/Zn2+//Cu2+/Cu ?
A) Cu2+ + Zn Cu + Zn2+. B) Cu + Zn2+ Cu2+ + Zn.
C) 2Cu + Zn2+ 2Cu2+ + Zn. D) 2Cu+ + Zn 2Cu + Zn2+.
8. Proces polegający na łączeniu się wielu cząsteczek organicznych w jedną dużą makrocząsteczkę z wydzieleniem niskocząsteczkowych produktów ubocznych (np. wody, amoniaku) nazywamy .……………
9. Addycja wody (hydratacja) do pent-1-enu prowadzona bez obecności nadtlenków daje:
A) pentan-1-ol. B) pentan-2-ol. C) pentan-3-ol. D) 2-metylobutan-1-ol.
10. Pewien związek organiczny jest substancją słabo rozpuszczalną w wodzie. Nie reaguje z wodnym roztworem wodorowęglanu sodu. Ulega natomiast w odpowiednich warunkach reakcjom nitrowania i estryfikacji. Związkiem tym może być
A) cykloheksanol. B) benzenol. C) kwas mlekowy. D) kwas benzoesowy.
ZAD. B (0- 10 pkt)
Odważono dwie próbki po 0,4000 g mieszaniny zawierającej tlenek żelaza(II) i tlenek żelaza(III). Próbki te rozpuszczono w rozcieńczonym kwasie siarkowym(VI). Pierwszą miareczkowano roztworem zawierającym 5,880 g dichromianu(VI) potasu w 1 dm3 zużywając 17,10 cm3 tego roztworu. W drugiej zredukowano jony żelaza(III) i na zmiareczkowanie zużyto 42,10 cm3 tego samego roztworu dichromianu(VI) potasu.
Napisać jonowe i cząsteczkowe równania reakcji zachodzącej z udziałem dichromianu(VI) potasu.
Obliczyć procentową zawartość obu tlenków żelaza w mieszaninie oraz procent zanieczyszczeń.
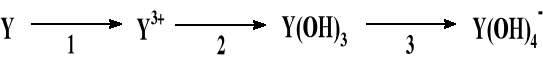
ZAD. C (0 - 10 pkt)
Schemat przedstawia przemiany, którym ulega pierwiastek Y.
Pierwiastek Y tworzy tlenek o wzorze Y2O3, w którym tlen stanowi 47,06%.
Ustalić jaki to pierwiastek.
Zapisać jonowe równania reakcji (1,2,3).
Podać w jaki sposób doświadczalnie można zidentyfikować gazowy produkt reakcji 1. Przedstawić rysunek i zapisać obserwację.
Jaki charakter kwasowo zasadowy wykazuje wodorotlenek pierwiastka Y. Zapisać odpowiednie jonowe i cząsteczkowe równania reakcji.
ZAD. D (0 - 10 pkt)
Na zmiareczkowanie 100,0 cm3 nasyconego roztworu wodorotlenku wapnia zużyto 16,50 cm3 roztworu kwasu chlorowodorowego o stężeniu 0,15 mol/dm3. Obliczyć wartość iloczynu rozpuszczalności wodorotlenku wapnia.
ZAD. E (0- 10 pkt)
2 dm3 roztworu azotanu(V) srebra o stężeniu 0,5 mol/dm3 poddano elektrolizie z użyciem elektrod platynowych. W czasie 1,5 h przez elektrolizer przepuszczano prąd o natężeniu 2,71 A.
1. Obliczyć stężenie molowe azotanu(V) srebra oraz kwasu azotowego(V) po zakończeniu elektrolizy zakładając 100% wydajność prądową.
2. Podać równania reakcji zachodzących na katodzie i na anodzie oraz określić typy tych reakcji.
3. Obliczyć objętość wydzielonego gazu w przeliczeniu na warunki normalne oraz masę wydzielonego metalu.
ZAD. F (0 - 15 pkt)
4-Nitrotoluen (A) reaguje z nadmiarem dichromianem(VI) potasu w środowisku kwasu siarkowego(VI) dając związek B. Związek B wchodzi w reakcje zarówno z roztworem wodorowęglanu sodu jak i roztworem wodorotlenku sodu tworząc substancję C. Związek B ogrzewany z metanolem w środowisku kwaśnym przekształca się w połączenie D o przyjemnym zapachu. Reakcja związku B z siarczanem(VI) żelaza(II) w środowisku amoniaku prowadzi do związku E zawierającego 61,31% C, 5,11% H i 10,22 % N. Związek E można otrzymać również ze związku D drogą dwuetapowej przemiany poprzez związek F.
Zapisać równanie reakcji 4-nitrotoluenu z dichromianem(VI) potasu.
Obliczyć wzór elementarny oraz określić i uzasadnić wzór rzeczywisty związku E.
Podać wzory strukturalne oraz nazwy systematyczne związków B, C, D i E.
Określić typy reakcji A B, B C, B D, B E.
Obliczyć masę związku E jaka powstanie z 137 g związku A jeśli wydajności przemian A B, B D i D E wynoszą odpowiednio 60, 70 i 50%.
DANE:
Masy atomowe: Ag - 108u; Ba - 137u; C - 12u; Cl - 35,5u; Cr - 52u; Cu - 64u; Fe - 56u; H - 1u; K - 39u; N - 14u; Na- 23u; O - 16u; Pb - 207u; S - 32u; Zn - 65u;
Stała Faradaya - 96500 C/mol.
II ETAP
ZAD. A (0 - 10 pkt)
Roztwór I o gęstości 1,115 g/cm3 zawiera tlenek azotu(V) w postaci 30-wodnego hydratu. Roztwór II, którego gęstość wynosi 1,120 g/cm3 zawiera tlenek siarki(VI) w postaci 27-wodnego hydratu. Z roztworów tych pobrano próbki po 5,0 cm3, zmieszano i rozcieńczono wodą w kolbie miarowej do objętości 0,500 dm3.
Obliczyć pH otrzymanego roztworu zakładając całkowitą dysocjację hydratu tlenku siarki(VI).
ZAD. B (0 - 10 pkt)
Do trzech kolbek stożkowych odmierzono po 25,00 cm3 jodu o stężeniu 0,0990 mol/dm3. Następnie do każdej wprowadzono po 10,00 cm3 roztworu zawierającego siarczan(IV) sodu. Na odmiareczkowanie nadmiaru jodu zużyto średnio 19,95 cm3 roztworu tiosiarczanu(VI) sodu o stężeniu 0,1000 mol/dm3. Reakcja jonów tiosiarczanowych(VI) z jodem przebiega zgodnie z równaniem:
2S2O32- + I2 S4O62- + 2I-
Zapisać równanie reakcji zachodzącej pomiędzy jonami siarczanowymi(IV) i jodem.
Obliczyć:
liczbę gramów siarczanu(IV) sodu w dodanej próbce,
stężenie molowe tego roztworu.
ZAD. C (0 - 15 pkt)
Stop miedzi i cynku (mosiądz) poddano analizie na zawartość poszczególnych metali. W tym celu rozpuszczono 4,500 g stopu w rozcieńczonym kwasie azotowym(V) na gorąco, rozcieńczono wodą, przeniesiono ilościowo do kolby miarowej pojemności 250 cm3 i dopełniono wodą do kreski. Z kolby pobierano próbki do analizy. W celu oznaczenia miedzi metodą elektrolityczną odmierzono 50,00 cm3 roztworu z kolby i poddano ją w odpowiednich warunkach elektrolizie stosując siatkową katodę platynową. Proces całkowitego wydzielania miedzi wymagał prowadzenia elektrolizy przez 0,5 godz. prądem o natężeniu 1,08 A (100% wydajności prądowej). Kolejna próbka (25,00 cm3) została w odpowiedni sposób przygotowana do analizy objętościowej z wykorzystaniem EDTA, który tworzy z jonami cynku trwały kompleks w stosunku molowym 1:1. Na odmiareczkowanie jonów cynku w tej próbie zużyto średnio 39,30 cm3 0,05 M EDTA
Zapisać równania reakcji zachodzących podczas rozpuszczania stopu w kwasie azotowym(V) oraz podczas elektrolizy (katoda i anoda).
Na podstawie wyników analiz obliczyć masę miedzi i cynku w oznaczanej próbce oraz ich zawartość procentową w stopie.
ZAD. D (0 - 20 pkt)
Omawiany w szkole najprostszy aldehyd - metanal znajduje liczne zastosowania, o których z braku czasu nie mówi się na lekcjach. Jest to związek o dużym znaczeniu w syntezie organiczej. Stanowi między innymi substrat w otrzymywaniu niektórych leków np. urotropiny. W klasycznej preparatyce organicznej wykorzystuje się go do przedłużania łańcucha węglowego. Metoda ta polega na przekształceniu odpowiedniej fluorowcopochodnej RX w połączenie magnezoorganiczne RMgX, które następnie poddaje się działaniu metanalu. Po zakwaszeniu otrzymanego produktu uzyskuje się odpowiedni alkohol I-rzędowy zawierający o jeden atom węgla więcej niż wyjściowe połączenie:
RX RMgX RCH2OMgX RCH2OH (X = Cl, Br)
Źródłem bezwodnego metanalu w tej metodzie jest poliformaldehyd (paraform), który ogrzany do odpowiedniej temperatury ulega depolimeryzacji.
Podać równanie reakcji rozkładu paraformu.
Zaproponować schemat otrzymywania cykloheksylometanolu z cykloheksanolu, wykorzystując opisaną wyżej metodę. i zapisując odpowiednie wzory strukturalne związków pośrednich.
Zapisać równanie reakcji utleniania cykloheksylometanolu do odpowiedniego kwasu z wykorzystaniem dichromianu(VI) potasu w środowisku wodno-acetonowym z dodatkiem kwasu siarkowego(VI).
Obliczyć masę paraformu poddanego rozkładowi zachodzącemu z 80% wydajnością jeśli do przeprowadzenia syntezy cykloheksylometanolu potrzeba 11,2 dm3 metanalu w warunkach normalnych.
Podać objętość formaliny (30% roztwór metanalu, d= 1,08 g/cm3) jaką teoretycznie można otrzymać z wydzielonego metanalu (zaniedbać zmianę temperatury).
Obliczyć objętość 0,1M roztworu azotanu(V) srebra jaką teoretycznie można otrzymać z uzyskanej formaliny poddając ją w pierwszym etapie próbie Tollensa a następnie rozpuszczając wydzielone srebro w odpowiednim kwasie (wszystkie etapy zachodzą ilościowo). Zapisać wszystkie etapy przemiany metanal azotan(V) srebra w formie odpowiednich równań reakcji.
Wiedząc, że urotropina (C6H12N4) powstaje w wyniku kondensacji metanalu z amoniakiem zapisać równanie reakcji jej otrzymywania, narysować wzór strukturalny leku oraz obliczyć jaką ilość urotropiny można otrzymać z 340 g amoniaku przy 70% wydajności.
ZAD. E (0 - 15 pkt)
Dulcyna jest związkiem około 250 razy słodszym od sacharozy i stosowana była dawniej jako słodzik. Została wycofana z użycia ze względu na przekształcanie się jej w organiźmie w niebezpieczny dla zdrowia 4-aminofenol.
Analiza elementarna dulcyny (związek C) wykazuje obecność 60,00% C, 6,67%H i 15,56%N. Otrzymuje się ją ze związku A (57,49%C, 5,39%H i 8,38%N) drogą redukcji wodorem do połączenia B, które następnie poddaje się kondensacji z azotanem(V) mocznika.
Na podstawie podanych informacji:
Podać wzory sumaryczne i strukturalne związków A, B i C oraz przedstawić sposób rozumowania.
Nazwać związki A i B.
Zapisać równanie reakcji i podać wzór strukturalny fenacetyny (D), która powstaje z substancji B pod wpływem działania bezwodnika kwasu octowego.
DANE:
Masy atomowe: Ag - 108u; C - 12u; Cu - 64u; H - 1u; I - 127u; N - 14u; Na - 23u; O - 16u; S - 32u; Zn -65u;
Stała Faradaya - 96500 C/mol.
Wyszukiwarka
Podobne podstrony:
zadania konkurs Swinarskiego zad07 08
zadania konkurs Swinarskiego XLII konkurs chemiczny zadania
zadania konkurs Swinarskiego, ZAD38, UNIWERSYTET MIKOŁAJA KOPERNIKA
46 Olimpiada chemiczna Etap I Zadania teoretyczne
52 Olimpiada chemiczna Etap III Zadania teoretyczne
54 Olimpiada chemiczna Etap I Zadania teoretyczne
48 Olimpiada chemiczna Etap II Zadania teoretyczne
52 Olimpiada chemiczna Etap II Zadania teoretyczne id (2)
49 Olimpiada chemiczna Etap II Zadania teoretyczne
51 Olimpiada chemiczna Etap III Zadania teoretyczne
46 Olimpiada chemiczna Etap II Zadania teoretyczne
54 Olimpiada chemiczna Etap II Zadania teoretyczne
51 Olimpiada chemiczna Etap II Zadania teoretyczne
zadania teoretyczne informax, informatyka
49 Olimpiada chemiczna Etap III Zadania teoretyczne
48 Olimpiada chemiczna Etap I Zadania teoretyczne
46 Olimpiada chemiczna Etap III Zadania teoretyczne
53 Olimpiada chemiczna Etap II Zadania teoretyczne
Hodowle 2014 zadania teoretyczn Nieznany
więcej podobnych podstron