98.04.02
Maciej Cierpucha
Wydział Chemiczny
Laboratorium z chemii fizycznej
ćwiczenie Nr 43
Temat: „Miareczkowanie konduktometryczne”
Maciej Cierpucha
Wydział Chemiczny
kurs magisterski
Nr grupy dziekańskiej 1
Zagadnienia teoretyczne
Podczas miareczkowania roztworu elektrolitu w punkcie równo-ważnikowym (jest to taki punkt miareczkowania, w którym ilość dodanego odczynnika miareczkującego jest chemicznie równoważna ilości substancji miareczkowanej) występuje wyraźna zmiana przewodnictwa tego roztworu. Największe zmiany przewodnictwa obserwuje się podczas miareczkowania mocnych kwasów (np. HCl) mocnymi zasadami (np. NaOH), lub odwrotnie.
Mocne elektrolity - są to elektrolity, które w roztworach o skończonych stężeniach są całkowicie zdysocjowane, a w fazie stałej sieć krystaliczną tworzą jony, a nie obojętne cząsteczki.
Dodając NaOH do roztworu HCl, w wyniku reakcji:
bardzo ruchliwe jony wodorowe (λ18H+ = 315) zostają zastępowane przez znacznie mniej ruchliwe jony sodowe (λ18Na+ = 43). Ponieważ przewodnictwo właściwe k (jest to przewodnictwo roztworu znajdującego się pomiędzy dwiema równoległymi elektrodami, o powierzchni jednostkowej, odległymi od siebie o jednostkę długości) zależy od stężenia i ruchliwości jonów (jest to stosunek prędkości jonu do natężenia pola elektrycznego, w którym znajduje się jon) w roztworze:
przewodnictwo miareczkowanego roztworu maleje aż do momentu zobojętnienia (punktu równoważnikowego). Dalsze dodawanie odczynnika miareczkującego (NaOH) powoduje wzrost przewodnictwa, ponieważ pojawiają się ruchliwe jony OH- (λ18 = 174), a także zwiększa się ogólna liczba jonów
w roztworze.
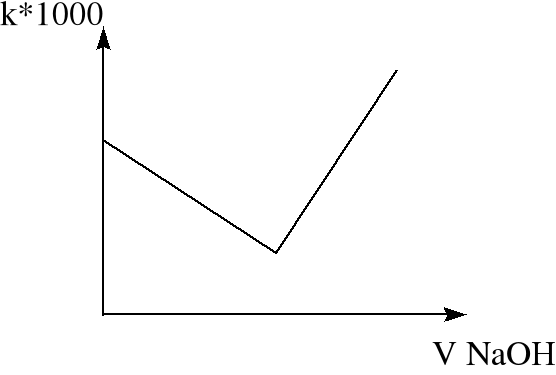
Zależność przewodnictwa właściwego roztworu mocnego kwasu od objętości dodanej zasady może obrazować wykres:
Tabele pomiarowe
ml kwasu |
przewodnictwo |
|
|
Obliczenia
Na podstawie wartości zawartych w tabeli pomiarowej sporządzono wykres zależności przewodnictwa roztworu od objętości dodanego kwasu (kwas 0,1n).
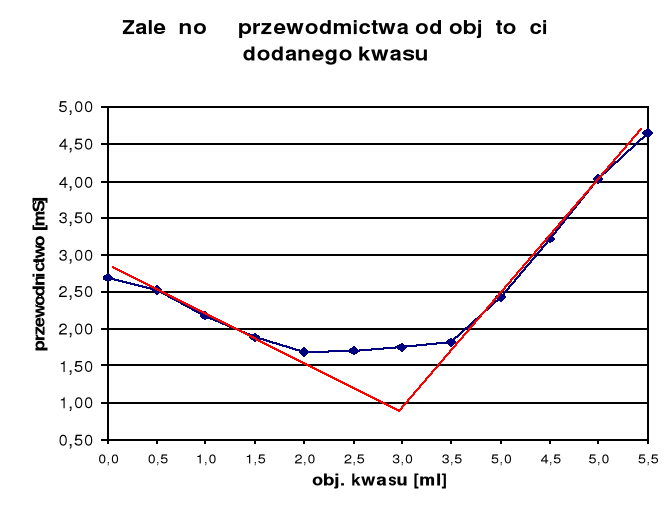
Z wykresu można odczytać, że punkt zobojętnienia nastąpił po dodaniu 2,95 ml kwasu. Tak więc liczba moli kwasu potrzebna do zobojętnienia zasady wynosi:
![]()
W związku z tym że, jony są jednowartościowe to liczba moli jest zarazem gramorównoważnikiem.
Z liczby moli zasady (NaOH) można obliczyć jej masę:
![]()
Wnioski
Opierając się na fakcie, że otrzymane przeze mnie wartości przewodnictwa roztworu, podczas miareczkowania jednego elektrolitu drugim, dość dobrze spełniają teoretyczną liniową zależność (przewodnictwo zmienia się liniowo wraz z objętością dodanego kwasu), można przypuszczać, że otrzymana przeze mnie masa NaOH jest bliska rzeczywistej zawartości czystego wodorotlenku w wyjściowym roztworze.
Charakterystyczną cechą otrzymanej przeze mnie krzywej miareczko-wania jest to, że posiada ona większy kąt nachylenia po punkcie równoważnikowym niż przed nim. Jest to prawdopodobnie spowodowane tym, że po punkcie równoważnikowym w nadmiarze pojawiają się jony, które są
o wiele bardziej ruchliwe, niż te, które były w nadmiarze przed tym punktem (λ18H+ = 315, λ18OH- = 174).
Wyszukiwarka
Podobne podstrony:
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 27(26) v Ma$ka kin, 97
KOND43 v Ma$ka, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz I
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, 131 vigor, 97
chemia fizyczna laboratoria, 52, 97
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 16Ania, ffffff
więcej podobnych podstron