22434 skanuj0143 (9)
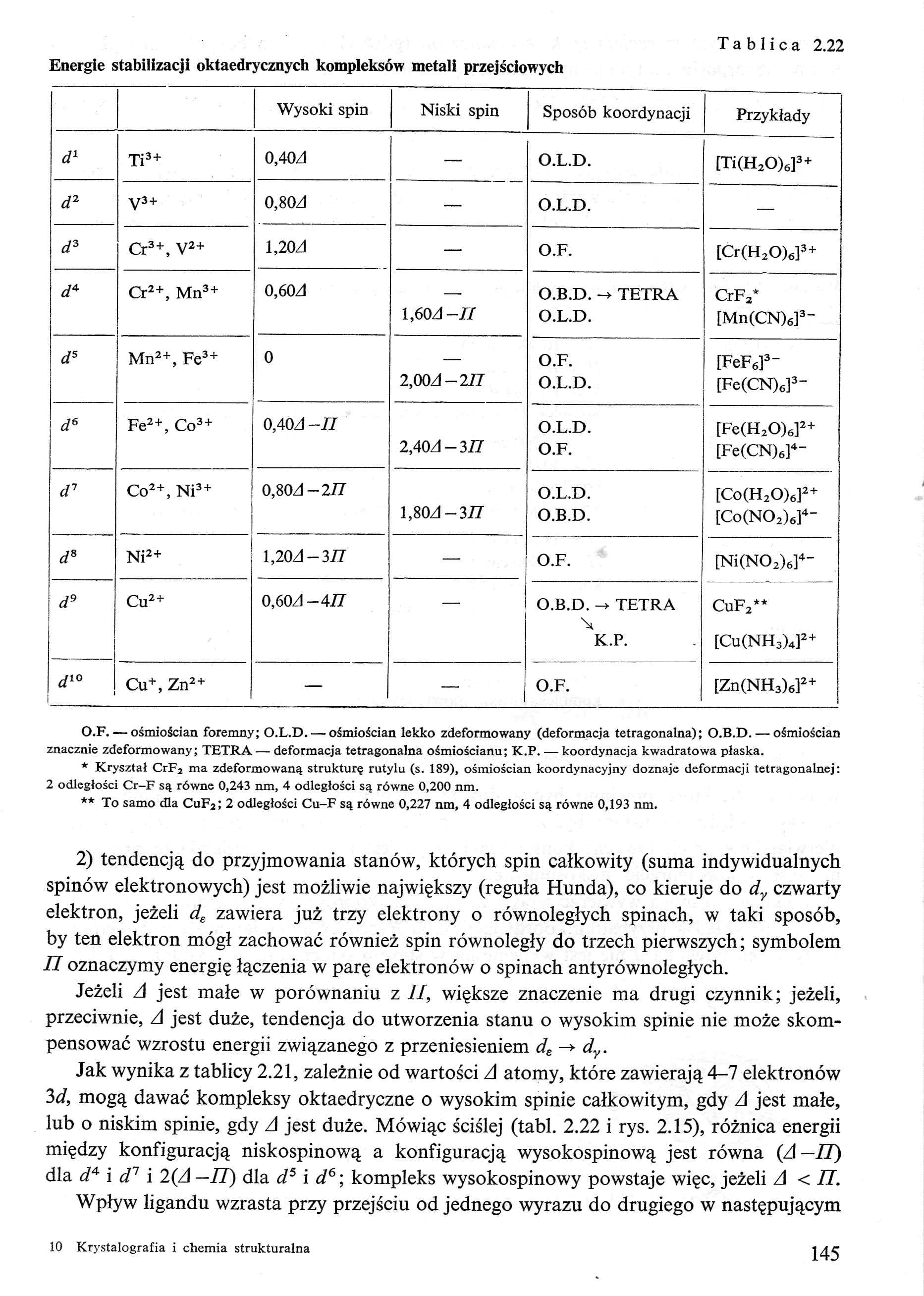
Tablica 2.22
Energie stabilizacji oktaedrycznych kompleksów metali przejściowych
|
Wysoki spin |
Niski spin |
Sposób koordynacji |
Przykłady | ||
|
d1 |
Ti3+ |
0,404 |
— |
O.L.D. |
[Ti(H20)6]3+ |
|
d2 |
V3+ |
0,804 |
— |
O.L.D. |
— |
|
d3 |
Cr3+, V2+ |
1,204 |
— |
O.F. |
[Cr(H20)6]3+ |
|
d4 |
Cr2+, Mn3+ |
0,604 |
l,60d -77 |
O.B.D. -> TETRA O.L.D. |
CrF2* [Mn(CN)6]3- |
|
d5 |
Mn2+, Fe3+ |
0 |
2,004-227 |
O.F. O.L.D. |
[FeF6]3- [Fe(CN)6]3- |
|
d6 |
Fe2+, Co3+ |
0,404 -n |
2,404-327 |
O.L.D. O.F. |
[Fe(H20)6]2+ [Fe(CN)6]4' |
|
d7 |
Co2+, Ni3+ |
0,804 - 227 |
1,804 - 327 |
O.L.D. O.B.D. |
[Co(H20)6]2+ [Co(N02)6]4" |
|
d8 |
Ni2+ |
1,204-327 |
— |
O.F. |
[Ni(N02)6]4' |
|
d9 |
Cu2+ |
0,604 - 427 |
— |
O.B.D. -► TETRA \ K.P. |
CuF2** [Cu(NH3)4]2+ |
|
d10 |
Cu+, Zn2+ |
— |
— |
O.F. |
[Zn(NH3)6]2+ |
O.F. — ośmiościan foremny; O.L.D. — ośmiościan lekko zdeformowany (deformacja tetragonalna); O.B.D.— ośmiościan znacznie zdeformowany; TETRA— deformacja tetragonalna ośmiościanu; K.P. — koordynacja kwadratowa płaska.
* Kryształ CrF2 ma zdeformowaną strukturę rutylu (s. 189), ośmiościan koordynacyjny doznaje deformacji tetragonalnej: 2 odległości Cr-F są równe 0,243 nm, 4 odległości są równe 0,200 nm.
** To samo dla CuF2; 2 odległości Cu-F są równe 0,227 nm, 4 odległości są równe 0,193 nm.
2) tendencją do przyjmowania stanów, których spin całkowity (suma indywidualnych spinów elektronowych) jest możliwie największy (reguła Hunda), co kieruje do dv czwarty elektron, jeżeli d€ zawiera już trzy elektrony o równoległych spinach, w taki sposób, by ten elektron mógł zachować również spin równoległy do trzech pierwszych; symbolem 77 oznaczymy energię łączenia w parę elektronów o spinach antyrównoległych.
Jeżeli A jest małe w porównaniu z 77, większe znaczenie ma drugi czynnik; jeżeli, przeciwnie, A jest duże, tendencja do utworzenia stanu o wysokim spinie nie może skompensować wzrostu energii związanego z przeniesieniem de-+ dy.
Jak wynika z tablicy 2.21, zależnie od wartości A atomy, które zawierają 4-7 elektronów 3d, mogą dawać kompleksy oktaedryczne o wysokim spinie całkowitym, gdy A jest małe, lub o niskim spinie, gdy A jest duże. Mówiąc ściślej (tabl. 2.22 i rys. 2.15), różnica energii między konfiguracją niskospinową a konfiguracją wysokospinową jest równa (A— 77) dla d4 i d7 i 2(A —77) dla d5 i d6; kompleks wysokospinowy powstaje więc, jeżeli A < 77.
Wpływ ligandu wzrasta przy przejściu od jednego wyrazu do drugiego w następującym
145
10 Krystalografia i chemia strukturalna
Wyszukiwarka
Podobne podstrony:
skanuj0007 Tablica 22. Charakterystyka i ocena strategii produktu na dotychczas obsługiwanym
28. Azamakrocykliczne kompleksy metali przejściowych jako elektroaktywne elementy strukturalne do
SDC10088 Przejścia typu d-d Dotyczą elektronów d w kompleksach metali przejściowych np. 29Cu 1
skanuj0023 (109) 22 Budownictwo przyjazne środowisku naturalnemu Późniejsze wykorzystanie energii sł
71576 skanuj00010 (2) Tablica 2. Energia wydatkowana przy zajęciach domowych wg J.Dumina i R.Passmor
więcej podobnych podstron