52944 skanuj0186 (7)
byłby więc czynnik chemiczny g, natomiast czynnik przestrzenny r+ \r_ odgrywałby rolę j edynie w przypadku wyboru między typami NaCl i CsCl; ten ostatni typ struktury pojawia się tylko wyjątkowo.
W konkluzji, można stwierdzić, że chociaż teoria chemiczna umożliwia przewidywanie dokładniejsze niż teoria geometryczna, te dwie teorie nie są z sobą sprzeczne. Istotnie, czynniki chemiczny i przestrzenny nie są zmiennymi całkowicie niezależnymi: występuje między nimi pewna korelacja. Również stosunek promieni jonowych jest ze względu na swą prostotę bardzo dogodnym punktem wyjścia w rozważaniach dotyczących struktury kryształów jonowych.
B. Związki MX2
W przypadku związków MX2 nie można sformułować reguł tak prostych jak te, które umożliwiły powiązanie trzech głównych typów struktury kryształów MX ze stosunkiem promieni jonowych. Mimo to można stwierdzić, że stosunki większe niż 0,73, pośrednie
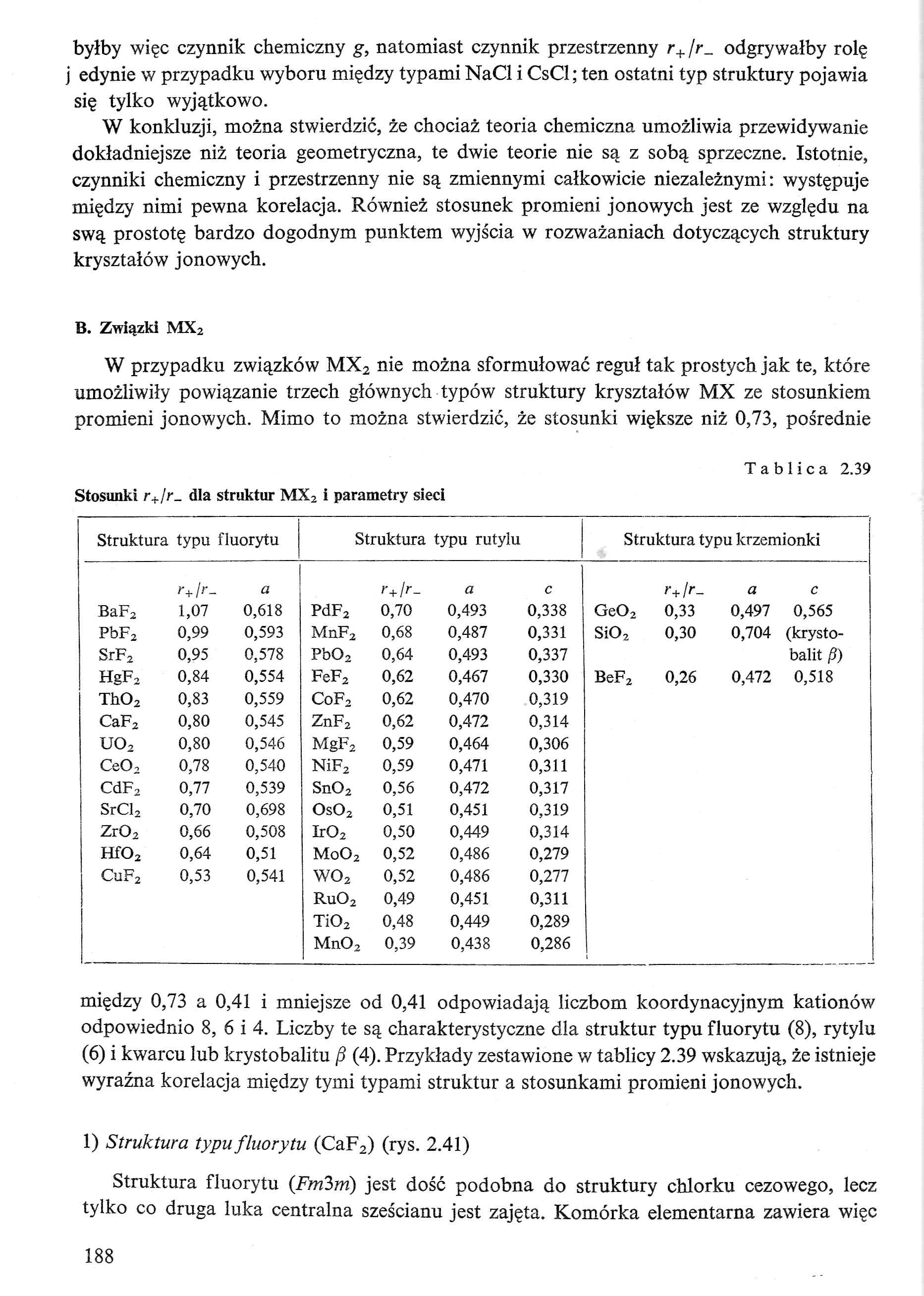
Tablica 2.39
Stosunki r+/r_ dla struktur MX2 i parametry sieci
|
Struktura typu fluorytu |
Struktura typu rutylu |
Struktura typu krzemionki | |||||||
|
a |
r+/r- |
a |
c |
r+/r_ |
a c | ||||
|
BaF2 |
1,07 |
0,618 |
PdF2 |
0,70 |
0,493 |
0,338 |
Ge02 |
0,33 |
0,497 0,565 |
|
PbF2 |
0,99 |
0,593 |
MnF2 |
0,68 |
0,487 |
0,331 |
Si02 |
0,30 |
0,704 (krysto- |
|
SrF2 |
0,95 |
0,578 |
Pb02 |
0,64 |
0,493 |
0,337 |
balit fi) | ||
|
HgF2 |
0,84 |
0,554 |
FeF2 |
0,62 |
0,467 |
0,330 |
BeF2 |
0,26 |
0,472 0,518 |
|
Th02 |
0,83 |
0,559 |
CoF2 |
0,62 |
0,470 |
0,319 | |||
|
CaF2 |
0,80 |
0,545 |
ZnF2 |
0,62 |
0,472 |
0,314 | |||
|
uo2 |
0,80 |
0,546 |
MgF2 |
0,59 |
0,464 |
0,306 | |||
|
Ce02 |
0,78 |
0,540 |
NiF2 |
0,59 |
0,471 |
0,311 | |||
|
CdF2 |
0,77 |
0,539 |
Sn02 |
0,56 |
0,472 |
0,317 | |||
|
SrCl2 |
0,70 |
0,698 |
Os02 |
0,51 |
0,451 |
0,319 | |||
|
Zr02 |
0,66 |
0,508 |
Ir02 |
0,50 |
0,449 |
0,314 | |||
|
Hf02 |
0,64 |
0,51 |
Mo02 |
0,52 |
0,486 |
0,279 | |||
|
CuF2 |
0,53 |
0,541 |
wo2 |
0,52 |
0,486 |
0,277 | |||
|
Ru02 |
0,49 |
0,451 |
0,311 | ||||||
|
Ti02 |
0,48 |
0,449 |
0,289 | ||||||
|
Mn02 |
0,39 |
0,438 |
0,286 | ||||||
między 0,73 a 0,41 i mniejsze od 0,41 odpowiadają liczbom koordynacyjnym kationów odpowiednio 8, ó i 4. Liczby te są charakterystyczne dla struktur typu fluorytu (8), rytylu (6) i kwarcu lub krystobalitu fi (4). Przykłady zestawione w tablicy 2.39 wskazują, że istnieje wyraźna korelacja między tymi typami struktur a stosunkami promieni jonowych.
1) Struktura typu fluorytu (CaF2) (rys. 2.41)
Struktura fluorytu (Fm3m) jest dość podobna do struktury chlorku cezowego, lecz tylko co druga luka centralna sześcianu jest zajęta. Komórka elementarna zawiera więc
188
Wyszukiwarka
Podobne podstrony:
skanuj0164 (3) Tak więc jeden i len sam produkt można osiągnąć przy różnym zestawie dwóch czynników
skanuj0019 (194) 6.2. Wpływ czynników antropogenicznych na przyrodę Polski 229 W niektórych regionac
skanuj0021 (166) 6.2. Wptyw czynników antropogenicznych na przyrodę Polski 6.2. Wptyw czynników antr
skanuj0023 (149) 6.2. Wpływ czynników antropogenicznych na przyrodę Polski Marek Ostrowski &nb
więcej podobnych podstron