76071 img087
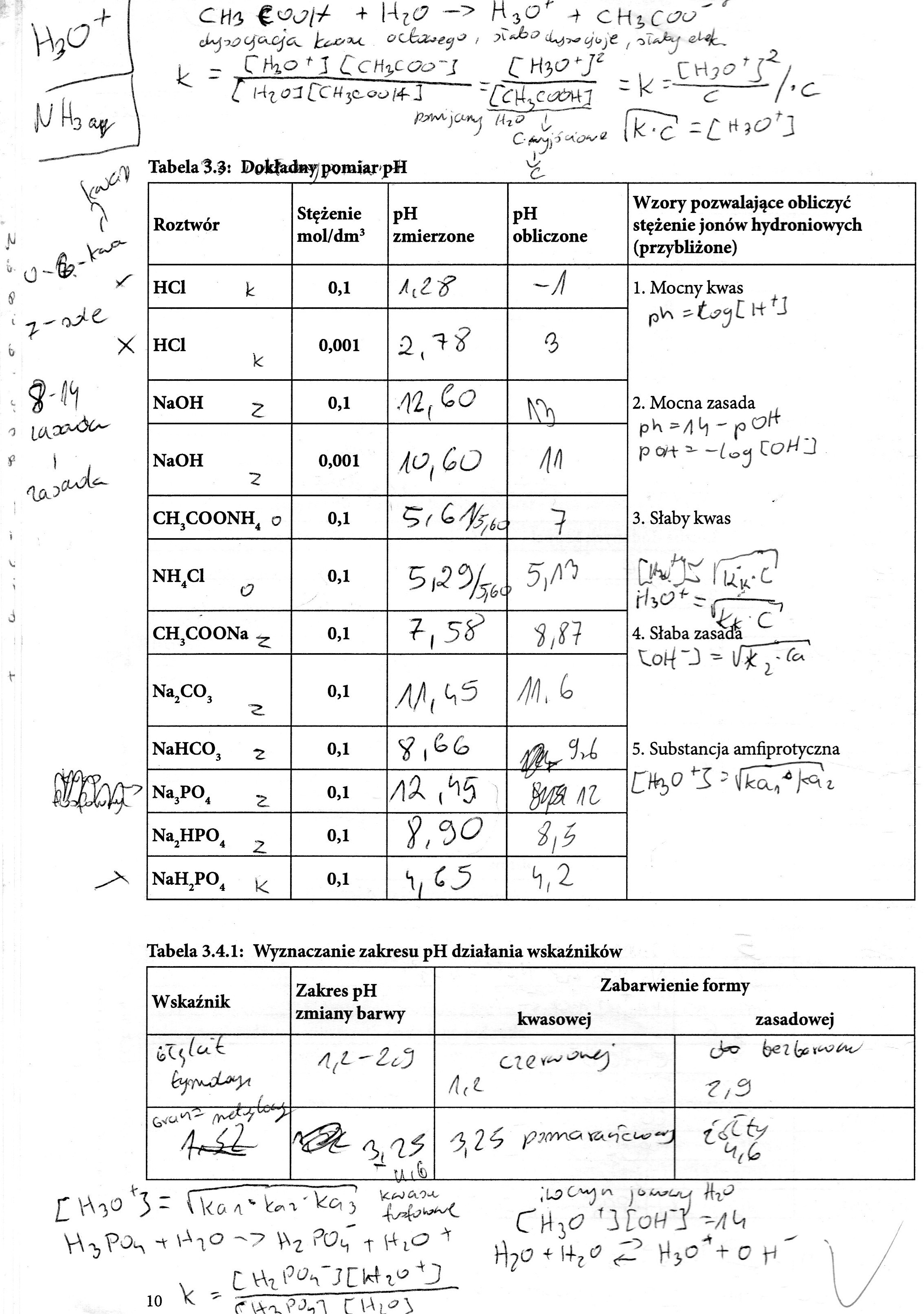

Tabela 3.3: Dpkładnypomiar pH
<T J ft^a0^/4 j Cc^Hj “ ,^'
C-
l?>WLjCŁA-j /-j.j
<? ,/
i>
W

C'|Wj,>
Ś^ÓCs-'
|
Roztwór |
Stężenie mol/dm3 |
pH zmierzone |
pH obliczone |
Wzory pozwalające obliczyć stężenie jonów hydroniowych (przybliżone) | |
|
HC1 |
k |
0,1 |
A,lt |
~H |
1. Mocny kwas pw 'Oyl H" 3 |
|
HC1 |
k |
0,001 |
2 ii **■ < | ||
|
NaOH |
0,1 |
AlfZ>0 |
K>\ |
2. Mocna zasada p K — /I bj - jO C?n p CH ^ ~(o^ CC?^3 | |
|
NaOH |
2 |
0,001 |
Ąo^ GO |
/M | |
|
ch3coonh4 0 |
0,1 |
7 |
3. Słaby kwas | ||
|
NH Cl 4 |
O |
0,1 |
5/5%, |
, 5,/rt |
0^ tuV? rli° 'Oc1 4. Słaba zasada ^Oh[ J - i^F^ET |
|
CH3COONa , |
0,1 |
7,5^ |
W? | ||
|
Na2C03 |
Z. |
0,1 |
Mi. b | ||
|
NaHC03 |
"2 |
0,1 |
V,<^ |
#r^ |
5. Substancja amfiprotyczna |
|
Na PO 3 4 |
Z |
0,1 |
/)2 ^5 | ||
|
Na.HPO, 2 4 |
Z |
0,1 |
f.w | ||
|
NaH.PO, 2 4 |
K |
0,1 |
\, 0 |
*1,2 | |
Tabela 3.4.1: Wyznaczanie zakresu pH działania wskaźników
|
Wskaźnik |
Zakres pH zmiany barwy |
Zabarwienie formy kwasowej zasadowej | |
|
Ct£ A(t | |||
|
^ 3,7* _~ n ifo |
/y 2 Ćj pjcrv\o |
CO 0 ( Cs | |
£ v\^o 3 - ruT, ^ Vt*^'
VC^ (X9-*~
\\^po^ -r Kyo \\2 t * * * r\A'L^\”
+ '+1^ <*-
o
10

Wyszukiwarka
Podobne podstrony:
img087 Tabela 6.10 Wyniki doświadczenia z dwoma środkami owadobójczymi Środek A Środek
kosmetyka12 C 0(7 CL n o, i 10n i O hJ Cc * 61 o f Lcl K) v n o Coi o n oJu/ycUn e 6u boi cm c be fc
31587 Kwas zas1258 TABELA 34-3. Stężenie jonów H+ ([H+]) oraz pH płynów biologicznych Płyn pH [HJ
Tabela kompaktybilności 8 75 PDA & PNA (WM, WINCE) 7.9XX Maps 875.3669 I yes YES Hj Maps 875.
skanuj0009 (394) »§!S!iSBSaas f. NiKclzutła-naibufccrie Grant-ujemner Estnl MWankomycyua £ Streptomy
więcej podobnych podstron