58355 IMGX00 (3)

5
5.1.5. Stany elektronowe w molekułach
Ruch elektronów w atomie odbywa się w polu elektrycznym jądra o symetrii kulistej. Nie ma więc w atomie wyróżnionego kierunku pola, który powodowałby kwantowanie momentu pędu. W molekule natomiast pole elektryczne jąder im wyróżnione kierunki pokrywające się z liniami łączącymi jądra.
W molekule dwuatomowej elektrony znajdują się w polu elektrycznym o symetrii osiowej. Podobnie jak w atomach pod wpływem pola zewnętrznego, w molekułach pod wpływem pola ich jąder następuje precesja wektora orbitalnego momentu pędu L wokół osi molekuły, jak to pokazano na rys. 5.4. Wskutek przestrzennego zorientowania (por. rys. 5.2) składowa L wzdłuż kierunku pola przybiera wartości ML = L, L- 1, L-2, .... -L. W polu elektrycznym energie poziomów +A(ł i —Ml są jednakowe. Wprowadzamy więc nową liczbę kwantową A = \ML\, która określa kwantowanie orbitalnego momentu pędu elektronów w molekule. Według przyjętej zasady do opisu stanów elektronowych w molekułach stosuje się litery greckie, pozostawiając litery łacińskie do oznaczania stanów w atomach [wzór (54)].
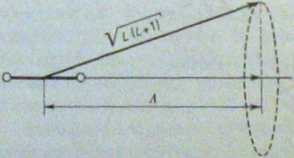
Rys. S.4. Precesja momentu pędu L względem co molekuły dwuatomowej. Składowa momentu pęd, L wzdłuż osi molekuły wynosi 'Ah, przy czym kwitowa liczba A — 0,1,2,.... L
Kwantowa liczba A może przyjmować następujące wartości:
0 12 3 4 Z n A <P r
A =
termy elektronowe w molekule
Każdej wartości L odpowiada w molekule L+ 1 termów A o różnej energii Termy A £ 0 są dwukrotnie zdegenerowane, każdy z nich zawiera dwa poziomy + MŁ i — Ml o jednakowej energii.
Podobnie jak w atomie, spiny elektronów w molekule dodają się wektorowa, tworząc spin wypadkowy S. Pole elektryczne nie działa na spin 5, dlatego w termach Z spin nie ma wyróżnionych orientacji. Inaczej jest w termach A # 0, tzn. w termach fj, A, <P, ..., w których orbitalny ruch elektronów wywołuje powstanie pob magnetycznego w kierunku osi molekuły, a pole to powoduje orientację spins 5 w myśl reguł kwantowania momentu pędu. Rzut 5 na oś roiędzyjądrową możt przyjmować wartości MJi, czyli 2S + 1 wartości
m,^s, s-t, s - 2, .... ~s • m
Wielkość 2S + 1 jest nmltipletowością termo elektronowego. Termowi Z przypis je się również muitipletowość, przejawia się ona bowiem m.in. w postaci nt-| szczepienia termu Z, jeżeli molekuła wykonuje rotacje. Term singletowy oznaczt sparowanie wszystkich elektronów w molekule. Term dubletowy jest charaktery
styczny m.in. dla rodników, które mają jeden niesparowany elektron. Term 5.1 trypletowy charakteryzuje molekuły mające dwa niesparowane elektrony (np. mole-kuta tlenu, Oz, w podstawowym stanie elektronowym).
Wektorowe zsumowanie rzutów orbitalnego (/l) i spinowego (M,) momentu pędu daje wypadkowy całkowity rzut momentu pędu ii
+ | (5.10)
Wielkość Ci zaznaczamy prawym dolnym indeksem przy symbolu termu. Multipletowość termu zaznaczamy lewym górnym indeksem. Mamy więc symbole termów 'L0, 2ni/2, 3/7,, ad5/J.
Oprócz opisanych wyżej liczb kwantowych w klasyfikacji termów elektronowych w molekule dużą rolę odgrywają właściwości symetrii funkcji falowych, które są związane z symetrią molekuły. Szczególnie ważne w przypadku molekuły liniowej jest stwierdzenie, czy funkcja falowa zmienia znak przy operacji odbicia w płaszczyźnie symetrii przechodzącej przez oś molekuły. Term £ o funkcji symetrycznej (nie zmieniającej znaku) oznacza się a o funkcji antysymetrycznej (zmieniającej znak) oznacza się E ~.
Ważne jest również w przypadku molekuł mających środek symetrii, czy zmienia się znak. funkcji falowej przy odbiciu w środku symetrii. Funkcje symetryczne względem .środka symetrii oznacza się dolnym prawym indeksem g, np. Er flp funkcje ąntysymetryczne natomiast oznaczane są indeksem u, np. f1r Należy przy tym zaznaczyć, że w odróżnieniu od termów oscylacyjnych (rozdział 3) w termach elektronowych chodzi o środek symetrii ładunków jąder, a nie o masy jąder; np. zarówno molekuła tlenu ,60,60 jak i l6OuO ma z punktu widzenia termów elektronowych środek symetrii. Termy z indeksem g nazywają się termami parzystymi, a z indeksem u nieparzystymi (niem. gerade i tmgerade).
Warto podkreślić, że elektrony na zamkniętych powłokach mają wszystkie wypadkowe liczby kwantowe równe zeru, rozpatrujemy więc w molekułach tylko konfiguracje elektronów walencyjnych.
Z orbitali atomowych s, p, d, ... powstają orbitale molekularne. W polu elektrycznym jąder następuje zróżnicowanie orbitali p i d, jak to pokazano na rys. 5.3. O zróżnicowaniu decyduje rzut wektora I na oś molekuły, który jest określony magnetyczną liczbą kwantową m,. Dla orbitali molekularnych wprowadzamy symbol ż = |m,|, analogicznie do wzoru (5,8), i oznaczamy różne wartości i małymi literami greckimi
ż « 0 12
orbital molekularny o n 6 (5.11)
Symbole <r, n, 6 określają orbitale elektronów walencyjnych w molekule. Jeżeli na rys. 5.3 oś z utożsamimy z międzyjądrową osią molekuły, to orbital s stanie się orbitalera a, orbitale p staną się odpowiednio: p„ — a, px~ n,pf — n, gdyż w przypadku Pt * = I%1 =* 0. a w przypadku px i pf i - (mj =1. W przypadku elektronów d mamy: dt> =. o. d„ = n,
Wyszukiwarka
Podobne podstrony:
* Mini wykład. - RUCH- to względne, odbywające się w czasie przemieszczenie się ci
DSC00981 (13) V widu zwierząt ruch płynów ustrojowych odbywa się U^RT istnieniu wyspecjalizowan
Dj5 stany elektronowe: procesy promieniste: GS - stan podstawowy- A - absorpcja Si - stany singlet
Budowa materiiLiczby kwantowe i zakaz Pauliego - elektron w atomie może się znajdo
Dj5 stany elektronowe: procesy promieniste: GS - stan podstawowy- A - absorpcja Si - stany singlet
A270603 4. Zakaz Paułiego dotyczy cząstek... w atomie, ponieważ elektrony w atomie muszą się różnić
46535 Wagony kolejowe i hamulce (233) Wywoływanie sygnałów w elektrycznych obwodach sterowania odbyw
IMGp88 elektronów w powłoce znajdującej się dalej od jądra? ■ W której powłoce liczba elektronów jes
fizyka 3 (2pkt) JO. Czy prawdą Jest, że tor naładowanej cząstki, poruszającej się w polu elektryczny
Oczyszczenie surówki odbywa się w piecach elektrycznych. Najczęściej używa się pieców elektrodowych
REKRUTACJA KROK PO KROKU Rekrutacja na Politechnikę Białostocką odbywa się drogą elektroniczną. Syst
jak w badaniach konwencjonalnych, z tym że przemieszczanie wiązki odbywa się elektronicznie bez fizy
Tworzenie się tego związku odbywa się kosztem stężenia kwasu siarkowego w elektrolicie. W przypadku
Spawanie metodą MIG odbywa się za pomocą łuku elektrycznego, jarzącego się między elektrodą topliwą
więcej podobnych podstron