231
gdzie:
y - przewodnictwo właściwe elektrolitu.
USgf | tego, że gęstosć prądu w danym elektrolicie jest wprost proporcjonalna do natężenia zewnętrznego pola elektrycznego działającego na jony tego elektrolitu.
Jeżeli podejść do ruchu jonów w elektrolicie w sposób ogólny, to należy uwzględnić ich masę. Pojawi się wtedy jeszcze jedna siła — siła bezwładności. W takim przypadku na jon będą działać trzy siły:
d2x dt2
a) siła bezwładności FB =m a = m
dx
dt
b) siła oporu ośrodka FT =bv — b
c) siła pola elektrycznego FE-N eE.
Ruch jonu w elektrolicie będzie ruchem jednostajnym, a zatem musi być spełniony warunek:
Fb+Ft -Fe
czyli ogólne równanie ruchu jonu będzie następujące:
m fl|C& ^ =
dt2 dt
Moza stwierdzić, że ruch jonu w elektrolicie jest opisany przez niejednorodne równanie różniczkowe stopnia drugiego. Wyrażenie na prędkość jonu w elektrolicie otrzymane z powyższego równania ma postać:
1 —exp
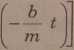
gdzie:
t - czas,
b - współczynnik oporu ośrodka.
Przepływowi prądu przez roztwory elektrolitów (tzn. roztwory kwasów, zasad i soli) towarzyszy wydzielanie się rozpuszczonych w nich substancji. Zjawisko to nosi nazwę elektrolizy. Przebieg zjawiska elektrolizy wyjaśnia teoria Arrheniusa.
Jeżeli źródło prądu przyłączymy do zanurzonych w roztworze płytek, zwanych elektrodami, to ruch jonów zostanie uporządkowany, dodatnie J°ny, tzw. kationy, przesuwają się do katody, ujemne zaś, tzw. aniony do anody.
Wyszukiwarka
Podobne podstrony:
P1050432 II. POJĘCIA PODSTAWOWE 37 Przewodnictwo właściwe elektrolitów jest mniejsze niż przewodnict
1. co to jest: a)przewodnictwo właściwe elektrolitów, b)przewodiiictwo
59935 img140 (17) 29) :przewodnictwo.Vłaściwe elektrolitu jest równe: .-a) odwrotności oporu właści
skanuj0087 174 piawo Ohma, a opór właściwy elektrolitu jest dużo większy od oporu właściwego elektro
BEZNA~21 Rozwiązanie. Wskutek tego, że źródło prądu było włączone przez 1 s obwód znajdował się w st
miejscach, gdzie natężenie pola elektrycznego jest największe, następuje koncentracja zanieczyszczeń
Oblicz szerokość błyskawicy, jeśli wiesz że gęstość liniowa ładunku ujemnego jest równa -2,5xlO 3c/m
historia sztukib5�01 Rzymski styl wystawny 79 : zyczynia się również do tego, że „ciału radyf‘ styl
DSCN7054 W ogólnym przypadku, nawet wtedy, gdy nie ma żadnych przewodników, siła elektromotoryczna j
skanuj0087 I /4 l«;iwo Ohma, a opór właściwy elektrolitu jest dużo większy od oporu właściwego elekt
Prawo i p k s V Konarska Wrzosek (100) Brak przesłanki szczególnej pozytywnej powoduje, że rozpozn
P1120603 [1024x768] W zakresie niskich stężeń elektrolitu wzrost przewodnictwa właściwego ze stężeni
4.2 Ćwiczenia Ćwiczenie 1 Udowodnij, że y = p • g, gdzie: y - ciężar właściwy, p - gęstość, g -
więcej podobnych podstron