CCF20081202�005

Ćwiczenie 2.2. Mycie i suszenie szkła laboratoryjnego. ■ „ /,aivŁuu~. ~~ *------
Wymyć szkło za pomocą szczotki gorącą wodą z dodatkiem płynu „Ludwik” i baił l'11 -tlów, a mi IDO WICI we w
dokładnie wypłukać w wodzie bieżącej, a następnie w wodzie destylowanej. Nastał preparaty p r z y z y C l 5 suszarkę na temperaturę 60 *C i wysuszyć w niej umyte szkło.
W zależności od kierunku badań wykonuje się różne rodzaje
których obserwuje się drobno-
Ćwiczenie 2.3. Wyjaławianie naczyń szklanych oraz sprzętu metalowego
I
Wyjaławianie szkła w suszarce. Przygotowane szkło do sterylizacji umieścić w susi ce. Temperaturę w suszarce podnieść stopniowo do 180"C i utrzymać przez 2 hi momentu jej osiągnięcia. Po ostygnięciu wyjałowione szkło wyjąć z suszarki i przeclj wywać w szafie przeznaczonej specjalnie do tego celu.
Wyjaławianie szkła w autoklawie. Przed uruchomieniem autoklawu wlać do ni wodę do poziomu dziurkowanego wkładu, na którym ustawić następnie przygotoj ne szkło. Korki z waty w kolbach i probówkach osłonić kapturkami z papił pergaminowego i owiązać sznurkiem, aby nie spadły i nie uległy zawilgoceniu. mknąć pokrywę kotła, starannie dokręcając przytrzymujące śruby, otworzyć kurek! odpowietrzania i rozpocząć ogrzewanie. Zamknąć kurek wówczas, gdy wydobywać! będzie równomierny strumień pary i czekać, aż ciśnienie w autoklawie osiągnie 1 al co odpowiada temperaturze 121 "C. Wówczas tak uregulować ogrzewanie, aby utrj mać to ciśnienie przez 20 min. (jest to czas sterylizacji szkła), po czym wyląc; ogrzewanie i czekać, aż wskazówka manometru opadnie do zera. Wówczas otworj kurek odpowietrzający, zdjąć pokrywę kotła i wyjąć szkło. L
Wyjaławianie sprzętu metalowego. Oczka (ezy) oraz igły (druciki) wyjaławiać w pj1 mieniu palnika gazowego trzymając je pionowo aż do rozżarzenia. Pincety zanur: w alkoholu etylowym, a następnie opalić w płomieniu.
Iliiije żywe,
W celu bezpośredniej obserwacji drobnoustrojów występujący< w produktach spożywczych, z badanego materiału wykonuje s preparaty mikroskopowe, które ogląda się pod mikroskopem pr: odpowiednio dobranym powiększeniu.
Za pomocą preparatów mikroskopowych można określić, m.in
- obecność lub liczbę drobnoustrojów w badanym materiale,
- kształt i wielkość komórek,
- sposób rozmnażania się,
- zdolność ruchu,
- obecność przetrwalników u bakterii oraz ich kształt i sposó ułożenia w komórce,
preparaty utrwalone i barwione, w których drobnoust-l< *ą martwe.
Preparaty przyżyciowe wykonuje się najczęściej w kropli spłasz-i.moj. Jest to najprostszy rodzaj preparatu. Przygotowuje się go na kiełku przedmiotowym i jeżeli badany materiał jest płynny, prze-•l się kroplę wprost na szkiełko, przykrywając ją szkiełkiem naukowym, a jeżeli pobierany materiał jest stały, należy najpierw nieść na szkiełko kroplę jałowej wody destylowanej lub roztwór |i(logiczny soli (przep. labor. 1.1), do której następnie wprowadza Imdany materiał i miesza go z wodą w celu otrzymania zawiesiny, irkicdy stosuje się barwienie przyżyciowe, co ułatwia obserwację lultu drobnoustrojów.
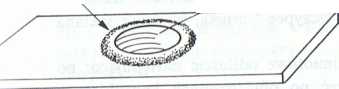
Kuch drobnoustrojów najlepiej jest oglądać w tzw. kropli wi-k c cj. Do wykonania takiego preparatu potrzebne jest szkiełko wlmiotowe z zagłębieniem. W tym przypadku kroplę badanej ulowli daje się na środek szkiełka nakrywkowego, a następnie k iclko to umieszcza się na szkiełku przedmiotowym z zagłębieniem k, aby kropla wisiała swobodnie nad zagłębieniem (rys. 16). Preparaty przyżyciowe służą głównie do obserwacji pleśni i droż-| v oraz do określania zdolności ruchu drobnoustrojów. Natomiast lUnwacje kształtu komórek bakterii są bardzo utrudnione, gdyż są
iodsms^ę^atsbie^
lutyek wazeliny
90
U / B /
.kropli wiszącej”: A - szkiełko podstawowe z wgłębie-
- 'i. ’ . . . I , Schemat wykonania „kropli wiszącej”: A - szkiełko podstawowe z wgłębię
obecnosc zarodników oraz ich kształt i liczbę u drożdży, |,„m „toczonym wazeliną, B - szkiełko nakrywkowe z kropelką badanego materiału
kształt zarodni i zarodników u pleśni. «____*------««« vrr»r»ip wiszącą”
schematyczny przekrój przez „kroplę wiszącą”
26
27
Wyszukiwarka
Podobne podstrony:
Mycie szkła laboratoryinego Naczynia używane do eksperymentu muszą być czyste i suche. Szkło
DSC00446 (2) Tematy ćwiczeń laboratorium „ Obrabiarki ” studia dzienne inż. 1. &nbs
spis ĆWICZENIA WSTĘPNE ćwiczenie 1%ZcTJcVn7l mp~ ** " »«*noicl o„ ,c* ^c^c, => oznaczanie kw
wyrazy z ą, ę 2 C 1.13 Ćwiczenie umiejętności ortograficznych Wyrazy z literami: „ ą ", „ę&qu
CWICZENIA GRAFICZNE ULATWIAJACE PISANIE (10) t I „•••••fi V,t ■ u® > k ♦ < ►v.* • ♦ «
CCF20080102�000 ĆWICZENIE 11 ZASTOSOWANIE PRAWA HAGENA - POISEUILLE’A nv zooorcw3]
CCF20080410�001 Ćwiczenie 1 z fizjologii krwi 1. Rola krwi w organizmie: •
CCF20090105�014 1L Ja jednak wierzę w laboratoria i w to, że wre w nich dzień i noc praca: nie
CCF20090117�003 111 u ° I SO,} n _Jl--L°~ u: -ytiu ,„ Pj V Uił fSo2 *■ ltt,ć>
CCF20090521�012 Ćwiczenie 3.11Układanie jadłospisów dla osób o zwiększonej aktywności fizycznejWprow
CCF20091015�029 Ćwiczenie 8. TKANKI H1ĘKISZ0WE Motorloł roślinny: I Sporzędzlć preparat mikroskopowy
CCF20091020�000 Ćwiczenie 1. Proszę obliczyć wskaźniki
CCF20091212�003 4 -ćwiczenia nóg Rodzaje ćwiczeń: Wynosy, przenosy, wymachy, krążenia, skurcze, uaie
więcej podobnych podstron