CCF20110129�018
~x) imiirin' ouczynmk kompleksujjjcy, w przypadku gdy o/nm .nmy kationy meiu w postaci barwnych związków chclatowych. Należy tak dobrać odczynnik komplekwi jący, aby:
a) Zarówno odczynnik, jak i wytworzony chelat były trwałe w czasie i dobrze rui puszczalne w stosowanym rozpuszczalniku.
b) Pasmo absorpcji odczynnika nie pokrywało się z pasmem absorpcji kompleksu
c) Reakcja kompleksowania była szybka i odtwarzalna.
d) Reakcja kompleksowania była selektywna, a nawet specyficzna względem annli zowanego metalu. W wielu przypadkach jest to warunek trudny do spełnienia. CzęHH korzystamy z faktu, że różne kationy tworzą trwałe kompleksy przy różnych pH, lir stosujemy odczynniki maskujące.
e) Powstały barwny chelat spełniał prawo Beera w szerokim zakresie stężeń, czyi aby w szerokim zakresie spełniona była liniowa zależność A od c.
f) Powstały kompleks charakteryzował się dużą wartością molowego współczyii nika absorpcji s. Wartość e determinuje dolną granicę oznaczalności danego składniki* Na przykład w przypadku oznaczania Cu2+ możemy utworzyć kompleks z amoniakiem umożliwiający oznaczanie miligramowych ilości miedzi, natomiast znany odczynnik dii tyloditiokarbaminian (DEDC) tworzy z Cu2+ rozpuszczalny w chloroformie komplck który umożliwia oznaczanie mikrogramowych ilości miedzi. Wartości £max i Amax dl roztworów CuS04, Cu(NH3)2+ i kompleksu Cu-DEDC przedstawiono w tablicy 6.1 Wartość e jest miarą czułości danego odczynnika i z tablicy tej wynika wyraźnie, b najczulsza jest reakcja z DEDC. Drugi przykład ilustrują wyniki przedstawione w tabll cy 6.5 i dotyczą odczynników do oznaczania Fe2+.
Tablica 6.4. Wartości żmax i gmax dla różnych kompleksów Cu(II)
|
Odczynnik |
^•max [nm] |
£max [dm3 • mol-1 • cm-1] |
|
(CuS04)aq |
800 |
20 |
|
Cu(NH,)2+ |
600 |
80 |
|
Cu-DEDC |
436 |
10000 |
Tablica 6.5. Wartości Xmax i £max dla kompleksów Fe(II) z odczynnikami organicznymi
|
Odczynnik |
^•max [nm] |
£max [dm3 ■ mol-1 • cm-1] |
|
2,2-dipirydyl |
522 |
8 000 |
|
1,10-fenantrolina |
510 |
11 000 |
|
4,7-difenylo-1,10-fenantrolina |
533 |
22400 |
Powyższe przykłady dowodzą, że przed podjęciem decyzji co do wyboru odczynniku należy dopasować układ analityczny do problemu, jaki mamy do rozwiązania.
Wybór analitycznej długości lali
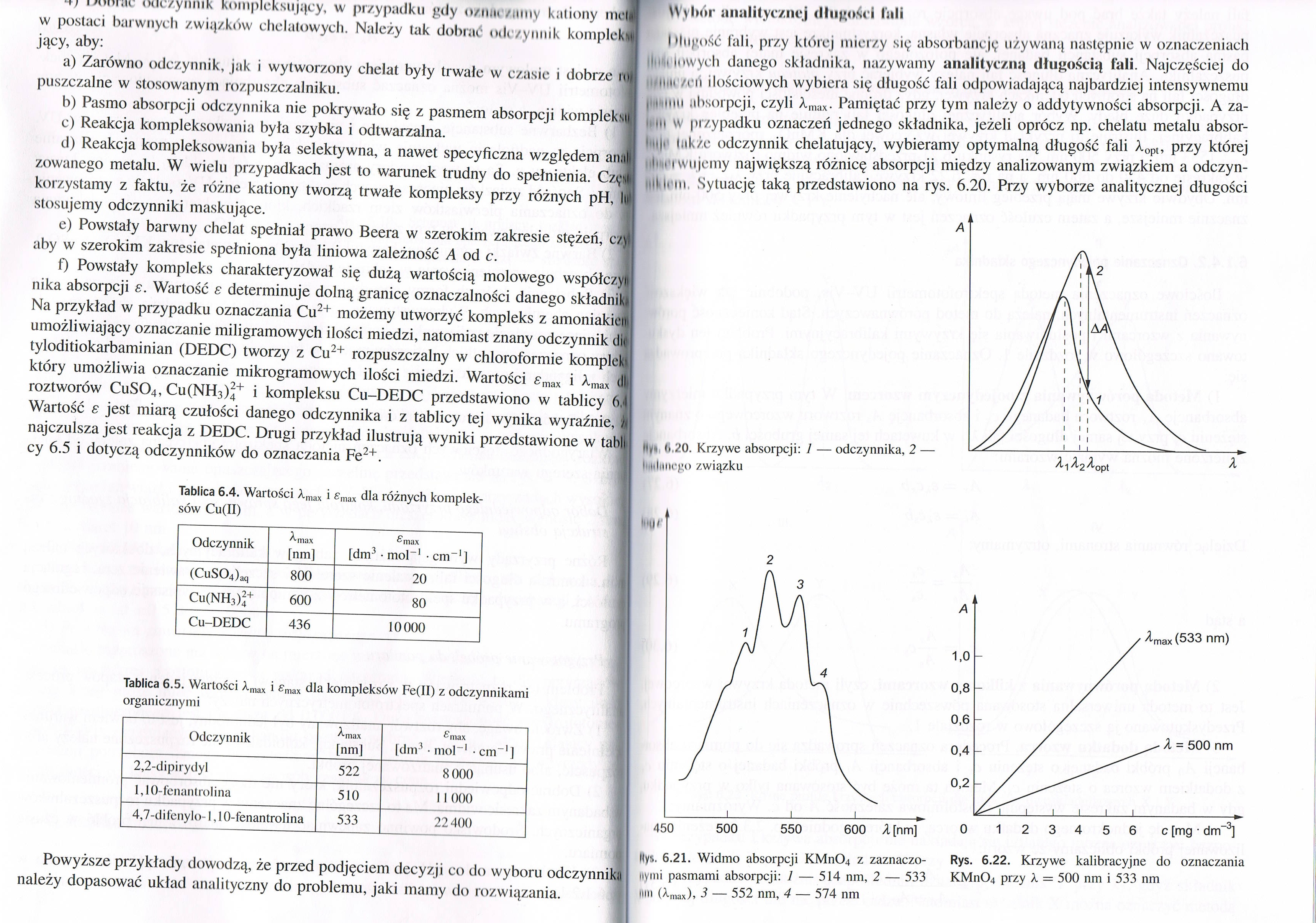
I (liigość fali, przy której mierzy się absorbancję używany następnie w oznaczeniach IttfH Inwych danego składnika, nazywamy analityczną długością fali. Najczęściej do tltłiiu /cii ilościowych wybiera się długość fali odpowiadającą najbardziej intensywnemu j i miii absorpcji, czyli Xmax. Pamiętać przy tym należy o addytywności absorpcji. A za-iii w przypadku oznaczeń jednego składnika, jeżeli oprócz np. chelatu metalu absor-' nji liikże odczynnik chelatujący, wybieramy optymalną długość fali Xopt, przy której li i i wujciny największą różnicę absorpcji między analizowanym związkiem a odczynił li iii Sytuację taką przedstawiono na rys. 6.20. Przy wyborze analitycznej długości
6.20. Krzywe absorpcji: 1 — odczynnika, 2 — | nliiiicpo związku
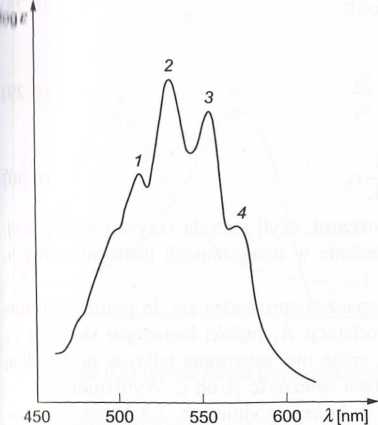
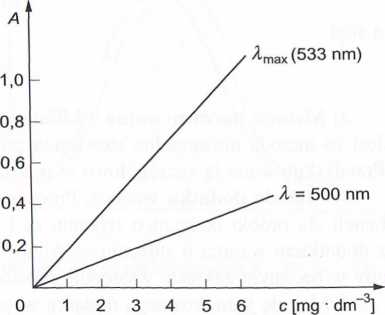
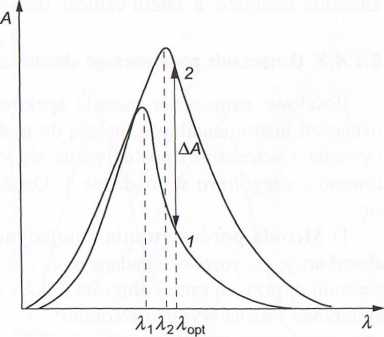
llys. 6.21. Widmo absorpcji KMnCU z zaznaczo- Rys. 6.22. Krzywe kalibracyjne do oznaczania liymi pasmami absorpcji: 1 — 514 nm, 2 — 533 KMnC>4 przy X = 500 nm i 533 nm lilii (kmax), 3 — 552 nm, 4 — 574 nm
Wyszukiwarka
Podobne podstrony:
0000003 3 jakim może podlegać substrat wchodzący z nim w kompleks. W przypadku, gdy jeden substrat m
CCF20110307�029 wartości. W przypadku, gdy w monotonicznym uporządkowaniu pojawiają się obok siebie
CCF20100422�004 (2) 100 11 Podana zależność obowiązuje dla przypadku, gdy Ny d > d . Jeżeli powyż
CCF20100422�004 (2) 100 11 Podana zależność obowiązuje dla przypadku, gdy Ny d > N^ d . Jeżeli po
CCF20100206�061 4. Tkanki zwierzęce Podział obejmuje: 1. Nabłonki okrywające i wyściełające —w przyp
CCF20100608�013 / W większości praktycznych przypadków, gdy stosowane są pionowe strzemiona, wystarc
skanuj0016 (131) wania dekodera niepełnego powstaje pytanie: jak układ ma działać w przypadku, gdy n
Image10 h(s)=G(s)-l(s) h(s) = , a po przęj śdu do funkcji oryginalnej: h(t) = jC s
Image529 W przypadku, gdy odpowiedź na przełączenie zestyku ma mieć postać impulsu, wówczas w układz
więcej podobnych podstron