CCF20121020�032
Dla NH4+ = 1 / 2 ( 8 - 8 ) = O
X elektr. = 5 elektr. z azotu + 4x 1 elektr. z wodoru- 1 elektr. znak (+ ) = 8 Każdy z wodorów tworzy dublet, łącznie 4x2 = 8 LO = 4 + 0 = 4 hybrydyzacja sp3 bez wolnych par elektronowych
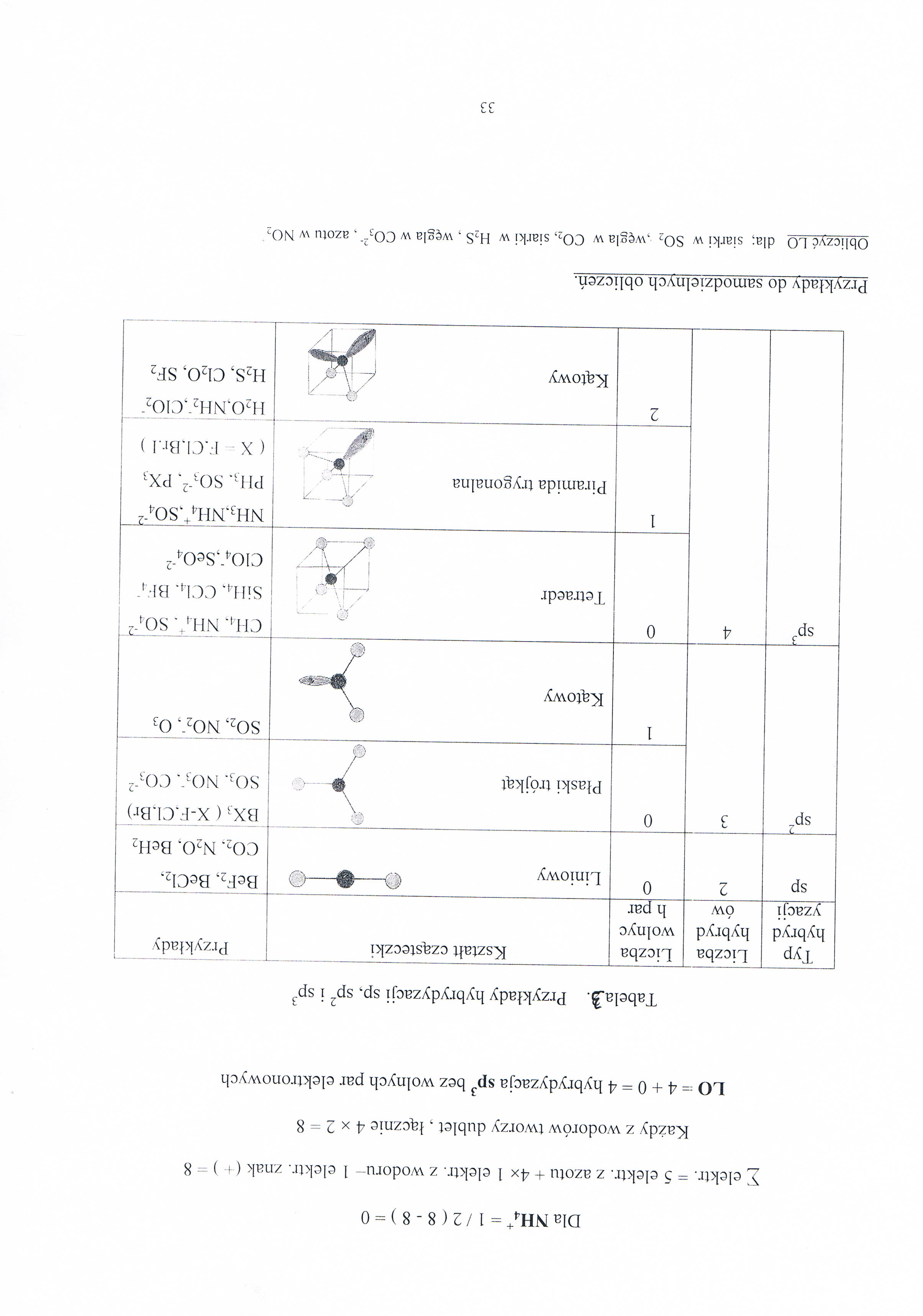
Tabelajl- Przykłady hybrydyzacji sp, sp' i spJ
|
Typ hybryd yzacji |
Liczba hybryd ów |
Liczba wolnyc h par |
Kształt cząsteczki |
Przykłady |
|
sp |
2 |
0 |
Liniowy 1 |
BeF2, BeCl2, C02, N20. BeH2 |
|
sp3 |
-> J |
0 |
'"A, \ Płaski trójkąt w---# / |
BX3 ( X-F.Cl.Br) S03. N03‘. CO3'2 |
|
1 |
Kątowy w |
S02, NOT, 03 | ||
|
sp3 |
4 |
0 |
Tetraedr L_.jA.yL i——& |
ch4, mi/, sor2 Sil I4, CC14, Blu' C104',Se04'2 |
|
1 |
P----71 Piramida trygonalna /" |\ |
NH3,NH4+,S04‘2 ph3, sot2. px3 ( X L.Cl.Br.I ) | ||
|
2 |
Ą............71 Kątowy |
H20,NH2',C102_ h2s, C120, sf2 |
Przykłady do samodzielnych obliczeń.
Obliczyć LO dla; siarki w S02 ,węgla w C02, siarki w H2S , węgla w C032’, azotu w N02
Wyszukiwarka
Podobne podstrony:
CCF20120118�008 Grapa 333 . elektrony walencyjne azotu na +2 stopniu utlenienia 2. reakcja znajduje
skrypt011 JO Laboratorium Podstaw Elektrotechniki 1 3, i Znak ostrzegawczy dla przyrządów, których
Wojciech Bieniecki*. Jacek Stańdo**, Sebastian Stoliński*Analiza wymagań dla systemu elektronicznego
Duża wartość początkowa prądu rozruchu może byc dla maszyny elektrycznej bardzo niebezpieczna i dlat
MACIERZ POWIĄZANIA EFEKTÓW KSZTAŁCENIA DLA PRZEDMIOTU Elektronika i Elektrotechnika Z EFEKTAMI
cznych odgromowej dla malej elektrowni wykorzystującej OZE stacjach średniego napięcia. Rozpoznaje i
Cnić II Oprz«t do linii napowietrznych SN w systemie PAS - prezentacja dla Stowarzyszenia Elektryków
2012 06 30 40 33 x ,mmm SSSSSm 14. Dla potrzeb elektrodiagnostyki, w metodach ilościowych wyznacza
w przypadku potrzeby zaewidencjonowania kolejnych dokumentów) Dla dokumentów elektronicznych pełna
Prawo Gaussa dla pola elektrycznego. a) Definicja strumienia elektrycznego: Strumi
Zestaw pytań do egzaminu dyplomowego inżynierskiego dla kierunku Elektronika i Telekomunikacja Pytan
Program Laboratorium z TO dla 1 roku Elektrotechniki (stacjonarne) 07 2008 (2) I -
załącznik 3.2 Efekty kształcenia dla kierunku Elektrotechnika studia II stopnia - profil
więcej podobnych podstron