DSCF6803

64
2.4. Oznaczanie wodorotlenku sodowego i węglanu sodowego obok siebie
Alkacymetryczne oznaczanie wodorotlenku i węglanu obok siebie można wykonać dwoma metodami: metodą Winklera i metodą Wardera. W metodzie Winklera poprzez zmiareczkowanie próbki kwasem solnym w obecności oranżu metylowego ustalamy sumę zawartości obu składników. Następnie do drugiej równoległej próbki roztworu badanego dodajemy roztworu chlorku barowego. W takich warunkach węglany wytrącają się w postaci BaC03, a pozostały w roztworze wodorotlenek miareczkujemy kwasem solnym w obecności fenoloftaleiny.
Różnica wyników obu oznaczeń odpowiada ilości kwasu, która jest równoważna ilości zawartego w roztworze węglanu.
W naszym laboratorium stosuje się drugą z metod - prostszą w wykonaniu metodę Wardera. Polega ona na kolejnym miareczkowaniu próbki mianowanym roztworem kwasu solnego wobec dwóch wskaźników: fenoloftaleiny i oranżu metylowego. Wykorzystana jest tu reakcja dwustopniowego zobojętniania roztworu NajC03. Schemat miareczkowania mieszaniny Na^CC^ i NaOH przedstawiony jest na rys. 36.
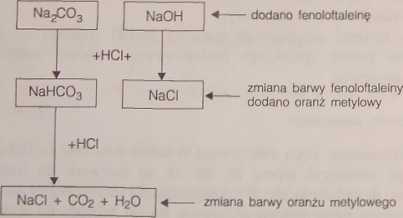
Rys. 36. Schemat miareczkowania mieszaniny NaOH i NajCOj
W miarę dodawania kwasu następuje najpierw zobojętnianie jonów OH" pochodzących z dysocjacji NaOH (najmocniejsza zasada w roztworze), według równania:
H+ +OH" H20
a następnie zobojętnienie jonów COj" pochodzących z dysocjacji NajC03 do wodorowęglanów:
CO^ + H+ HCOj
W punkcie równoważnikowym reakcji roztwór ma pH = 8,3 i jeśli zastosuje óę fenoloftaleinę jako wskaźnik, następuje odbarwienie się roztworu. Jak widać z równań, zobojętnieniu uległa całkowita ilość NaOH i połowa Na^COj.
Następnie do miareczkowanej próbki dodaje się oranżu metylowego i miareczkuje się dalej roztworem kwasu solnego. Następuje wówczas zobojętnienie wodorowęglanu sodu zgodnie z równaniem:
HCOj+ H+ -> HjO +C02
W drugim punkcie równoważnikowym roztwór jest nasycony C02 i wykazuje pH ok. 4. Następuje więc zmiana barwy wskaźnika. Metoda Wardera daje dobre wyniki, gdy zawartość węglanu sodu jest znacznie mniejsza od zawartości wodorotlenku. Można ją więc wykorzystywać np. do oznaczania czystości NaOH.
Wykonanie oznaczenia
Z kolbki miarowej zawierającej rozcieńczony roztwór zadania kontrolnego pobrać pipetą 25 ml roztworu, przenieść do kolby stożkowej o pojemności 300 ml, dodać 2 krople fenoloftaleiny i miareczkować mianowanym roztworem kwasu solnego aż do odbarwienia roztworu. Zanotować objętość zużytego kwasu (a ml), dodać 2 krople oranżu metylowego i miareczkować dalej roztworem HC1 do zmiany barwy wskaźnika z żółtej na cebulkową. Zanotować objętość kwasu zużytą na drugie miareczkowanie (b ml). Miareczkowanie powtórzyć trzykrotnie.
Z podanych rozważań wynika, że na zmiareczkowanie wodorotlenku zużyto (fl-b) ml kwasu, natomiast na zmiareczkowanie węglanu 2b ml kwasu. Wynik analizy na zawartość wodorotlenku sodu i węglanu sodu w próbce kontrolnej należy podać w milimolach tych związków równoważnych 1 mili-mdowi HC1 zużytego na ich zmiareczkowanie.
Ilość milimoli NaOH i 1/2 NajCOj (x) obliczyć ze wzorów:
*n.oh = (a~b) 'c w (“®°1)
xi/2NHco, = 26 • c ■ w (mmol)
gdzie:
a - objętość roztworu HC1 zużyta na zmiareczkowanie wobec fenolo-ftaleiny (ml),
b - objętość roztworu HC1 zużyta na zmiareczkowanie wobec oranżu metylowego (ml),
c - stężenie roztworu kwasu solnego (mmol/ml), w - wspóhnierność kolby z pipetą.
Objętości a i b wzięte do obliczeń są średnią z trzech próbek.
Wyszukiwarka
Podobne podstrony:
DSCF6804 66 Zawartość wodorotlenku sodu i węglanu sodu w gramach można obliczyć mnożąc otrzymane ilo
--—Mu..v lu/iwuicm wodorotlenku sodowego wobec ilości zużytego do miareczkowania wodorotlenku
Chemia testy18 8. Jeśli do roztworu powstałego przez dodanie wodorotlenku sod
CsaOH- stężenie roztworu wodorotlenku sodowego do miareczkowania [mol/“m"] V.aOH - objętość
Chemia testy18 8. Jeśli do roztworu powstałego przez dodanie wodorotlenku sod
55705 Strona109 się z kolei alkoholowym roztworem wodorotlenku sodowego. Przy zmieszaniu obu roztwor
img040 (22) że próbka preparatu zanieczyszczonego kwasem szczawiowym zużyje więcej roztworu wodorotl
pytania na koło 1. Podaj wzory chemiczne kwasu siarkowodorowego, fosforany(V) potasu, wodorowęglanu
Chemia testy18 8. Jeśli do roztworu powstałego przez dodanie wodorotlenku sod
różnym stężeniu zawierał dodatek chlorku sodu, wodorofosforanu dwusodowego, wodorowęglanu sodowego o
więcej podobnych podstron