3582279950
Ograniczenia modelu gazu doskonałego
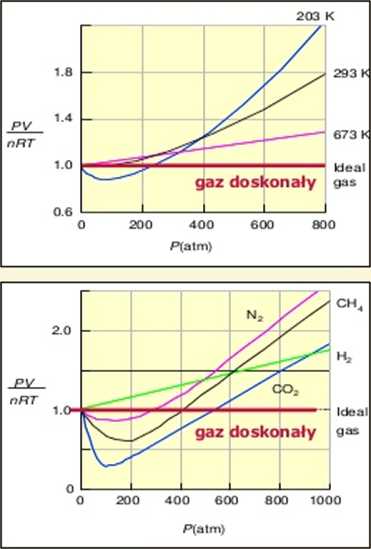
Zależność pV/nRT od p dla azotu w 3 temperaturach
Zależność pV/nRT od p dla kilku różnych gazów (w 200 K)
Podstawy chemii - Gazy Jakub M. Milczarek Uniwersytet Jagielloński
Wyszukiwarka
Podobne podstrony:
Dla 1 mola gazu doskonałego (jednotomowego) N = pV = RT, stąd
2.3. Współczynnik ściśliwości Równanie stanu gazu doskonałego: pV = nRT
Równanie Van der Izaaka Równanie stanu gazu doskonałego pV = nRT dobrze opisuje gazy rzeczywiste ale
img209 209 więc* energia promieniowania gazu Jest zależna od temp era tury gazu Tg oraz od iloczyn
w7 Włodaw Uniyersity oi TechnologyRównanie stanu gazu doskonałegoPV = nRT R = 0,08205781 atm/(K x m
P1010014 (2) , 2.5. Równanie stanu gazu doskonałego4- fi otrzymujemy: pub pv nvtr = Nkr J « «(aV f
GAZY RZECZYWISTE I RÓWNANIE VAN DER WAALSA Gazy rzeczywiste wykazują odchylenia od praw gazu doskona
100D61 30. Czy en.wew stopienia lodu =0 >0 <0 ? 31. Od jakich parametrów zależy en wew gazu do
CCF20101205�011 1 Punkty: OM Mol jednoatomowego gazu doskonałego zamkniętego w cylindrze z ruchomym
8 (1101) 8. Jeden kilomol gazu doskonałego ogrzewa się w przemianie izobarycznej od ti=20 do t2-600
PB260125 Równanie Van der Waalsa Równanie gazu doskonałego p —nRT dobrze opisuje gazy rzeczywiste p
P2283560 Ula gazu doskonałego zachodzi zależność między molowymi cieplarni właściwymi: gdzie: cp - c
więcej podobnych podstron