1

Dla 1 mola gazu doskonałego (jednotomowego) N = pV = RT,
stąd
r;na = k
= <ek>
dla, 1 czu,{tti

dla- n hnoU
dl Cu <Ł hnola-
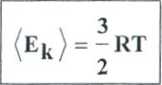
(stała Bolzmanna)
k
(e*>
k = 138-to'" J/K
/£ v ^ fcT1 u jeJr ió energta, Cki'*>etynio*)
**■ ' 2. HZi/nę.ł-fZna, —?* SpecjcJnt, O?no-
•z 4?fc z&u ru^T tisną

Równanie stanu gazu (Clapeyrona)
ok. 1834 r.
pon* tz-*-jqce-fo /i-t ^
jo-l-Oft prfJkoito*} C
n V J
- - -- = 8,314-= R (uniwersalna stała gazowa)
Tn K • mol
pV = RT (dla 1 mola)
pV = n RT (dla n moli)
Jest to równanie empiryczne
• dla stałej T -»
• dla stałego p -»
• dla stałej V -»
W w/w przypadkach
pV = const
V
— = const T
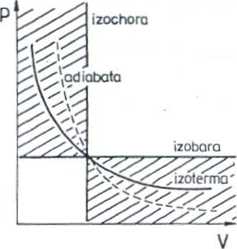
przemiana izotermiczna (prawo Boyle’a - Mariotte’a)
1662 r. 1676 r.
przemiana izobaryczna (prawo Gay - Lussaca)
1802 r.
przemiana izochoryczna (prawo Charlesa) 1?8g p zachodzi wymiana ciepła z otoczeniem
przemiana adiabatyczna - bez wymiany ciepła z otoczeniem
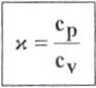
pVx = const
dla tej przemiany też obowiązuje równanie stanu
a) b)
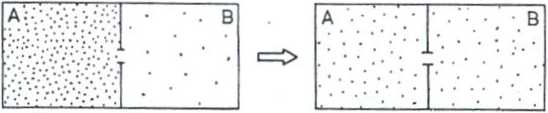
Ta * "(b . Pa * Pb Ta = Tb , pA = pB
Pa* Pb Ha= Pb
•> dQ = C ■ m • dT = C • lip. -dT ; C- ciepło właściwe - miara pojemności cieplnej substancji; p - masa jednego mola
- dla cieczy c większe niż dla ciał stałych (np. dla wody ok. 6,5 x większe niż dla stali);
- dla gazów cp > cv (cp - przy p = const, cv - przy V = const)
|
Cp JA 1 Cp |
Cu- JA. — c„ |
Cp - c„ + R |
Rys. Podukłady A i B: a) przed i b) po osiągnięciu stanu równowagi
termodynamicznej
Równowaga termodynamiczna - stan, do którego dążą wszystkie układy izolowane; nie ma w nim zmian makroskopowych
przemiana termodynamiczna równowagowa (ideaIizacja)-» układ nieskończenie (bardzo) powoli przechodzi przez kolejne stany równowagi od punktu P do punktu K; inaczej - guasistatyczna.
- procesy ąuasistatyczne są równocześnie odwracalne (przy braku dysypacji energii)
- termodynamika fenomenologiczna - równowagowa (tą się zajmujemy)
- nierównowagowa
Wyszukiwarka
Podobne podstrony:
Dla 1 mola gazu doskonałego (jednotomowego) N — N A , p V — RT, stąd
P1040146 Zapiszmy równanie van der Waalsa dla 1 mola gazu (p+Vf)(V-b)=RT jako P J
Ograniczenia modelu gazu doskonałego Zależność pV/nRT od p dla azotu w 3 temperaturach Zależność pV/
10. Jeśli znamy dla dwuatomowego gazu doskonałego współczynnik izentropy k = 7/5, to policzyć jego c
Obliczanie pracy objętościowej dla gazu doskonałegoPV=RT
Termodynamika Techniczna dla MWT, wykład 6. © AJ Wojtowicz IF UMK mamy dalej RT - (y - l)U dla jedne
39623 MechanikaI2 Równanie stanu gazu doskonałego Równanie Clapeyrona • dla m kg:pV = mRT R - stała
fizyczna egzamin002 6. Równanie przemiany adiabatycznej dla gazu doskonałego ma postać (p - ciśnieni
P1010014 (2) , 2.5. Równanie stanu gazu doskonałego4- fi otrzymujemy: pub pv nvtr = Nkr J « «(aV f
Lista 1 (2010) Przemiany gazowe. 1. 3,25 mola jednoatomowcgo gazu doskonałego,
2.3. Współczynnik ściśliwości Równanie stanu gazu doskonałego: pV = nRT
więcej podobnych podstron