3582318592
|
Wydział: Mechaniczny |
Ćwiczenia laboratoryjne z chemii |
Grupa: B 3 |
|
Semestr: III Kierunek; mgr |
Ćwiczenie nr: 5 Wyznaczanie wydajności prądowej procesu elektrolizy oraz grubość powłoki galwanicznej |
Zespół: 2 Borysławski Łukasz Jędrzejewski Mariusz Kiraga Paweł |
1. Wstęp teoretyczny
Przemiany chemiczne zachodzące w przewodniku elektrolitycznym związane z przepływem prądu i zobojętnianiem jonów na elektrodach nazywamy elektrolizą. Podczas elektrolizy zachodzi trwały rozpad elektrolitu pod wpływem prądu.
Elektroliza stanowi najprostszy i najsilniejszy układ utŁeniająco-redukujący. Reduktorem jest katoda, gdyż dostarcza elektrony -kationy, które się redukują. Utleniaczem jest anoda, gdyż elektrony, które przez to się deelektrolizują czyli utleniają.
Pierwsze prawo Faradaya (pierwsze prawo elektrolizy)
Masa M substancji wydzielonej na elektrodzie jest wprost proporcjonalna do ładunku elektrycznego Q, jaki przepłynął przez elektrolit, czyli:
M= k*Q =k*l*t
Jeżeli przez elektrolit w ciągu czasu t płynął prąd stały o natężeniu I.
Stała FaradayJa=96500
Współczynnik proporcjonalności k nazywamy równoważnikiem elektrochemicznym danej substancji. Jest on liczbowo związany równy masie substancji, jaka wydziela się na elektrodzie na skutek przepływu przez elektrolit jednostkowego ładunku elektrycznego. Współczynnik k zależy od chemicznej natury danej substancji.
Drugie prawo Faradaya (drugie prawo elektrolizy)
Stosunek równoważników elektrochemicznych różnych substancji jest równy stosunkowi ich równoważników chemicznych kx (gramorównoważników) tj.:
hi
ki
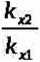
Równoważnik elektrochemiczny jest masą substancji jaką wydzieli w czasie elektrolizy ładunek jednego Kulomba.
Wydajność prądowa *7% jest to stosunek masy mi substancji pożądanej otrzymywanej w wyniku elektrolizy rzeczywiście do jej ilości m przewidywanej teoretycznie
7?% = -^-*100% m2
Im mniej szlachetny jest metal odkładający się na katodzie tym więcej wydziela się wodoru. Zatem wydajność prądowa jest ściśle związana z położeniem metalu w szeregu napięciowym
Wyszukiwarka
Podobne podstrony:
Wydział: Mechaniczny Ćwiczenia laboratoryjne z chemii Grupa: B 3 Semestr: II Kierunek; mgr Ćwiczeni
Wydział: Mechaniczny Ćwiczenia laboratoryjne z. chemii Grupa: B2 Semestr: I Kierunek:
Wydział: Mechaniczny Ćwiczenia laboratoryjne z chemii Grupa: B3 Semestr: II Kierunek: mgr Ćwiczenie
chemia (7) Ćwiczenia laboratoryjne z Chemii ogólnej dla I roku kierunku lekarskiego na rok akademick
Harmonogram Elektronika 3 LABORATORIUMELEKTROTECHNIKI Z ELEKTRONIKĄ PROGRAM ĆWICZEŃ DLA WYDZIAŁU MEC
Warunki zaliczenia ćwiczeń laboratoryjnych z Chemii Organicznej i Makromolekuł dla III roku chemii
Tematy ćwiczeń laboratoryjnych z Chemii Sanitarnej realizowane w semestrze letnim 2007. Ćwiczenie 1.
Warszawa, 30.10.2012 Katedra Chemii Analitycznej Wydział ChemieznyPWPROGRAM CWICZEN LABORATORYJNYCH
więcej podobnych podstron