3582326705
1) Zmieszano 22 cm3 0,012 M HN03, 43 cm3 0,027 M H2S04 i 180 cm3 wody. Jakie jest pH roztworu (przyjąć gęstości wszystkich roztworów równe 1,00 g/cm3) ? Jakie jest stężenie molowe jonów siarczanowych ?
• Piszemy równania reakcji rozpadu na jony:
HNOj -»• H‘ + NO
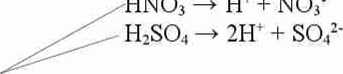
Te związki to mocne kwasy ( HNOi - azotowy V1 H:S0 i - siarkowy VI) dlatego rozpadają się na jony całkowicie, a stężenie każdego z jonów jest równe stężeniu początkowemu rozpadającego się kwasu (czyli np. Jeśli było 5 mol/dm3 HN03 to powstaje nam 5 mol/dm3 H+ i 5 mol/dm3 NOy)
• Ponieważ mamy obliczyć pH (czyli -log ze stężenia jonów IT) musimy obliczyć stężenie jonów wodorowych w objętości całego roztworu (czyli mieszaniny HNO31 H2SO.1 i H20)
DLATEGO:
• Musimy obliczyć liczbę moli (n) wodom dla każdego kwasu ze wzoru:
G„ = 11/V => n = Cm*V
1. kwas HNO3ma na+= 0,012 mol/dm3 * 0,022 dm3 = 0.000264 mol
2. kwas H2SO,i ma 2iim-= 2(0,027 mol/dm3 * 0,043 dm3) = 0,002322 mol
H:SO.t -► 2R- + S04-
• Musimy obliczyć V całego roztworu V = 0,022 dnr'+ 0,043 dni3 + 0,180 dm3 = 0,245 dm3 I TERAZ:
• Podstawiamy do wzoru na stężenie molowe sumę wszystkich moli H! w roztworze 1V całego roztworu (C1U = n/V)
Cm = (0.000264 mol + 0,002322 mol)/0.245 dm3 = 0,011 mol/dm3
• Wyliczamy pH = -logO.011 = 1.96 ŻEBY OBLICZYĆ [SO42 ]:
• Obliczamy stężenie SO42 tak jakbyśmy liczyli stężenie H 2S04 ponieważ ich liczba moli jest równa przed reakcją dysocjacji 1 po reakcji dysocjacji (rozpadu na jony)
0,027 mol/dm3 * 0,043 dm3 / 0,245 dm3 = 0.011 mol/dm3
Wyszukiwarka
Podobne podstrony:
2013 03 22 961 * Jakie jest pH roztworu KOH, którego lOO cm3 dodanych do 900 cm3 roztworu zawie
25085 IMG?81 rozpuszczalność / pH Jakie jest pH roztworu KOH, którego 100 cm3 dodanych do 900 cm3
Chemia0025 Zadanie nr 13 ) Iloczyn rozpuszczalności jodku srebra(l) wynosi Kso = 1 • 10’16 . Zmiesza
15. Zmieszano 50 cm3 0,20 M Mn(NOj)2 i 150 cm3 0,20 M NaOH. Jakie będzie stężenie
Zmieszano 275 cm3 0,050M kwasu azotowego V i 325 cm3 0,010M HCI. Do otrzymanego roztworu dodano 5,61
img102 (22) Rozpuszczalność tłuszczu w rozpuszczalnikach Do 4 probówek odmierzyć kolejno po 2 cm3 wo
Zadanie 14. Zmieszano 80cm3 20% roztworu NaOH o gęstości 1,225 g/cm3 z 15 cm3 2M roztworu NaOH. Jaki
img340 207 ki należy wlać analogiczną ilość kwasu siarkowego(VI) dokładnie zmieszaną z 10 cm3 roztwo
DSC02191 b) Zmieszano 100 cm3 roztworu CaCI2 o stężeniu 0,001 mol/dm3 i 100 cm3 roztworu Na2C03 o st
CCF20140426�001 3. Zmieszano 10 cm3 0,01-molowego roztworu chlorku magnezu z 10 cm3 roztworu amoniak
Obliczenia związane z iloczynem rozpuszczalności Przykład 9 warunki wytrącania osadów Zmieszano 100
więcej podobnych podstron