105723
Funkcje zwaną Entalpią wprowadzamy, gdy układ może wykonać pracę zmiany objętości. W takich warunkach część energii dostarczonej do układu na sposób ciepła wraca do otoczenia więc: du<dq
Dostarczone ciepło w takich warunkach jest równe zmianie Entalpii, czyli:
dh=dq
przy p=const i gdy układ nie wykonuje pracy nieobjętościowej.
Dla wielkości mierzalnych:
Ah=qp, qp - ciepło mierzone pod stałym ciśnieniem (4)
Pojemność cieplna (Cp) przy p=const jest zdefiniowana :
Cp=(ćH/ćT)p (5)
H-entalpia T-temperaturalKl
Nachylenie wykresu entalpii jako funkcji temperatury, gdy p=const nazywamy Pojemnością cieplna pod stałym ciśnieniem(Rys.2)
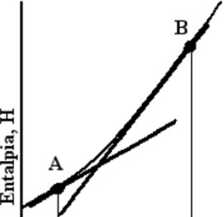
Rys. 2
Wykres pojemności cieplnej pod stałym ciśnieniem(linia gruba). Pojemność cieplna zależy od temperatury, dlatego jak to widać na wykresie pojemności w punktach A i B są różne.
Temperatura, T
Pojemność cieplna układu pod stałym ciśnieniem jest zmianą Entalpii układu w procesie izobarycznym odniesiona do zmiany temperatury układu w tym procesie.
Pojemność cieplna zależy od temperatury i w niskiej maleje. Dla niewielkich zakresów temp.(temp. pokojowa i wyższa)w przybliżonych obliczeniach przyjmujemy że jest niezależna od temperatury.
2. Wyprowadzenie Prawa Kirchhoffa:
Za pomocą wzoru nr (5) wiążemy zmianę Entalpii ze zmianą temperatury.
Dla nieskończenie małych zmian temperatury.
dH=CpdT (6)
całkując w granicach Ti -Tz (zakres temperatur w których ogrzewamy substancje),
otrzymujemy:
Wyszukiwarka
Podobne podstrony:
O pracy, którą układ może wykonać, decyduje więc wielkość 4.18 F = U — TS zwana energią swobodną.
PB260119 Przemiana izotermiczna (T = const) W przemianie izotermicznej dU = 0 gdyż T = const. Gaz mo
0000090 (4) teryzowania tego rodzaju procesu wprowadza się nową funkcję stanu zwaną entalpią //. Nap
Naprawa uszczelnienia Naprawa uszczelnienia może być konieczna, gdy hydroizolacja została wykonana w
P1000995 (2) Tylko masaż serca:Gdy nie można wykonać sztucznego oddechu Wykonywanie samego masażu se
bch2 -(n) Co to jest energia swobodna? Może być wymiennikiem entalpii swobodnej gdy proces przebiega
może bardziej do niego się zbliżyć, podczas gdy układ somatyczny oddala się od terenu obcego i bardz
Image10 h(s)=G(s)-l(s) h(s) = , a po przęj śdu do funkcji oryginalnej: h(t) = jC s
Image318 Funkcje arytmetyczne i logiczne realizowane przez układ 181 przy założeniu, ie sygnałem akt
Image480 zostanie wygenerowany impuls o czasie trwania t — R30 C ln 2. Błędy wprowadzone przez układ
więcej podobnych podstron