0000090 (4)

teryzowania tego rodzaju procesu wprowadza się nową funkcję stanu zwaną entalpią //. Napiszemy równanie 4.5 w postaci
wprowadzając oznaczenia
= U2 + pV2, Hl=Ul-\-pV1 równanie 4.6 przyjmie postać
Qp — H2 — H1 = A H dla p = const 4.7
Funkcja
H=U + pV 4.8
jest funkcją stanu zwaną entalpią.
Przyrost entalpii AH jest równy ilości ciepła dostarczonego układowi w procesie izobarycz-nym Qp = AH (przy p — const) tak, jak przyrost energii wewnętrznej A U jest równy ilości ciepła dostarczonego układowi iv procesie izochorycznym Qv = At/ (przy V = const). Przykład. Jak zmieni się energia wewnętrzna 1 kg wody podczas wyparowania w temperaturze 373 K. i przy ciśnieniu 1 atm? Ciepło parowania wody w tych warunkach L = J l kcal\
= 22,6 • 105 — ,( 540-), objętość 1 kg pary, objętość właściwa v = 1,725 m3/kg.
kg V kg /
N .
Parowanie odbywa się przy stałym ciśnieniu p = 1 atm = 101325 — , ciepło dostaniu”
czone L jest więc równe przyrostowi entalpii.
Uwaga. Energię wewnętrzną, entalpię, objętość odniesioną do jednostki masy (1 kg), oznaczać będziemy małymi literami jako energię wewnętrzną właściwą u, entalpię właściwą /;, wyrażające się w J/kg, względnie w cal/kg, oraz objętość właściwą v w m3/kg.
L = Mi = Av+pAv = 22,6 • 105 -Ł ^540
Stąd przyrost energii wewnętrznej dla 1 kg:
Ah = A/i — pAr
Ile wynosi praca objętościowa pAr? Pomijając objętość właściwą wody ciekłej (10~3 m3/kg) w porównaniu z jej objętością w stanie lotnym (1,725 m3/kg) można przyjąć, że At) = 1,725 m3/kg. Wtedy
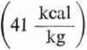
pAi = 101325 -^-m3
m3 |
1,725 = 1,74 ■ 105 -j—
kg kg
Wobec tego przyrost energii wewnętrznej podczas wyparowania 1 kg wody wynosi
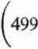
kcal \
kg J
97
Au = 22,6 ■ 108 - 1,74 • 105 ~ = 20,86 • 105 /-
kg kg kg
7 — Podstawy biofizyki
Wyszukiwarka
Podobne podstrony:
P3111156 KARL R POPPER się dość powszechne, zanim tego rodzaju procesy mogłyby doprowadzić do powsta
CCF20090523�084 tif KARL R. POPPER się dość powszechne, zanim tego rodzaju procesy mogłyby doprowadz
IMGw43 (3) 10 Rozdział l plastycznej Tego rodzaju uzależnienia pojawiły się przede wszystkim dzięki
DSC00067 ^ad tego rodzaju pytaniami zastanawiał się Thomas Malthus
Rzut dyskiem0031 na tego rodzaju trening przeznaczy się dwa do trzech razy w tygodiiu po 60 min. Prz
42730 Zdjęcie0509 (5) ttjm« tym ręki tych z ImW. Alę słyszałem tu *e obecnie w fabrykach lub tego ro
12 Jerzy Wilkin tego rodzaju wolności odbywa się pewnym kosztem: osoby kierujące społeczeństwem trac
maistre o papiezu0088�01 88 f łh niektórych tego rodzaj j pisarzy, zdawałoby się, iż bronią osobist
6 (260) 330 Liryki religijne nuwiścią. Z tego rodzaju przeciwstawieniami spotykamy się w owej poezji
więcej podobnych podstron