120602

Jeżeli silnik w każdym cyklu pobiera ciepło Q2 z chłodnicy o temp. T* a dodaje ciepło Qi (Qi >Q2) źródłu o temp. Tj (Tj^Ti). Brakująca różnica QrQi pokrywa
a) Dostarczona z zewnątrz praca,
b) Lub Q doprowadzona z dodatkowego źródła.
W pierwszym przypadku silnik działa jako chłodnica obniżając T chłodnicy albo jako pompa cieplna, kosztem W z zewnątrz dostarcza źródła ciepła.
Energia swobodna
Podobną rolę jak entropia czyli wyznaczania kierunku przebiegu zjawiska spełnia w stosunku do przemian izochoryczno-izotermicznych energia swobodna F, wprowadzona przez Helmholtza.
F = U — TS
Jest ona tą częścią całkowitej energii układu, która jest energia dostępną, a więc taką, którą można w każdej chwili zamienić na pracę.
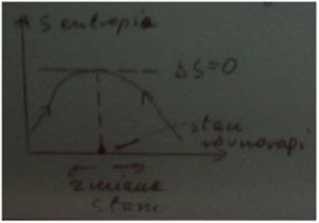
Ponieważ każdy proces nieodwracalny przebiega ze wzrostem entropii, to chociaż całkowita energia układu U jest stała to wartość użyteczna jest coraz to mniejsza, gdyż część energii
^ ^ jest energią związaną, nie nadającą się do wykonania pracy. Zasada degradacji energii. Jeśli w układzie zachodzą przemiany T=const; V=const to warunkiem wystąpienia stanu równowagi termodynamicznej jest minimum F dF — dU — TdS — SdT <, -pdV - SdT aIe dT j dv=0 to dF^O.
Czyli w układzie zachodzą procesy powodujące zmniejszenie F układu, aż do wystąpienia....
W wyniku zmiany N liczby cząstek w układzie energia układu również się zmienia.
Dla zmian odwracalnych dU = dQ + dW + pdN dN - zmiana liczby cząstek w układzie
tŁ - potencjał chemiczny (w przypadku gazu elektronowego w metalach i pół przewodni kach
jest to energia Fermiego. dU = TdS + pdV + pdN
Potencjał chemiczny** — zmianie U układu przy zmianie N o jeden przy S i V=const
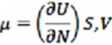
Inna definicja potencjału chemicznego dF — dU — TdS - SdT wstawiając x dF = -pdV - SdT + pdN
N zmiana F przy zmianie N o jeden przy T i V=const.
Mamy dwa metale stykające się ze sobą.
Wyszukiwarka
Podobne podstrony:
190 Wykład z fizyki, Piotr Posmykiewicz silnika? (b) Jeżeli silnik pracuje w cyklu odwrotnym jako lo
różnica temperatur między nimi. Stąd silnik cieplny musi pobierać ciepło ze źródła i oddawać jego
Qw>Qd r
File0603 Policz owoce na każdym talerzu. Ile owoców mogą zjeść dzieci, jeżeli na każdym talerzu musz
img135 135 12.2, TSRMODYS AMICISA SKALA TERMOMETR* C ZNA Jeżeli silnik Carnota umieścimy pomiędzy ci
p1030181 Przepływ danych w cyklu pobierania Fetch_ • Zależy od rozwiązania CPU •
skanowanie0033 Rysunek 10.4. Zjawisko Pelt i era: w obszarze złącza I pobierane ciepło ą jest zużywa
Jak to robią inni? Elektrociepłownie w Austrii Czynnikiem roboczym, pobierającym ciepło z wody
DSC00132 (27) 1. Na jaką wysokość uniesie ciężar o masie 500 kg silnik Carnota, jeśli pobiera 0,5 MJ
56 (160) OBSŁUGAZatrzymywanie silnika Jeżeli silnik nie został uruchomiony, przeprowadzić ponowne ro
więcej podobnych podstron