Obliczenia:
Temperatura przeprowadzania pomiarów: T = 22![]()
C
Przeliczam gęstości w temperaturze T = 22
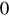
C:
Gęstość ksylenu = ![]()
= 0,760 g/cm![]()
Gęstość wody = ![]()
= 0,88 g/cm![]()
Gęstość metanolu = ![]()
= 0,696 g/cm![]()
Przykład obliczeń dla pierwszego pomiaru:
Obliczam masę:
mw = dw*Vw = 0,88 g/cm![]()
*1cm![]()
= 0,88 g
mk = dk * Vk = 0,760 g/cm![]()
*9 cm3 = 6,84 g
mm = dm * Vm = 0,696 g/cm![]()
*27 cm3 = 18,79 g
Obliczam masę całkowitą m:
m= mw + mk + mm = 0,88 g + 6,84 g + 18,79 g = 26,51 g
Obliczam skład procentowy (% wagowe ) otrzymanych mieszanin jednofazowych:
%wody = ![]()
= 3,3%
%ksylenu = ![]()
= 25,8 %
%metanolu = ![]()
= 70,9 %
W ten sam sposób dokonuje się obliczeń dla pozostałych pomiarów.
Wykres izotermy mieszania:
Załączyłam na papierze milimetrowym.
Wnioski:
Celem ćwiczenia było doświadczalne znalezienie takich składników mieszaniny trzech cieczy, tj.: wody, ksylenu i metanolu, przy których w stałej temperaturze układ dwufazowy przechodzi w jednofazowy. Graficzną interpretacją tego jest trójkąt stężeń, tzw. Trójkąt Gibbsa - Roosebooma. Na jego bokach odkłada się skład procentowy odpowiednich składników mieszaniny. W tym celu należało do kolbki zawierającej znane ilości cieczy A (wody) i B (ksylenu) o ograniczonej wzajemnie rozpuszczalności, dodać z biurety kroplami ciecz C (metanol) dobrze rozpuszczalnej w każdej z nich. Cieczy tej należy dodać tyle, aby układ dwufazowy przemienił się w jednofazowy. Skład otrzymanego układu jednofazowego odpowiadający tej przemianie, podaje współrzędne punktu położonego na izotermie mieszania. Wychodząc z cieczy A (woda) i B (ksylen) zmieszanych w innych proporcjach, otrzymuje się współrzędne następnych punktów, które połączone ze sobą tworzą izotermę mieszania. Układ dwufazowy jest dobrze zmiareczkowany wtedy gdy nie jest mętny i nie zawiera zawieszonych kuleczek substancji organicznej. Dalsze dodawanie metanolu powoduje ponowne zmętnienie. Roztwór jest wówczas przemiareczkowany i nie należy już dodawać dodatkowych ilości rozpuszczalnika. Punkt równoważnikowy (zwany również krytycznym) leży na wierzchołku izotermy mieszania. Punkty leżące na płaszczyźnie izotermy mieszania (punkty składów procentowych trzech cieczy) należą do układu jednofazowego. Pole pod izotermą mieszania odpowiada układom dwufazowym złożonym z dwóch trójskładnikowych roztworów, natomiast pole nad izotermą - układom jednofazowym będącym roztworami trójskładnikowymi.
Na wykreślonej przeze mnie izotermie mieszania występuje punkt D, który jest punktem równoważnikowym. Jego położenie jest prawidłowe, bo w najwyższym punkcie izotermy, oddziela on jedną fazę od dwóch pozostałych. W moim przypadku określa on następujące zawartości składników roztworu: woda - 13,6%, ksylen - 7,9%, metanol - 78,05% i są to wyniki z pomiaru siódmego. Przed osiągnięciem pkt. G mój układ uległ zmętnieniu. Jego zniknięcie po dodaniu odpowiedniej ilości metanolu wskazało na przemianę układu dwufazowego w jednofazowy i zakończenie miareczkowania.
Zawartości procentowe poszczególnych składników mieszanin jednofazowych przy kolejnych pomiarach odczytane z wykresu mogą nieco się różnić od wartości obliczonych, co spowodowane jest niedokładnością nanoszenia tych wartości na wykres (niedokładność ludzkiego oka). Izoterma mieszania powinna kształtem przypominać parabolę, jednakże trzy punkty nie znajdują się na krzywej, co świadczy o tym, że przy wykonywaniu pomiarów nr 1, 2, 3 zostały popełnione błędy miareczkowania. Spowodowało to błędy w obliczeniu składów procentowych mieszanin i w związku z tym błędny rozkład tych punktów. Uważam, że błędy pomiarowe mogę uzasadnić również faktem, iż sprzęt pomiarowy, na którym pracowałam był wybrakowany: cieknąca biureta, wyszczerbiona pipeta, starta podziałka na biurecie. Wszystko to doprowadziło do niedokładnego odczytu, co w konsekwencji wpłynęło na dalsze obliczenia.
Bez względu na wyniki mogę powiedzieć, że ćwiczenie zostało przeprowadzone prawidłowo i zgodnie z instrukcją.
Wyszukiwarka
Podobne podstrony:
chemia fizyczna laboratoria, Lab.35, Obliczenia:
zagadnienia lab fiz, WIiTCh PK, Technologia Chemiczna, semestr 3, Chemia Fizyczna, laboratorium
Wzór sprawozdania chemfiz lab, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratoriu
chemia fizyczna laboratoria, iwona-chem. fiz. ćw. 33, Iwona Frątczak
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 16Ania, ffffff
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
więcej podobnych podstron