IZOTERMY ADSORPCJI
Dogodne jest podzielenie wszystkich procesów adsorpcji na dwie kategorie. Podział ten związany jest z rodzajem sił wiążących cząsteczki gazowe z ciałem stałym; mogą to b siły fizyczne lub wiązania chemiczne. Rozróżniamy więc adsorpcję fizyczną\adsorpcję chemiczną, czyli chemisofpcję. Obserwacja cech charakterystycznych dowolnego proce: adsorpcji umożliwia zaliczenie go do jednej z wymienionych kategorii. Adsorpcja może przypominać proces fizyczny, kondensację lub reakcję chemiczną.
Badanie procesu adsorpcji polega najczęściej na wyznaczaniu zależności między ilością gazu zaadsorbowanego przez daną masę adsorbentu a ciśnieniem gazu. Pomiary takie wykonuje się zwykle w stałej temperaturze, a otrzymane wyniki przedstawia się graficznie w postaci tzw. izotermy adsorpcji. W praktyce mierzy się objętość gazu zaadsorbowanego przez daną masę adsorbentu albo określa się zmianę masy adsorbentu poddanego działaniu gazu o określonym ciśnieniu.
Langmuir przyjął, iż chemisorpcja prowadzi do utworzenia na powierzchni adsorbentu warstwy jednocząsteczkowej i rozważał równowagę ustalającą się między fazą gazowa a częściowo utworzoną warstwą jednocząsteczkową.
Ciśnieniu gazu p odpowiada ułamek pokrytej powierzchni Θ. Równowaga ma charakter dynamiczny; szybkość desorpcji jest równa szybkości ich adsorpcji.
Teoria Langmuira zakłada, że szybkość desorpcji jest proporcjonalna do ułamka powierzchni pokrytej przez cząsteczki Θ. Natomiast szybkość adsorpcji jest proporcjonalna zarówno do ciśnienia gazu p, jak i do ułamka powierzchni jeszcze nie pokrytej przez zaadsorbowane cząsteczki (1-Θ). W stanie równowagi szybkości desorpcji i adsorpcji są równe:
![]()
Wprowadzając współczynnik aproksymacji b=k/k' można napisać:
![]()
Doświadczalna izoterma adsorpcji jest obrazem zależności między ilością gazu zaadsorbowaną przez daną masę adsorbentu a ciśnieniem gazu. Liczba moli substancji n zaadsorbowana pod pewnym ciśnieniem p oraz ilość substancji nm potrzebna do utworzenia warstwy jednocząsteczkowej powiązane są ze stopniem pokrycia powierzchni Θ zależnością (oraz a=n/m
i am=nm/m, gdzie: m-masa adsorbentu):
![]()
Dla łatwiejszego porównania teorii Langmuira z doświadczeniem przekształca się do postaci:
![]()
Freundlich podał empiryczne równanie izotermy adsorpcji, dość dobrze opisujące adsorpcję gazów, stosowane jednak głównie w przypadku adsorpcji z roztworów. Równanie Freundlicha ma postać:
![]()
gdzie: y oznacza masę substancji zaadsorbowanej przypadającą na l g adsorbentu, c — stężenie substancji rozpuszczonej w roztworze, k i n — stałe empiryczne. Dogodne jest posługiwanie się logarytmiczną postacią równania:
![]()
Jeżeli dane doświadczalne spełniają równanie Freundlicha, graficznym obrazem zależności lny od lnc jest linia prosta. Umożliwia to wyznaczenie stałych równania Freundlicha na podstawie nachylenia prostej i odcinka wyznaczonego przez prostą na osi rzędnych.
WYKONANIE ĆWICZENIA
Do kolbek na 150 cm3 z korkiem dodajemy niewielkie ilości węgla aktywnego (ok. 0,5 g). Następnie sporządzamy roztwory kwasu octowego (po 100 cm3), zgodnie z tabelą:
Tabela objętości kwasu i wody, z których sporządzono roztwory oraz mas absorbentu.
Nr kolbki |
1 |
2 |
3 |
4 |
5 |
6 |
Masa adsorbentu [g] |
0,510 |
0,495 |
0,495 |
0,490 |
0,500 |
O,500 |
Objętość wody [cm3] |
98,5 |
96,5 |
94,0 |
90,0 |
87,0 |
80,0 |
Objętość kwasu octowego [cm3] |
1,5 |
3,5 |
6,0 |
10,0 |
13,0 |
20,0 |
A następnie dodajemy do naważek adsorbentu. Tak przygotowane kolbki pozostawiamy na 2h wstrząsając ich zwartość co 10 minut. W tym czasie oznaczamy dokładnie stężenie użytego kwasu octowego pobierając pipetą po 1 cm3 kwasu (V0 kw) i miareczkujemy 0,1 M roztworem wodorotlenku sodu (pomiar powtarzamy trzykrotnie).
Po zakończeniu adsorpcji sączymy każdy z badannych roztworów, następnie pobieramy po 10 cm3 każdego roztworu i miareczkujemy, dwukrotnie, mianowanym roztworem wodorotlenku sodu o stężeniu 0,1 M.
ZESTAWIENIE WYNIKÓW
Na zmiareczkowanie użytego w doświadczeniu kwasu octowego (1cm3) zużyliśmy: 40,33 cm3 wodorotlenku sodu (V0 zas).
Po przesączeniu roztworów, po adsorpcji, miareczkujemy je dwukrotnie wodorotlenkiem sodu i otrzymujemy następujące objętości zasady:
Tabela objętości zasady.
Nr kolbki |
Objętość zasady zużyta na zmiareczkowanie roztworu kwasu po adsorpcji V [cm3] |
|
|
I pomiar |
II pomiar |
1 |
5,6 |
5,7 |
2 |
13,9 |
14,0 |
3 |
24,7 |
24,8 |
4 |
40,1 |
40,1 |
5 |
52,4 |
52,6 |
6 |
82,4 |
85,6 |
Dane pomiarów adsorpcji z roztworów można obliczać przy pomocy izotermy Freundlicha. Na wstępnie obliczamy:
1. masę kwasu przed adsorpcją w poszczególnych kolbkach:
![]()
gdzie: Vk - objętość kwasu octowego przed adsorpcją,
V0zas - objętość zasady zużyta na oznaczenie miana kwasu,
V0kw - objętość kwasu octowego pobrana do oznaczenia miana,
czas - stężenie zasady,
M - masa molowa kwasu.
Obliczone masy:
m01 = 0,363 g
m02 = 0,847 g
m03 = 1,452 g
m04 = 2,418 g
m05 = 3,146 g
m06 = 4,836 g
masa kwasu po adsorpcji w poszczególnych kolbkach:
![]()
gdzie: Vz - objętość zasady zużyta na zmiareczkowanie roztworów po adsorpcji,
Vw - objętość wody,
Vad - objętość roztworu pobrana do oznaczenia (wartość stała 10 cm3).
Obliczone masy:
m1 = 0,339 g
m2 = 0,837 g
m3 = 1,485 g
m4 = 2,406 g
m5 = 3,150 g
m6 = 4,944 g
Masy przed adsorpcją nie mogą być mniejsze od mas po adsorpcji więc masy podkreślone (wyniki 3,5, i6) są błędne. Do dalszych obliczeń będziemy wykorzystywać wartości poprawne.
masa zadsorbowanego kwasu z poszczególnych roztworów:
![]()
czyli:
x1 = 0,024 g
x2 = 0,010 g
x4 = 0,012 g
stężenie kwasu w warunkach równowagi:
![]()
czyli:
c1 = 0,057 [g/mol]
c2 = 0,140 [g/mol]
c4 = 0,401 [g/mol]
Kożystając z logarytmicznej postaci izotermy Freundlicha:
![]()
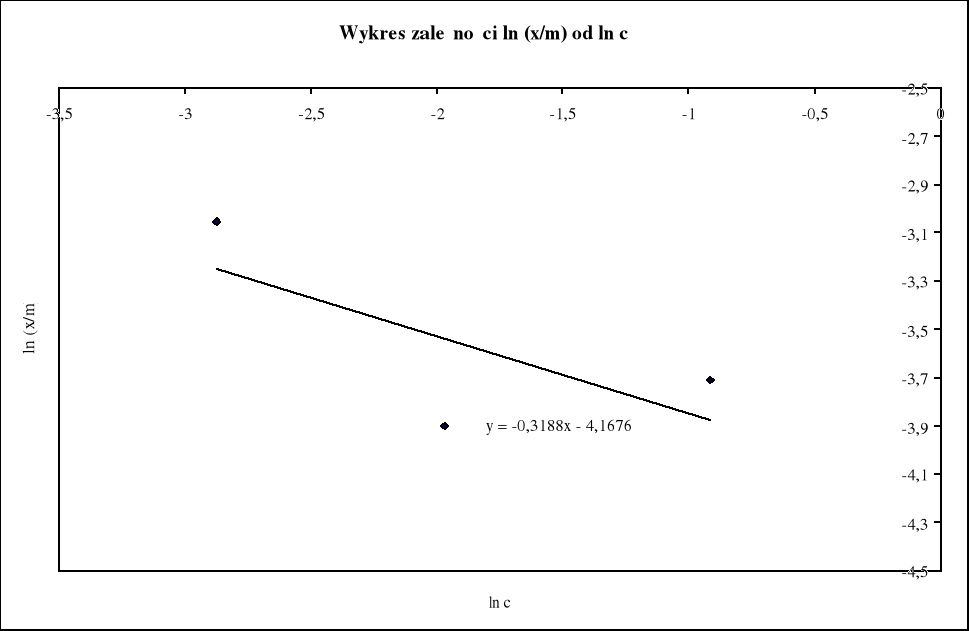
możemy wyznaczyć stałe k i n, kreśląc wykres w układzie współrzędnych ln(x/m), ln c oraz aproksymujemy wielomianem pierwszego stopnia.
Odczytane z wykresu równanie linii trendu y = -0,3188x - 4,1676 odpowiada logarytmiczną postacią izotermy Freundlicha, czyli: y = ln (x/m), x = ln c, ln k = - 4,1676 oraz n = - 0,3188, można więc zapisać: ln (x/m) = - 4,1676 - 0,3188 ln c.
Stałe z powyższego równania mają wartości:
n = - 0,3188 k = 0,015
WNIOSKI
Doświadczenie miało na celu określenie ilości kwasu octowego zaadsorbowanego w stałej temperaturze, z rozcieńczonych roztworów o różnym stężeniu, na węglu aktywnym.
Z pośród pomiarów przeprowadzanych dla sześciu różnych stężeń tylko trzy są poprawne i na ich podstawie zostały wyznaczone stałe k i n w równaniu izotermy Freundlicha. Błędy w oznaczeniu stężenia po adsorpcji mogły być spowodowane zbyt słabym mieszaniem roztworów w czasie prowadzenia adsorpcji, co zmniejszyło powierzchnię adsorpcji; oraz ponowne napełnianie biurety w czasie miareczkowania.
Wyszukiwarka
Podobne podstrony:
LISTOPAD 5l., plany miesięczne 5 latki
5.5L, technologia chemiczna, chemia fizyczna, sprawozdania z chemi fizycznej, 5.5
MARZEC 5l., plany miesięczne 5 latki
8.5L, Izotermy adsorpcji 8.5L, Izotermy adsorpcji
11 2 5L 5 CYL
Dydaktyka inf opracowanie, Dydaktyka Informatyki opracowane zagadnienia, Zagadnienia do egzaminu Dyd
ŻYCIE ZWIERZĄT W OKRESIE ZIMY-5l, las
Poznajemy Figurolandię 5l (1)
11. Mydło w płynie 5l, HACAP
5l. u progu szkoły - rozwój dz. 5l
inscenizacje, dzien.babci.dziadka.5l
Spotkanie z Mikołajem. Moja ulubiona zabawka-5l, PRZEDSZKOLE, Mikołajki
karta pracy percepcja wzrokowa 5l
Oczekujemy na przyjście Mikołaja-5l, PRZEDSZKOLE, Mikołajki
PLAN PRACY IX13 5L
CZERWIEC 5l., plany miesięczne 5 latki
pit 5l
więcej podobnych podstron