56820

Jeżeli metal zanurzony do roztworu wykazuje matą aktywność chemiczną Gak np. metale szlachetne) - następuje proces przeciwny: dodatnie jony z roztworu osadzają się na jego powierzchni, która ładuje się dodatnio, a warstwa roztworu najbliższa powierzchni metalu ładuje się ujemnie.
Układ składający się z metalu zanurzonego w roztworze elektrolitu nazywa się umownie elektrodą lub półogniwem Potencjał elektryczny na granicy metal/roztwór nazywa się potencjałem elektrody.

Zależność tę ujmuje wzór Nernsta:
dla elektrody, na której zachodzi reakcja elektrodowa:


wzór Nemsta ma postać (postać uproszczona):
|
2,303 RT | |
|
e = e° +............. z F |
log aMz+ |
gdzie: £ - potencjał elektrody
£° - standardowy (normalny) potencjał elektrody R - stała gazowa T - temperatura bezwzględna z - ładunek jonu aMz+ - aktywność kationów [mol/dm3] F - stała Faradaya - czyli ładunek potrzebny do wydzielenia na elektrodzie 1/z moli substancji, gdzie z jest liczbą elektronów występujących w równaniu reakcji elektrodowej; F równa się 96 500 C • mol.
Dla:
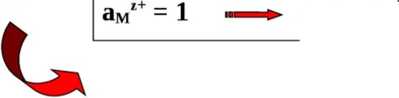
£ — £° <
Wyszukiwarka
Podobne podstrony:
Scan0007 (50) /ml dnia 1. Płytkę cynkową o masie 50 g zanurzono do roztworu azotan
image05 elektroda cynkowaPółogniwo I rodzaju metal zanurzony w roztworze swoich kationów półogn
skanuj0049 2 Jeżeli próba z jonami Cr04: dała wynik ujemny, wówczas do roztworu analizowanego zawier
e4 2 -t> * 57. Jeżeli soczewkę ze szkia o współczynniku załamania względem powietrza n zanurzyć
1. Badano stężenie jonów srebra w roztworze. W tym celu zanurzono do
1003ga -A ^ 57. Jeżeli soczewkę ze szkła o współczynniku załamania względem powietrza n zanurzyć do
skanuj0049 (4) Jeżeli próba z jonami Cr042 dała wynik ujemny, wówczas do roztworu analizowanego zawi
84591 P5101351 ElektrochemiaElektrody Metal MBuraont do romroiu swoich jonów: a) wysyła jon* do rozt
Płytka ta zanurzona jest w roztworze mocnego kwasu o jednostkowej aktywności jonów wodorowych.
fizykaegz3 J> 57. Jeżeli soczewkę ze szkła o współczynniku załamania względem powietrza n zanurzy
Image49 ^ 57. Jeżeli soczewkę ze szkła c współczynniku załamania względem powietrza u =zanurzyć do c
więcej podobnych podstron