55261

(I=const)
JA^J
W][L\
Aby przeliczyć termodynamiczne stale trwałości (a takie stale są najczęściej umieszczane w tablicach) na stale stężeniowe (warunkowe, dla określonej siły jonowej) należy użyć współczynników aktywności.
Tak więc:
pT = [ML,,]fMIjl /([M]f„ [L]" fi") = W, fiu ‘fi." [ML„]/([M][L]“) P = PTfiuu‘'Łifi."
Należy dodać, że największa zmiana współczynników aktywności następuje przy przejściu od stężeń bliskich zera do stężeń umiarkowanych, powiedzmy 0,05. Dalsza zmiana współczynników aktywności w zakresie 1=0,05 do 1=0,3 jest zwykle mniejsza.
Dla naszych celów będziemy używać następującego uproszczenia Stałych termodynamicznych będziemy używać dla roztworów trudnorozpuszczalnych osadów w wodzie, a stałych warunkowych wynikających z interpolacji danych z tabeli dla siły jonowej wynikającej z waninków zadania W przypadkach, gdy końcowa siła jonowa jest tradna do przewidzenia, przyjmować będziemy stalą dla 1=0,IM
Jeśli rozważamy proces dysocjacji tego samego kompleksu na składniki, zamiast stalą trwałości można posługiwać się stalą nictrwalości, która jest odwrotnością stałej trwałości
ML,, = M + n L * = ± = MHL
P [A//.„ ]
Bilans metalu w roztworze, w którym współistnieją jony metalu oraz kilka kompleksów MLi, ML2, ML,, itp. można opisać równaniem (przyjmując p0= 1):
C„ = [M] + [ML] + [ML:] + [ML;] + ... = [A/£>,[L]'
Przykład
Obliczyć stężenia jonów Ag+ oraz SCN obecne w 0,05M roztworze K[Ag(SCN)2). Rozwiązanie.
Po pieiwsze z tabeli stałych trwałości musimy wybrać stalą odpowiednią do występującej siły jonowej Musimy ją obliczyć Siła jonowa będzie wynikała przede wszystkim z dysocjacji związku według równania K[Ag(SCN);] -> K* + Ag(SCN); Ponieważ jest to elektrolit 1-1 siła jonowa równa się stężeniu kompleksu I=c=0,05. Odczytujemy log p = 8,76, czyli p=10&76= 5.754-108
Teraz możemy zająć się dysocjacją komplekowego anionu na składniki:
Ag(SCN); <=> Ag' + 2 SCN' start 0,05 0 0
równ. 0,05-x x 2x
Wstawiamy te wartości do wzoru na stalą trwałości kompleksu [Ag(SCN), ] _ 0,05 - ,v r 0,05 [,lg'][SCA ]: ,r(2.v)! * 4.v'
Po prostym przekształceniu mamy:
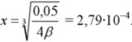
2
Wyszukiwarka
Podobne podstrony:
ŚRODY RADOSNEJ Tak jak rosa ożywia każd^ kwiat Tak ja ż^czę, aby dla Giebie piękniejszy&nb
skanuj0057a pełnej relacji Ja-Ty usiłuje zatrzymać na stałe jej kopię, stracił już widzenie. Nie jes
Zagadka Możesz jej siłę zamienić w prąd, gdy na rzece stoi przeszkoda I z uporem ją piętrzy aby napę
INSTRUKCJA PUG@5 B Rozbiórka i naprawa gaznika m Odkręcić pokrywę gaźnika i ostrożnie ją zdjąć, aby
65248 skanuj0016 (305)
Tak więc natura przeznaczyła ziemię do wspólnego władania i urządziła ją tak, aby trzeba było
06 ?korowanie potraw marchewka Z długiej, prostej marchewki odkrawamy końce. Obkrawamy ją tak aby
dekorowanie potraw marchewka3 Z długiej, prostej marchewki odkrawamy końce. Obkrawamy ją tak aby p
DSC00134 d. wszystkie odpowiedzi iwą jw»»Wkwc, Aby przeprowadzić prawidłową diagmwnyltf a)
Zagadnienia�4 SF..M1NARH M IV KRYSTALIZAC JA I OTRZYMY W ANI!KRYSZTAŁÓW 1 Termodyi
P1010035 c. Sterylizacja gorącą parą wodną pod ciśnieniem — sterylizac ja w autoklawie. Aby uzy
więcej podobnych podstron