55262
Rodzaje reakcji jonowych:
• reakcje zobojętniania (neutralizacji);
• reakcje strącania osadów;
• reakcje wydzielania gazów;
• otrzymywania słabych, niezdysocjowanych elektrolitów;
• reakcje utlenienia i redukcji (omówione oddzielnie);
• reakcje hydrolizy,
• reakcje kompleksonowania
Hydroliza
- to reakcja związku chemicznego z wodą w wyniku której powstają jony oksoniowe (hydroksylowe - H30*) lub hydroksylowe (OH ) ze związków nieorganicznych hydrolizie ulegają sole: mocnych kwasów i słabych zasad, słabych kwasów i mocnych zasad oraz słabych kwasów i słabych zasad
spośród związków organicznych hydrolizie ulegają: alkoholany i fcnolany (do alkoholi i fenoli); sole kwasów karboksylowych (do kwasów); estry (do kwasów i alkoholi lub soli kwasów karboksylowych i alkoholi); amidy w zależności od środowiska do amoniaku i soli kwasów karboksylowych lub kwasów karboksylowych i soli amonowych tłuszcze do glicerolu i kwasów karboksylowych: peptydy i białka (do aminokwasów); wielocukry (do cukrów prostych). Czasami hydroliza, zwłaszcza związku organicznego wymaga wytworzenia
odpowiedniego środowiska.
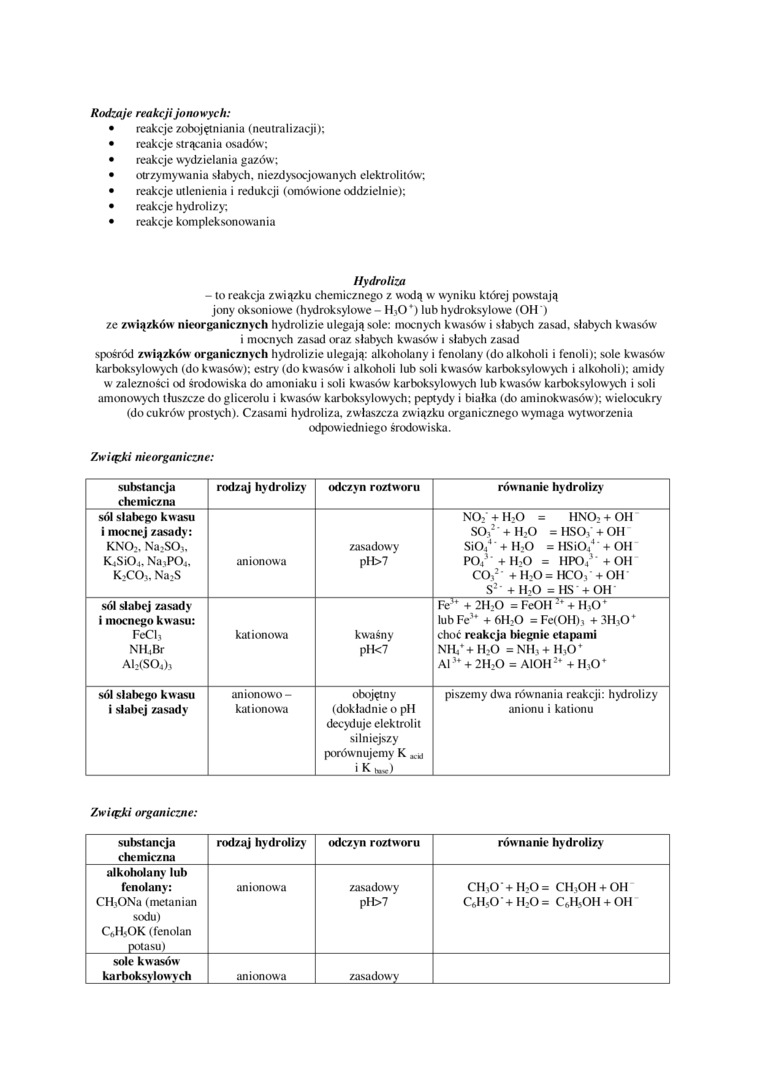
Związki nieorganiczne:
|
substancja chemiczna |
rodzaj hydrolizy |
odczyn roztworu |
równanie hydrolizy |
|
sól słabego kwasu i mocnej zasady: KNO:. Na:SO,. KjSiOj. Na,P04, K>CCh, Na>S |
anionowa |
zasadowy pH>7 |
NO> + H>0 = HNO; + OH SÓ>: +H;0 = HSO» + OH SiO/+ HjO = HSiO/' + OH P04' +HO = HPO/+OH COr +H>0=HC0, +OH S: +H20 =HS +OH |
|
sól słabej zasady i mocnego kwasu: FeCI, NH.Br AI>(S04)j |
kationowa |
kwaśny pll<7 |
Fe,ł + 2H>0 = FeOH -* + H,0* lub Fe?* + 6HO = Fet OH) , + 3H3Oł choć reakcja biegnie etapami NIV+H_'0 *NHj+HjO* Alu + 2H>0 = AlOH-’* + H3Oł |
|
sól słabego kwasu i słabej zasady |
anionowo -kationowa |
obojętny (dokładnie 0 pH decyduje elektrolit silniejszy porównujemy K i*«~) |
piszemy dwa równania reakcji: hydrolizy anionu i kationu |
'/.wiązki organiczne:
|
substancja chemiczna |
rod/.ąj hydrolizy |
odczyn roztworu |
równanie hydrolizy |
|
alkoholany lub fenolany: CH.ONa (metanian sodu) CftH3OK (fenolan potasu) |
anionowa |
zasadowy pH>7 |
CH.O' + H20 = CH,OH + OH CftHjO* + H;0 = C6HsOH + OH |
|
sole kwasów karboksylowych |
anionowa |
zasadowy |
Wyszukiwarka
Podobne podstrony:
skanuj0023 (110) 1) REAKCJE ZOBOJĘTNIANIA W ŚRODOWISKU NIE WODNYM Najlepszym rozpuszczalnikiem przy
Egzamin maturalny z chemii Poziom podstawowyZadanie 15. (2 pkt) Przeprowadzono reakcją zobojętniania
Warunki skuteczności wsparcia Dostosowanie rodzaju wsparcia do rodzaju reakcji na niezaspokojon
Rodzaje wsparcia a rodzaj reakcji (2) lęk niepewność Wsparcie informacyjne
Rodzaje wsparcia a rodzaj reakcji p) Nieefektywna strategia obronna -
Rodzaje wsparcia a rodzaj reakcji (4) Kryzys Wsparcie duchowe egzystencjalny - „ograniczenie
Rodzaje reakcji anafilaktycznych: 1. Reakcje IgE-zależne (np.
Ten sam bodziec może wywołać kilka rodzajów reakcji. Dostosowane są one do okoliczności w jakich czł
Metody otrzymywania soli 1. Reakcja kwasu z zasadą -reakcja zobojętnienia NaOH + H
chemia nowej ery 2 kartkówki z doświadczeń reakcja zobojętnienia 001 •~X Kartkówka Temat: Reakcje zo
RYBOZYMY przeprowadzają trzy rodzaje reakcji biochemicznych: 1) cięcie
Zdjęcie0293 (2) 2. Napis/ reakcje zobojętnienia, w których otrzymasz a) b) c) 0 +Z
Zdjęcie0510 Ćwitanit Iii. ALERGIA 1. Alergia Definicja alergii. Rodzaje reakcji na
więcej podobnych podstron