67295

REDOKSYMETRIA

Rów - Nesta E = E°‘ lg
E°= nonnalny poc. Układ Ox/Red Stęż. równoważne 0x = Red.
Krzywa miareczkowania roztworu FeS04 roztworu Kn04
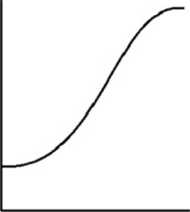
Obliczanie punktów krzywej miareczkowania redoksy metrycznego - manganometiia Oznaczenie sacharydów opaite na redukcji soli miedzi (II) w środowisku alkalicznym przez cukry redukujące:
- metoda Bertranda ( mangan )
- Luffa - Schooda (jod orne tria)
- metoda Fehlinga ( odbarwienie po redukcji całej miedzi w płynie )
Miareczkowanie redoksy metryczne
Reakcje utleniania i redukcji, będące podstawą miareczkowania redoksymetrycznego, przebiegają znacznie wolniej od reakcji jonowych (np. alkacymetria). Wymiana elektronów pomiędzy jonami przebiega w kilku etapach, a najwolniejszy z nich decyduje o szybkości całego procesu.
Oxi+ me —> Redi | n:
Ręd: -> Qxz + luę 1 m
1120x1 + ni Red:= mRedi + ni0x2
Wyszukiwarka
Podobne podstrony:
REDOKSYMETRIA Ogniwo galwaniczne zbudowane z dwóch układów reakcji. Rys. 1 Rów - Nesta E = E°* lg E°
REDOKSYMETRIA Ogniwo galwaniczne zbudowane z dwóch układów reakcji. Rys. 1 Rów - Nesta E = E°* lg E°
Zdj 25252525EAcie0961 Wzór Narosła E - potencja) redoks badanego układu E°- standardowy potencjał pó
CCF20110121�202 Tabela potencjałów redoks Elektroda redoks Reakcja elektrodowa E°(V) 1. SO42-, S
REDOKSYMETRIA Ogniwo galwaniczne zbudowane z dwóch układów reakcji. Rys. 1 Rów -Nesta E = E0*
IMG 44 Ej -E» Jcicli rozważny układ znajduje się w sianie ustalonym. z zależności (S 3) wyn). ka. Ze
OX-lg mysie immunoglobuliny (Ig) wyznakowane OX PCI chlorek pikrylu (ang. picryl chloride); TNP-CI
37766 polityka społeczna i gospodarcza wykłady (15) uhIl^oscf Wfc/oj <"
6 (859) (^X,ycW Aa^. 2aJj Łg- 2. AfliA- *, AUt®La® UuMh w £*~e ę^.. trvv &X
mechanika gruntów09 A *.J (/U^Aok-^. Łg i 3=1 —ę-^vt- _
strona 2 dziennik?g tGJUZctjy JUjiĄUjQjAY)} ^ c^aZo3ue^Iv £pn3-fy O&Ot f poc(
szereg napięć Szereg napięciowy półogniw redoks Półogniwo Reakcja elektrodowa E°(V1
PICT0177 91 9 9 9 9 9 9 aj r r e r ^ t d -4 -4 -4 *4 O O Oj !&S8 §£g ItNM 8 1 9999 9999 99 999
img017 2 Bytom, dnia 22.10.2009 Miejski Ośrodek Pomocy RodzinZE-9034- £G~I//1 /~E>t /O 9
więcej podobnych podstron