84864

Wiązanie koordynacyjne symbolizujemy jako -> (od donora do akceptora)
Przykład: H, 4- H* = NH4*
H
H
H - N : + H
II - N
II
H
H
azot - donor
jon Hł - akceptor
5. Teoria orbitali molekularnych
Teoria OM zakłada, że zachowanie się elektronu w cząsteczce opisuje orbital molekularny (analogia do orbitalu atomowego). Obowiązuje zakaz Pauliego- maksymalnie dwa elektrony na jednym orbitalu.
Efektywny orbital molekularny powstanie gdy:
a) oba orbitale atomowe mają porównywalną energię elektronów,
b) oba orbitale atomowe pokrywają się,
c) oba orbitale atomowe mają tę samą symetrię w stosunku do osi łączącej oba jądra. orbitale tvou s
powstają wiązania typu sigma
■rtk;2t6 a:orrK*e orbita* motHutorr* symbol orbitalu
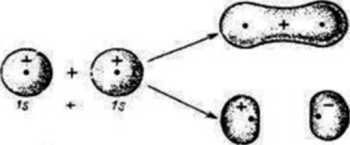
moltkulamtgo
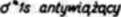
przykłady: H2, (He*)*, Li*
orbitale typu p
Wyszukiwarka
Podobne podstrony:
DSC01341 (10) System transportuelektronów: ■ przenosi elektrony od donora do
Schowek46 Rozkład grup konsumentów w zależności od skłonności do akceptacji innowacji oraz ichznaczą
przeciętnych energii wiązań kowalencyjnych, które wynoszą od 200 do 800 kJ/mol oraz kilkukrotnie mni
Metody Analizy finansowej Metoda dedukcji- od ogółu do szczegółu - Przykładem metody dedukcji jest
SolIdWorks 2003 Podręcznik Szkoleniowy Lekcja 10 Modolowanle Ztożonla Od Modelu Do Zlołania Przykład
81092 PA080171 HX>* Wiązanie koordynocyjrie (donorowo - akcept Jeden otom daje parę elektronów do
Wiązanie koordynacyjne Tworząca je para elektronów pochodzi od jednego atomu -donoru Akceptor uzupeł
IMAG0180 (3) lązanie donorowo-akceptorowe -wiązanie koordynacyjne •• ••• lązeniekoordynacyjne
4e Symbole graficzne front?w atmosferycznych W tej strefie, o szerokości od kilkudziesięciu do kil
IMG!99 (6) Drugie ujęcie subkultury wydaje się lepiej eksponować jej cechy w od* niesieniu do młodzi
172 Ryszard Domański Oznaczenia / Symbols 1) p -prawdopodobieństwo przejścia od postawy i do postaw
1 OD PARADYGMATU DO METODY. ONTOLOGIA DZIEDZINOWA JAKO SPOSÓB REPREZENTACJI WIEDZY O WSPÓŁ
więcej podobnych podstron