96236

CH4+2,1 02 + 7,9 N 2 —♦ CO 2+ 2 H 20+ 7,9N2+0,1 O
Uwaga: w spalinach jest tlen.
Całkowita liczba moli spalin N równa się:
N=1 mol CO2+ 2 mole H 20 +7,9 mola N 2+ 0,1 mola O 2=11 moli
Udziały molowe składników spalin, wg analizy mokrej (woda w postaci pary) przedstawiają się następująco:
[CO 2)=^ wo^CQ 2=9,09 %C02 obj.
| H20 2 m0l^H 2°=18,2 % H 20 obj.
1= 11
0,1 mola O A
1 n
7,52 mola N 10,52
10 2)= )=
=0,91 % 02 obj. 2=71,82 %N2obj.
* Zapotrzebowanie powietrza spalania
Teoretyczne zapotrzebowanie powietrza do spalania oznacza ilość powietrza przypadającego na jednostkę paliwa w stechiometrycznej mieszanki palnej. Dla paliw gazowych określa się je w m '/m' w warunkach normalnych. Przeczywiste zapotrzebowanie powietrza do spalania zależy od założonego nadmiaru powietrza.
Współczynnik nadmiaru powietrza (A)
całkowita ilość powietrza do spalania_
teoretyczna ilość powietrza do spalania
20,9
' 20,9 -[02]
* Współczynnik ekwiwalencji (FUEL RATIO)
W literaturze anglojęzycznej częściej niż współczynnikiem nadmiaru powietrza A posługuje się współczynnikiem <J).
T
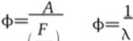

A s
F-ilość moli paliwa, A-iloścf moli powietrza, s-stechiometryczny
* AIR/FUEL RATIO (AFR) i FUEL/AIR RATIO (FAR)
Ze względu na łatwość wyznaczania w praktyce zastosowanie ma stosunek strumienia powietrza do paliwa określany jako AFR (Air/Fuel Ratio) AFR= F/A
A-strumień powietrza (A-air) [kg s], F-strumieri paliwa (F-fuel) [kg s]
Podobnie definiuje się FAR (Fuel/Air Ratio).
♦ Współczynnik nadmiaru powietrza a rodzaj płomienia Rodzaj płomienia (hib skład mieszanki):
-bogaty: A<1, <J>>1 -stechiometryczny: A=l, 4>=1 -ubogi: A>1, <J)< 1
* Nadmiar płomienia (11)
caŁkmtiLa^Lęorętyęzna ilość powietrza do
pte
Związek współczyiurika
teoretyczna ilość powietrza do
nadmiaru pow. i nadmiaru powietrza
n=(A-l)*100%
♦ Przykład
Teoretyczne zapotrzebowanie powietrza do spalenia CHt wynosi 9,52 m7m\ Przyjmując:
-strumień metanu V=10 mJ/h -strumień powietrza V=114.62 m'/h otrzymuje się:
Wyszukiwarka
Podobne podstrony:
Na(s) + Cl2(g) A l + I2= c CH4 + 02 = PbS + 02 = PbO + CO =oo Równania do uzgodnienia mogą
r6 — tE 79/H-01550-131 Pręł iO * 800 mm wg PN-7S/H-932D0.02 ot* <t i}rnm do B na otmadzie co 20&
3 (1432) 10. Standardowa entalpia tworzenia reakcji: 2 CH4 (g) + 3 02(g) —> 2 CO(g) + 4 H2O
skanuj0015 * ZJAWISKO KONWtR (SS/WCJ/ .......... “ Co pcxj/.obuc.cr.c/o. tcto-so
Image32 1 Lm(co)[dB] = 20 log A (co) = 20 log —.-h+(tór)2
skanuj0495 (2) Rozdział 20. ♦ Forum 513 Zadaniem funkcji showThreads jest wyświetlenie listy wątków.
img031 31 Acniiwt 4pa«MX 1* ł’ J* f f J1 S ♦ "j
img079 79 Hya. 8$ RyG. B4- działu lirabusa. Liabus je st podzielony w odstępach co 20 , skala natomi
PICT3809 2i^v ca Gt6L %L <ft ^ fctz^e z 4m t o(/T A MP^I b AU) J- ^ / ✓-y^ C
więcej podobnych podstron