3784503674
powłokowego. W czasie przepływu prądu stałego przez elektrolit jony metalu przemieszczają się w kierunku pokrywanego podłoża (katody) i wydzielają na nim tworząc powłokę.
Na katodzie osadzanie metalu zachodzi zgodnie z równaniem:
z+ - o
M + z • e — M
Jednocześnie anoda, która zwykle jest z tego samego metalu, co wytwarzana powłoka, rozpuszcza się według równania:
0 z+ -
M -» M + z • e .
Powstające jony metalu zasilają elektrolit, co pozwala utrzymywać ich określone stężenie podczas elektrolizy. Przemieszczanie się jonów podczas elektrolizy jest skutkiem nie tylko przepływu prądu, ale także dyfuzji i konwekcji.
Proces elektrolizy można prowadzić w roztworach elektrolitów zawierających proste jony osadzanych metali, jak i w roztworach zawierających związki kompleksowe (zespolone), przy czym wydzielanie powłok z kąpieli jonów kompleksowych zachodzi przy znacznie obniżonych potencjałach katod.
Podczas elektrolizy możliwe jest jednoczesne wydzielanie na katodzie dwóch lub więcej metali, które tworzą powłoki stopowe, np. przez jednoczesne osadzanie miedzi i cynku wytwarza się powłokę mosiężną.
Na elektrodach poza procesami podstawowymi wydzielania i rozpuszczania metalu mogą zachodzić niepożądane procesy uboczne, na katodzie np. wydzielanie gazowego wodoru, co nie tylko powoduje zużycie części prądu i zmniejszenie wydajności procesu, ale inne szkodliwe skutki, jak np. kruchość wodorową pokrywanego metalu.
CZYNNIKI WPŁYWAJĄCE NA BUDOWĘ POWŁOKI GALWANICZNEJ
Głównymi czynnikami wpływającymi na wygląd powłoki są: gęstość prądu katodowego, stężenie i intensywność mieszania elektrolitu, temperatura, obecność substancji powierzchniowo czynnych, rodzaj elektrolitu, własności metalu, na którym osadza się powłokę.
Przy małych
gęstościach prądu wyładowanie jonów na katodzie
następuje powoli i szybkość wzrostu powstałych już
zarodków
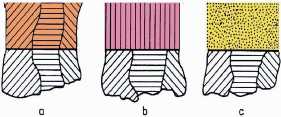
Zasadnicze typy struktur elektrolitycznie osadzanych metali:
Wyszukiwarka
Podobne podstrony:
Wpływ prądu stałego na tkanki -przepływ prądu stałego przez tkanki powoduje wytwarzanie w nich ciepł
2 (2174) Rodzaje pieców elektrycznych oporowe przetworzenie energii w czasie przepływa prądu przez w
Pomiary wielkości ełektrycmych stałych w czasie■ Pomiary prądu stałego— Technika pomiaru prądu »
Siła elektromotoryczna 12 •W przypadku jedno-oczkowego obwodu prądu stałego siła elektromotoryczna j
i ©akcja nerwów i ntięSnł na przepływ prądu stałego Brak skurczu mięśni i. Istmojo
ScanImage07 Zasada budowy maszyny prądu stałegoRodzaje silników elektrycznych: silniki prądu stałego
schem 1. Model silnika prądu stałego Silnik elektryczny prąciu stałego, którego model pokazano na ry
Próbka jest poddawana działaniu pola magnetycznego wywołanego pizez przepływ prądu w cewce m. Przez
zgrz07 Ciepło wydzielone w czasie przepływu prądu w obwodzie zgrzewania określa się na podstawie pra
• hamują wybiórczo przepływ prądu wapniowego przez kanały typu L •
Najbardziej rozpowszechnione źródła prądu stałego: ogniwa elektrochemiczne (baterie i akumulatory)Ty
Na przepływ prądu wpływa Rozmiar elektrod (gęstość prądu) Ułożenie elektrod (opór tkanek
IMGD75 ~ Schemat blokowy serwonapędu tyrystorowego z silnikiem prądu stałego; Ę - sygnał elektryczny
więcej podobnych podstron