2749771535
27. Standardową entalpię każdej reakcji można wyrazić poprzez standardowe entalpie tworzenia
AH ° = 2V, zJHn °
oraz poprzez standardowe entalpie spalania (o ile te ostatnie można zdefiniować dla wszystkich reagentów)
AH ° = - 2V, /tH,pi 0
Uwaga! Posługujemy się tutaj uogóhtionym pojęciem współczynnika stechiometrycznego. Zgodnie z tum. współczynniki stechiometiyczne mają znak - ujemny dla substratów (bo ich ubywa) i dodatni dla produktów (bo ich przybywa w trakcie reakcji). Jest to zgodne z ogólną konwencją, w której w szelkie zmiany rozpatrujemy z punktu widzenia układu. Według tej notacji, dow olną reakcję chemiczną zapisalibyśmy za pomocą formuły:
Ei'jRj = 0
28. Za pomocą stabelary zowanych standardowych entalpii tworzenia lub spalania możemy policzyć standardową entalpię teakcji w tej temperaturze, dla której dysponujemy' danymi tablicowymi. A co z innymi temperaturami? Pojawia się zatem problem zależności zmian entalpii od temperatury. Zależność tę. poprzez pochodną temperaturową, wyraża PRAWO KIRCHHOFFA
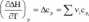
Obliczenie zmian entalpii dla dowolnej temperatury' wymaga scalkowania powyższego równania. Formalnie można to zapisać jako
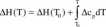
Obliczenie całki jest nieco złożone, jeśli funkcja podcałkowa nie jest ciągła w przedziale <T0,T>. Sytuacja taka występuje dosyć często w obliczeniach fizykochemicznych, a punkty nieciągłości odpow iadają przejściom fazowym. Niech jedno takie przejście ma miejsce w temperaturze T0 < Tf < T. Wtedy całkę należy obliczać oddzielnie w przedziałach <T0,Tr> i <Tf,T> i ostatecznie wyrażenie na zależność temperaturową zmiany entalpii przyjmuje postać:
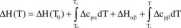
gdzie indeksy a i /? oznaczają fazę nisko- i wysokotemperaturową, a złH„/(jcst zmianą entalpii dla przejścia fazowego a-yfi.
W szczególnym przypadku, zmiana entalpii i pojemności cieplne mogą być standardowe, co wyraża się poprzez odpowiedni indeks. Tak więc aby obliczyć zmianę entalpii (standardowej entalpii) w dowolnej temperaturze, musimy znać wartość zmiany w temperaturze odniesienia T„ oraz zależności temperaturowe pojemności cieplnych.
29. Niekiedy interesuje nas efekt cieplny reakcji w stałej objętości. W tym przypadku równy on jest zmianie energii wewnętrznej a nie entalpii. Podstawową zatem funkcją będzie standardow a energia wew nętrzna (AU°).
Związek pomiędzy zlU ° a zlH ° wynika z definicji entalpii, tj.
dU°= zlH zKp°V°)
co przy pominięciu zmian objętości substancji skondensowanych, prowadzi do AU °= AH Ang RT
i zlng jest zmianą liczby moli reagentów gazowych.
Równanie powyższe można zapisać również i tak
A\J °= zlH 2Vig R7' (sumowanie współczynników slechiomelrycznych dotyczy tytko reagentów gazowych)
30. Tcrmochcmiczna energia wiązań.
W przy padku braku właściwych danych można dokonać oszacowania efektów cieplnych posługując się jedną z wielu metod przybliżonych. Z reguły są one oparte na addyty w ności udziałów pochodzących od wiązań chemicznych. Wy maga to uprzedniego założenia, że energia potrzebna do powstania/ rozerwania określonego w iązania, nie zależy od sąsiednich w iązań oraz atomów', w
Wyszukiwarka
Podobne podstrony:
19528 P1010930 (3) Równanie drogi najprościej można wyrazić poprzez kąt cpft) mierzony od ustalonej
43642 P1010930 (4) Równanie drogi najprościej można wyrazić poprzez kąt <p(t) mierzony od ustalon
W najbardziej ogólnym wypadku szybkość reakcji kontaktowej można wyrazić wzorem [7j: gdzie: k. = sta
Wniosek: Entalpie danej reakcji można uzyskiwać z entalpii innych reakcji. Każda reakcja = reakcje t
3 (1432) 10. Standardowa entalpia tworzenia reakcji: 2 CH4 (g) + 3 02(g) —> 2 CO(g) + 4 H2O
DSCN4160 (4) Obliczanie ciepła reakcji z entalpii tworzenia Mając dane entalpie tworzeni*, odlicz st
Image001 Czego chce Ewa Kiedy można było poprzestać na podstawówce, dzieci Reginy na niej poprzestaw
Top 7 — rzadko, a niektóre są. całkiem unikalne, dla każdej z nich można/ obliczyć wskaźnik oryginal
więcej podobnych podstron