2982019603
1.5.4 Odczyn biuretowy
W wyniku reakcji związków zawierających wiązanie peptydowe z jonami miedzi(II) w środowisku zasadowym powstają barwne, niebieskofioletowe kompleks}. Podobną reakcję wykazuje mocznik, który, w obecności zasady, tworzy dimer, zdolny do kompleksowania jonów miedzi w sposób podobny do peptydów.
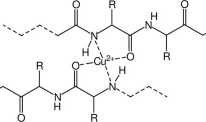
Barwa jest tym intensywniejsza, im dłuższy jest peptyd (im więcej wiązań peptydowych wchodzi w skład cząsteczki)
1.5.9 Reakcje aminokwasów siarkowych
W reakcji cysteiny lub cystyny z gorącym roztworem NaOH powstaje siarczek sodu, który, w obecności rozpuszczalnych soli olowiu(II) tworzy czarny osad PbS.
1.6 Strącanie, dcnaturacja i wysalanic białek
Białka wykazują dużą zmienność rozpuszczalności w zależności od pH roztworu, jego siły jonowej, stałej dielektrycznej rozpuszczalnika oraz temperatury.
Dodanie do wodnego roztworu białka mniej polarnego rozpuszczalnika, np.: etanolu czy acetonu, powoduje obniżenie względnej przenikalności elektrycznej układu. W efekcie obniża się stopień hydratacji i rozpuszczalność białek i peptydów. Wprowadzenie odpowiednio dużej ilości takiego rozpuszczalnika powoduje wytrącenie się białka.
Większość białek wykazuje najmniejszą rozpuszczalność w roztworze o pH bliskim ich punktowi izoelektiycznemu. W punkcie tym ładunek cząsteczki białka wynosi zero, zatem na cząsteczki nie działają odpychające sil}- elektrostatyczne (w pH różnym od punktu izoelektrycznego molekuły białka są obdarzone ładunkiem, zatem, na skutek oddziaływań coulombowskich odpychają się), co sprzyja agregacji cząsteczek białka. Ze względu na występowanie, w cząsteczkach białek, aminokwasów zasadowych lub kwasowych, na powierzchni molekuły tworzą się często centra (rejony), obdarzone lokalnym ładunkiem. By zapobiec oddział}waniom przyciągającym miejscowych różnoimiennych ładunków pomiędzy molekułami protein, konieczna jest obecność w roztworze pewnej ilości jonów, które poprzez oddziaływania elektrostatyczna wiążą się z cząsteczkami białka, równoważąc w ten sposób ładunki lokalne, a co za tym idzie, zapewniając symetrię rozkładu potencjału elektrycznego i, gromadząc się na powierzchni cząsteczki, znoszą międzyinolekularne oddziaływania elektrostatyczne, dodatkowo podwyższając stopień hydratacji, uniemożliwiając tym samym agregację i wytrącanie peptydu. Efekt tea polegający na zwiększeniu rozpuszczalności białek w wyniku dodania pew nej ilości związków jonowych do roztworu obserwuje się szczególnie wyraźnie dla białek o dużej asymetrii rozkładu ładunków (np.: albuminy). Z dnigiej strony, dodatek dużej ilości związków jonowych, powoduje wytrącanie białek (tzw. wysalanie). Jest to spowodowane odciąganiem cząsteczek wody. sol watującej molekuły białka, przez wprowadzone do roztworu jony soli. których hydratacja jest bardziej uprzywilejowana. Zniszczenie otoczki solwatacyjnej powoduje pojawienie się oddziaływań elektrostatycznych pomiędzy cząsteczkami białka i ich aglomerację a w następstwie wypadanie z roztworu. Fakt. iż różne białka wytrącają się z roztworu przy różnym stężeniu czynnika wysalającego. stosowany jest do frakcjonowania mieszanin białek. Procesy wysalanie i wytrącania rozpuszczalnikami organicznymi nie mają większego wpływu na przestrzenną strukturę białka.
Denaturacją nazywamy takie proces}', przeprowadzone drogami fizycznymi lub chemicznymi, które prowadzą do zmiany w strukturze białka, co prowadzi do utraty bądź zmniejszenia aktywności lub innej cechy charakteiystycznej tego białka, przy czym struktura pierwszorzędowa pozostaje niezmieniona. Procesy denaturacji wiążą się ze zniszczeniem wiązań wodorowych, stabilizujących drugo- trzecio- i czwartorzędową stnikturę proteiny, oraz. w warunkach redukujących, rozerwaniem mostków (wiązań) disiarczkowych. W przypadku denaturacji łańcuch białkowy traci swoją, stabilizowaną nieko walencyjny mi oddziaływaniami oraz wiązaniami disulfidowymi, konformację i przechodzi, na skutek drgań termicznych, w strukturę nieuporządkowaną, o charakterze statystycznym (tzw. kłębek statystyczny). Forma taka nie wykazuje
Wyszukiwarka
Podobne podstrony:
b-laktamowy zawierający wiązanie peptydowe, nieodwracalnie hamuje transpeptydazę glikopeptydową -
1.4 Peptydy, białka Peptydy są amidami utworzonymi w wyniku reakcji tworzenia wiązań peptydowych pom
15734 skanowanie0005 (172) Reakcje aminokwasów modyfikujące białka Wiązanie peptydowe jest sztywne i
aa mogą brać udział w reakcjach... hydroliza wiązań peptydowych i estrowych ustawienie gmp kwasowych
distamycyny (3 podjednostki). Oba związki zawierały grupę metoksylową w pozycji orto do wiązań
Obie opracowane przez mnie metody umożliwiają syntezę związków zawierających kilka wiązań amidowych
DSC01205 Id4/n rbid techniczny powstaje w wyniku reakcji CaO(S) + 3 C(>) -* CaC2 w + CO(g) :ymany
Wiązanie peptydowe i jego cechy. Tworzenie wiązania peptydowego jest najistotniejszą reakcją aminokw
metalurgia012 22 ra topienia, lepkość itp. W wyniku &ld^p
Obraz (2452) 126 6J. Reakcje wiązań podwójnych i potrójnych z wodorem Do najczęściej wykonywanych re
54275 Obraz (2452) 126 6J. Reakcje wiązań podwójnych i potrójnych z wodorem Do najczęściej wykonywan
Obraz (1023) 18. NIENASYCONE ZWIĄZKI KARBON YLOWE Cząsteczki zawierające wiązania OC i C=0 rozdzielo
DSCF1015 Prawie wszystkie pierwiastki metaliczne tworzą związki metaloorganiczn zawierające wiązania
więcej podobnych podstron