5399619974
w którym cyfra przed symbolem literowym wskazuje numer powłoki, odpowiednia litera określa symbol podpowłoki, a indeks u góry po prawej stronie symbolu podpowłoki wyraża liczbę elektronów należącą do danej podpowłoki, np. 3s2,4p6.
Konfigurację podpowłokową dla atomu wapnia 2oCa można zapisać na trzy sposoby:
2oCa: 1 s22s22p63s23p64s2 (elektronowa konfiguracja podpowłokową pełna) 2oCa: bVMV (elektronowa konfiguracja podpowłokową skrócona) 2oCa: [Ar] 4.v2 (walencyjna konfiguracja podpowłokową)
Elektrony zapełniają podpowłoki zgodnie z zasadą wzrastającej energii. W jednoelektrono-wym atomie wodoru, w którym nie występuje odpychanie pomiędzy elektronami, wszystkie orbitale danej powłoki mają identyczną energię: ns = np = nd = nf. W atomach wieloelektro-nowych jądro silniej przyciąga elektrony, czego efektem jest obniżenie energii zajmowanego przez nie orbitalu. Z drugiej strony wzajemne odpychanie elektronów powoduje wzrost energii tego orbitalu, a tym samym osłabienie siły przyciągającej elektrony przez jądro. To sprawia, że elektrony s mają niższą energię niż elektrony p tej samej powłoki. Efektem zjawiska zwanego ekranowaniem elektronów jest zatem zróżnicowanie energii orbitali (ns < np < nd < nf) znajdujących się w znacznej odległości od jądra. Wpływa to na kolejność obsadzania orbitali, ponieważ musi zostać zachowana zasada zapełniania zgodnie ze wzrastającą energią. W celu odtworzenia kolejności zapełniania podpowłok (zasada rozbudowy powłok można skorzystać ze schematu, zwanego potocznie „choinką”).
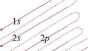
Ze schematu wynika, że energia orbitalu 4s jest niższa niż energia orbitalu 3d, zatem będzie on zapełniany w pierwszej kolejności, po zapełnieniu elektronami orbitalu 3p.
Obsadzanie podpowłok przez kolejne elektrony musi być również zgodne z tzw. regułą Hunda, według której najkorzystniejsze energetycznie jest takie zapełnianie orbitali, przy którym liczba elektronów o niesparowanych spinach w obrębie danej podpowłoki jest największa.
Liczba poziomów orbitalnych jest równa połowie maksymalnej liczby elektronów w danej podpowłoce (/) i wynosi: (2/+1). Rozmieszczenie elektronów na poziomach orbitalnych przedstawia się za pomocą tzw. zapisu klatkowego, w którym konfigurację orbitalną rysuje
6
Wyszukiwarka
Podobne podstrony:
36 (33) elementy i pokoloruj okienko, w którym cyfra wskazuje ich ilość. Skreśl największego bałwank
Przed rozpoczęciem pracy. Sprawdź numer modelu umieszczony na pokrywie skanera. Poniższe instrukcje
„Bank Name und Anschrift" - to nazwa Twojego banku i kraju w którym jest Twoje konto „IBAN"
01 pomiartemperaturyprzedwszystkim Pomiar temperatury w pomieszczeniu przed rozpoczęciem ćwiczenia T
DSC00914 If wyżej wymienionych zależnościach pierwsza cyfra indeksu określa numer gałęzi, druga zaś
Inwestuj we wlasny dlug ZŁOTE_ DŁUG Sławomir SniegockiInwestujwe własny 7 kroków, dzięki którym spła
Drugim miastem po Moguncji, w którym jeszcze przed 1460 rokiem zaczęły działać prasy drukarskie, był
8 djvu Wbudowany odtwarzacz płyt kompaktowychOdtwarzanie płyt CD ©Wskaźnik numeru ścieżki Wskazuje n
WA308?7 II5947 NAUKA O LUDACH�381 I 36ć znaszają tedy dzień w którym dziewczyna przed wschodem słońc
Obraz (40) 114 zmierza najczęściej do ustanowienia obrazu metaforycznego, w którym kawałki materiału
Inwestuj DŁUG Sławomir Śniegockiwe własny 7 kroków, dzięki którym spłaciszkredyt przed
Zadanie 7. Zadanie A. N„ Którym rysunku prrsdstewlono symbol orallwny diody Sohottky .Oo? Si kai rys
więcej podobnych podstron