
3.1 Praca
3.2 Termodynamika mikroskopowa i makroskopowa
3.3 Własności termodynamiczne
3.4 Fundamentalne prawa termodynamiki
3.5 Kontinuum oraz ciśnienie
3.6 Gaz idealny
3.7 Termometr gazowy
3.8 Kinetyczna teoria gazu doskonałego
Wyklad 3
2
3.1 Praca
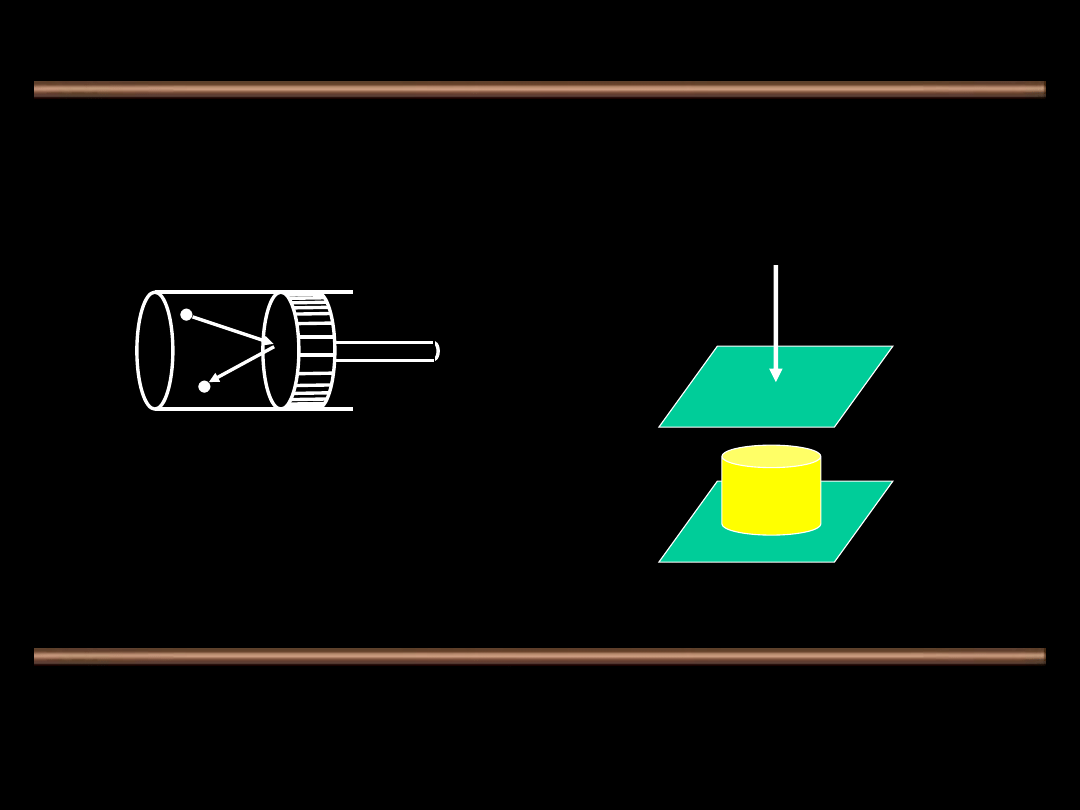
Praca zdefiniowana jest jako ilość energii dostarczanej przez
siłę działającą na pewnej drodze i matematycznie jest zapisana
jako:
c
s
d
F
W
(3.1)
F
ds
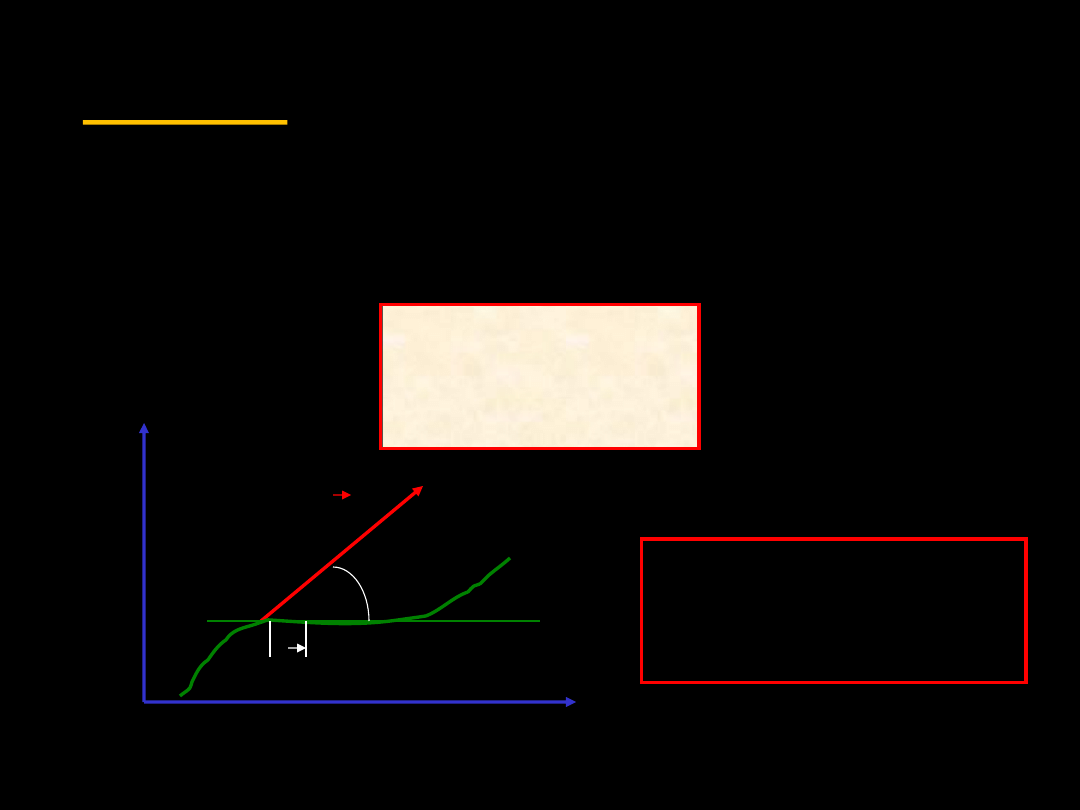
c
Całka liniowa definiuje
pracę wykonaną w
kierunku działania siły

3
3.2 Termodynamika mikroskopowa i makroskopowa
Rozważanymi do tej pory układami termodynamicznymi
były były obiekty makroskopowe ( gaz w butli, blok lodu
i.t.p.). W rozważaniu ich własności zaniedbuje się strukturę
molekularną i atomową tych ciał. Ciała takie opisuje
termodynamika klasyczna.
Jeśli wgłębimy się w strukturę cząsteczkową i atomową tych
ciał mówimy o termodynamice mikroskopowej. Termodynamika
ta dostarcza dodatkowych narzędzi i metod rozszerzających
termodynamikę klasyczną.
4
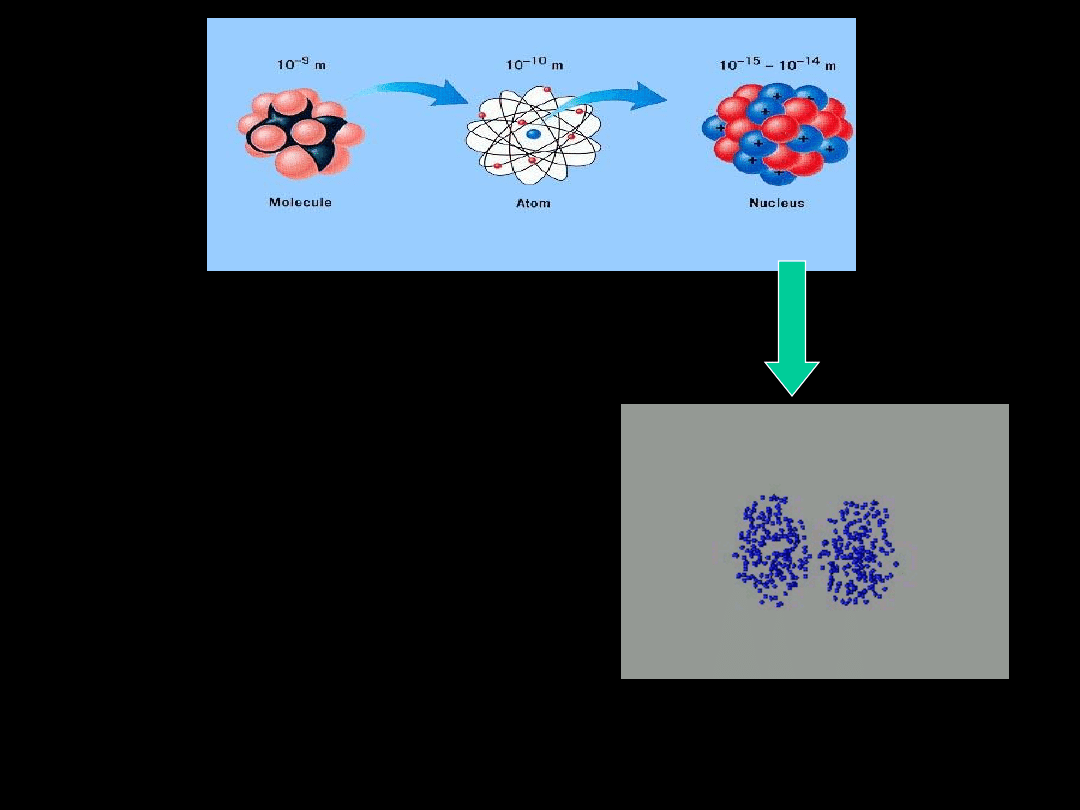
Termodynamika mikroskopowa
do analizy zdarzeń może
posługiwać się mechaniką
klasyczną. Mówimy wtedy o teorii
kinetycznej. Prawa mechaniki w
analizie tej przyjmujemy jako
aksjomaty..
Przechodząc do wymiarów
atomowych prawa mechaniki
musimy uzupełnić o mechanikę
kwantową.

5
Dla zderzenia uran-uran cząstki biorące udział w reakcji jeszcze
możemy policzyć. Zwykle w analizie mikroskopowej liczba
cząstek, która musimy uwzględnić przekracza 10
20
cm
-3
. Nie da się
niestety uwzględnić indywidualnie każdą cząsteczkę. Musimy więc
stosować metody statystyczne.
Jeśli więc sprzężemy metody fizyki statystycznej z ograniczeniami
wynikającymi z mechaniki kwantowej, będziemy mieli do czynienia
z termodynamiką statystyczna.
Termodynamika mikroskopowa zajmuje się dwoma sprawami:
1. Wyliczeniem rozkładu energii na poziomie molekuł i atomów,
aby móc z tego uzyskać makroskopowe własności energetyczne.
2. Pokazanie w jaki sposób znajomość rozkładu energii na
poziomie mikroskopowym można zastosować do opisu zjawisk
transportu (energii, pędu, masy).

6
Zobaczmy na przykładzie podstawową
różnicę pomiędzy opisem
makroskopowym a mikroskopowym.
W litrze gazu w normalnych warunkach znajduje się ok. 2x10
23
cząstek poruszających się w sposób przypadkowy we wszystkich
kierunkach, uderzających m.in. w siebie i w ścianki naczynia.
Jeśli przyjmiemy, że cząstki te zderzają się jak elastyczne kulki,
możemy do opisu ich ruchu zastosować mechanikę klasyczną.
Powinniśmy więc dla każdej i-tej kulki napisać równanie ruchu w
oparciu o II zasadę mechaniki Newtona.
)
1
(
i
i
N
j
ij
v
m
dt
d
F
Rozwiązanie tego układu równań dla wszystkich cząstek jest
oczywiście niemożliwe. Zamiast tego musimy opierać się na
metodach statystycznych opisujących zachowanie molekuł.

7
Z konieczności musimy opisać własności mikroskopowe
materii metodami matematyki statystycznej i przyjąć to co
przewiduje ona, że powinno się zdarzyć dla dużej liczby
cząstek.
Czy takie podejście jest do zaakceptowania musimy jednak
sprawdzić metodami doświadczalnymi.
8
3.3 Własności termodynamiczne
Własności termodynamiczne układu mogą zostać opisane
przez dowolną obserwablę charakterystyczną dla danego
układu. Własności termodynamiczne dzielimy na intensywne i
ekstensywne.
Intensywne własności
to takie, które nie zależą od masy(ilości
materii) zawartej wewnątrz granic układu.
Ekstensywne własności
to takie, które są proporcjonalne do
ilości materii w układzie.
Przykładowo – objętość jest własnością ekstensywną, a objętość
właściwa – intensywną.
Ogólnie biorąc parametry ekstensywne dzielone przez masę
stają się intensywne.

9
Układ termodynamiczny
może również składać się z więcej niż
z jednej fazy.
Mieszanina pary wodnej, kropel wody i kryształków lodu jest
mieszaniną trzyfazową.
Układ termodynamiczny może również zawierać więcej niż
jeden składnik.
Mieszanina powietrza, wody i lodu zawiera dwa składniki i trzy
fazy.
Jeśli fazy są rozłożone jednorodnie układ jest homogeniczny,
jeśli są rożłożone niejednorodnie układ jest heterogeniczny.
Własności termodynamiczne zależą od liczby faz i
składników,oraz od tego, czy układ jest homogeniczny czy
nie.

10
3.4 Fundamentalne prawa termodynamiki
a).
Pierwsza zasada termodynamiki
mówi:
Energia układu izolowanego jest stała. Oznacza to również, ze
energii nie można ani stworzyć ani zniszczyć.
Układ izolowany jest to taki, który nie wymienia energii z
otoczeniem
b).
Druga zasada termodynamiki
przyjmuje jako aksjomaty szereg
obserwacji eksperymentalnych, z których kilka wyraża się
następująco:
1. Ciepło przepływa od temperatury wyższej do
temperatury niższej, a nie odwrotnie.
Czyli ciało ciepłe ochłodzi się w kontakcie z chłodnym
ciałem a nie odwrotnie..

11
2. Dwa gazy umieszczone w izolowanym naczyniu wymieszają
się jednorodnie w całym naczyniu i nie będą w stanie
spontanicznie się rozdzielić.
3. Bateria rozładuje się przez opornik wydzielając pewną ilość
ciepła, przy czym proces odwrotny jest niemożliwy.
4. Nie jest możliwe skonstruowanie maszyny pracującej w
sposób ciągły przez pobór ciepła z pojedynczego zbiornika
i wykonującej równoważną ilość pracy
.
II zasada termodynamiki określa więc kierunek przemiany
i transferu ciepła. Procesy te są nieodwracalne.
c).
Trzecia zasada termodynamiki
odnosi się do własności
substancji w pobliżu zera absolutnego i poznamy ją po
analitycznym sformułowaniu I i II zasady.
12
3.5 Kontinuum oraz ciśnienie
Gęstość określonej masy gazu jest zdefiniowana zgodnie ze
znaną definicją;
V
m
(3.2)
Ta definicja zakłada, że objętość jest wystarczająco duża ażeby
liczba cząstek w niej zawarta nie podlegała znaczącym
fluktuacjom w czasie. Jeśli tak jest to układ może być traktowany
jako kontinuum.
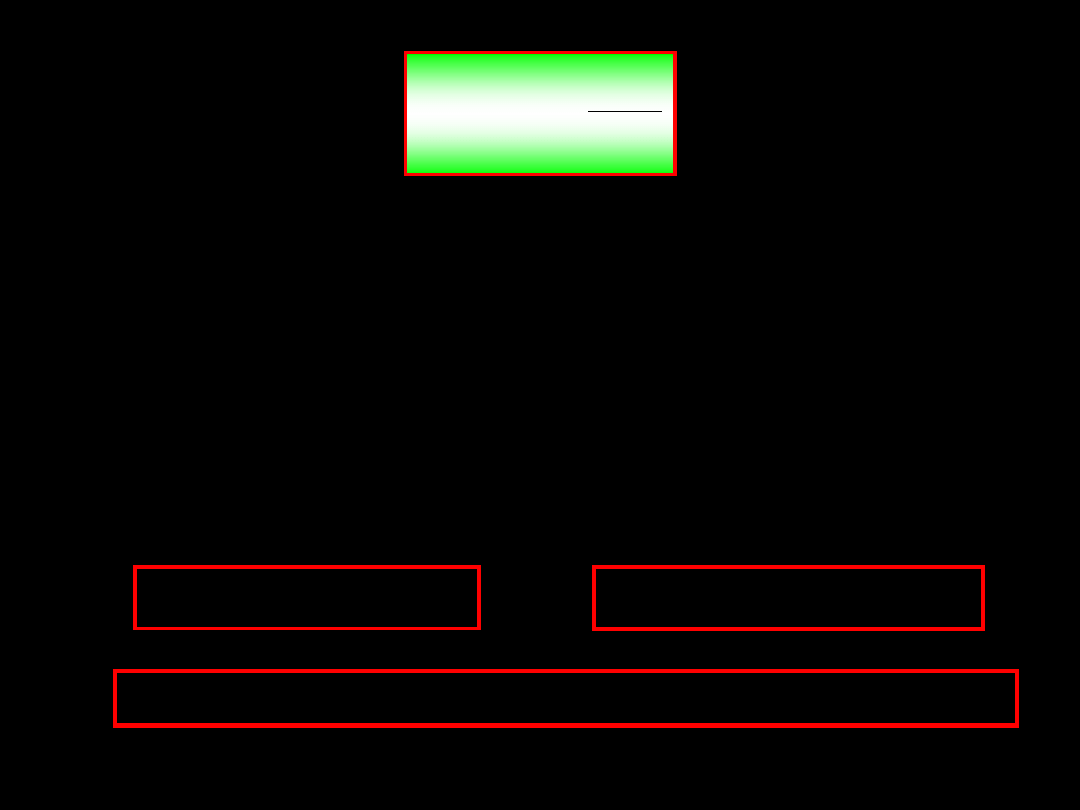
Ciśnienie
jest zdefiniowane jako stosunek składowej normalnej siły
wywieranej przez substancję na ścianki układu, do wielkości
powierzchni. Ciśnienie jest zdefiniowane dla takiej objętości
układu, aby można ją było uważać jako kontinuum.
13
CIŚNIENIE
=„siła działająca na powierzchnię
zderzenie
A
F
p
F
A
ciężar
14
A
F
p
n
A
A
lim
'
(3.3)
A
’
jest najmniejszą powierzchnią dla której ciecz zachowuje się
jako kontinuum.
Całkowite ciśnienie wywierane na ścianki naczynia nazywamy
ciśnieniem absolutnym.
Ciśnienie wywierane przez atmosferę nazywamy ciśnieniem
atmosferycznym.
Jednostką ciśnienia w układzie SI jest Pascal.
1 atm = 101.325 kPa
1 atm jest to ciśnienie słupa rtęci o wysokości 760 mm .
1 Pa = 1N/m
2
15
3.6 Gaz idealny
Jeśli przez M oznaczymy ciężar molekularny a przez
n
liczbę
moli, to masa substancji jest równa:
nM
m
0
N
M
n
m
cz
cz
M
M
N
0
(3.4)
(3.5)
(3.6)
N
0
jest liczbą Avogadro i
jest równa:
N
0
= 6.022045 10
23
cz/g.mol
Objętość będziemy oznaczali
przez V, a objętość molową
przez V
m
, a przez v objętość
właściwą. M
cz
oznacza masę
cząsteczki
16
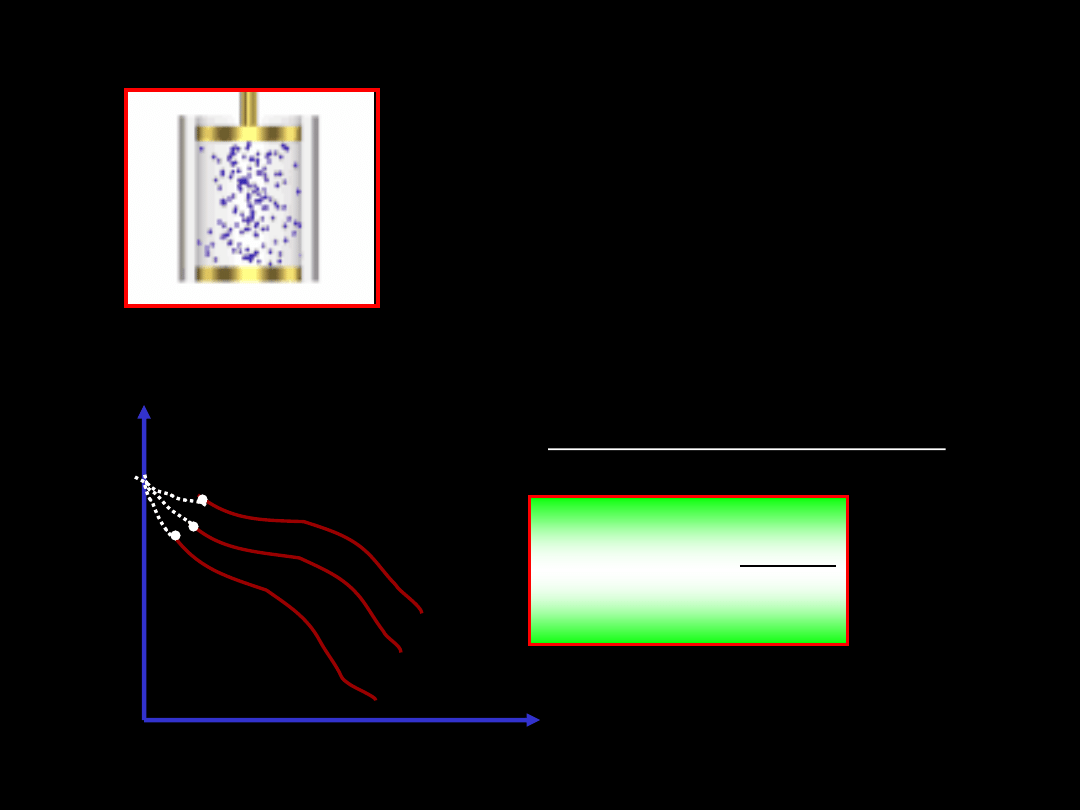
Załóżmy, że wykonujmy szereg eksperymentów z różnymi gazami.
Dla 1 mola różnych gazów mierzymy
ciśnienie, temperaturę i objętość dla
różnych ciśnień i temperatur. Okazuje
się, że niezależnie od gazu mierzone
zależności przy stałych temperaturach
spotykają się w jednym punkcie przy ciśnieniu dążącym do zera.
T
1
T
2
T
3
p
pV
m
/T
Wartość ta jest równa uniwersalnej stałej gazowej
.
T
pV
m
p
lim
0
(3.7)
17
Stała gazowa
jest równa:
= 8314.41 kJ/(mol • K)
Z dobrym przybliżeniem wiele gazów spełnia proste prawo
T
pV
m
(3.8)
w szerokim zakresie ciśnień i temperatury.
Równanie (2.8) jest to równanie stanu gazu doskonałego. określa
ono zależności pomiędzy własnościami termodynamicznymi
koniecznymi do zdefiniowania stanu układu
.
Ponieważ V
m
= V/n, mamy
T
n
pV
(3.9)
18
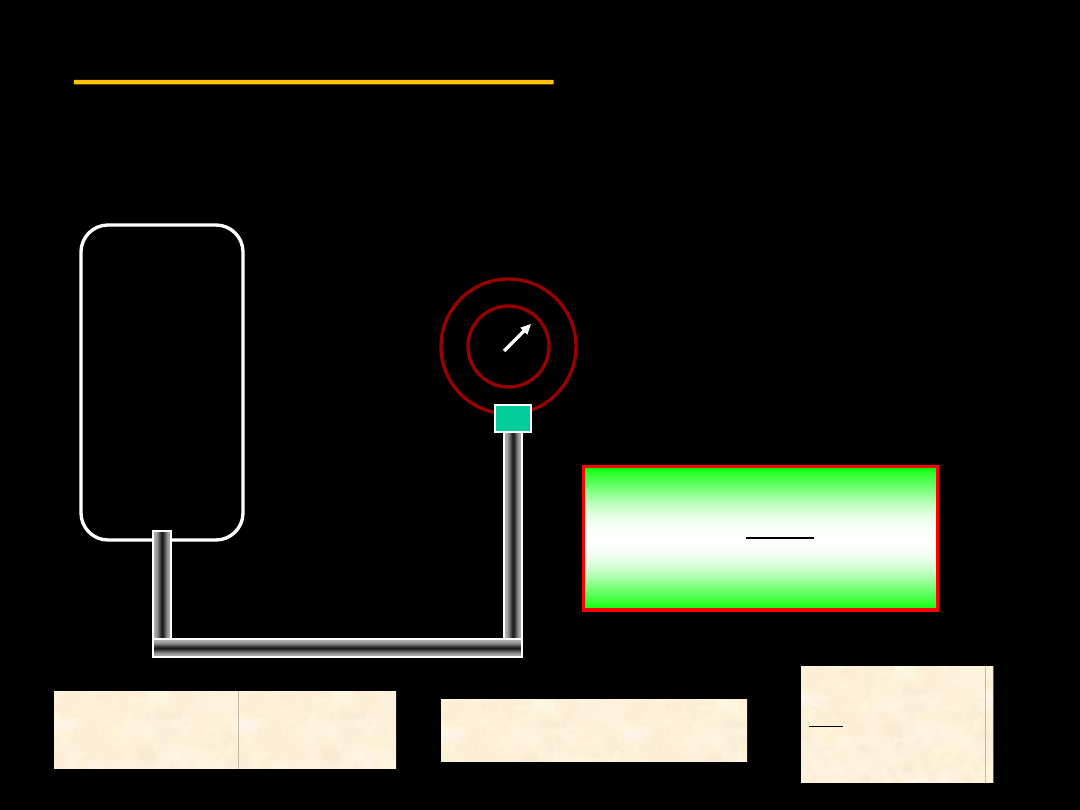
3.7 Termometr gazowy
objętość
V
ciśnienie
nieznana
T
Zbiornik umieszczamy w
miejscu, w którym mierzymy
temperaturę. Odczytujemy
ciśnienie. Następnie
umieszczamy zbiornik w
temperaturze wzorcowej i
odczytujemy ciśnienie p
wz
.
const
V
wz
wz
p
p
T
T
(3.10)
T
R
n
V
p
const
V
for
const
T
p
19
x
y
z
v
x
v
y
v
z
dA
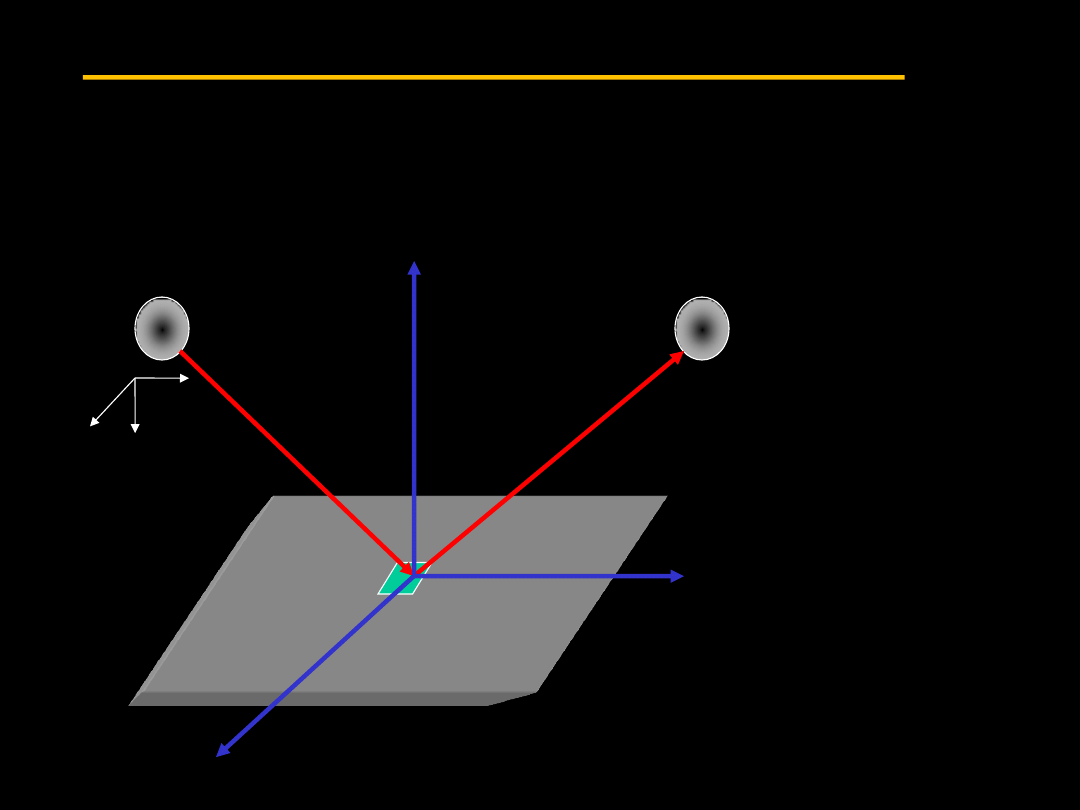
3.8 Kinetyczna teoria gazu doskonałego
Aby pokazać proste zależności pomiędzy termodynamiką
mikroskopową a makroskopową rozważmy prostą kinetyczną
analizę cząsteczek
gazu. Ciśnienie
jest zdefiniowane
jako siła
wywierana na
ściankę przez
uderzające w nią
cząsteczki.
Pęd przekazany
ściance przez
każdą cząstkę jest
równy.
20
z
cz
z
cz
z
cz
v
M
v
M
v
M
dt
F
2
)
(
(3.11)
Liczba molekuł uderzająca powierzchnię dA dana jest przez
strumień molekuł w kierunku z
s
molekuł
v
dA
n
n
z
/
(3.12)
·
n
jest gęstością molekularną, czyli liczbą molekuł na jednostkę
objętości.
Jeśli założymy przypadkowy ruch molekuł, to tylko połowa
molekuł poruszać się będzie w kierunku –z .
z
z
v
dA
n
n
2
1
(3.13)
·
21
Z zależności pomiędzy popędem siły a zmianą pędu znajdujemy,
że całkowity pęd przekazany powierzchni dA w czasie dt jest
równy iloczynowi
dt
dA
v
n
v
M
dt
F
z
z
cz
)
2
1
(
)
2
(
czyli
2
z
cz
v
n
M
p
dA
F
(3.14)
Wiemy, że
2
2
2
2
z
y
x
v
v
v
v
a z przypadkowości ruchu
wynika, że
2
2
2
2
3
1 v
v
v
v
z
y
x
Otrzymujemy więc
2
3
/
1
v
M
n
p
cz
(3.15)
22
We wzorze (3.15) iloczyn
V
m
M
n
cz
czyli masę na substancji
na jednostkę objętości.
Po wstawieniu tego do równania (3.15) otrzymujemy wyrażenie;
2
3
1
v
m
pV
(3.16)
Porównując to równanie z równaniem (3.9) (równanie gazu
doskonałego) otrzymujemy:
2
3
1 v
T
R
(3.17)
Temperatura jest miarą średniej energii
kinetycznej gazu.
m jest całkowitą masą substancji, a R =
/M
cz
, jest stałą
gazową konkretnego gazu.
Wyszukiwarka
Podobne podstrony:
AGH Wyklad 4 id 52883 Nieznany (2)
AGH Wyklad 6 id 52884 Nieznany
AGH Wyklad 8 id 52885 Nieznany (2)
AGH Wyklad 9 id 52886 Nieznany (2)
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
ZP wyklad1 id 592604 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
or wyklad 1 id 339025 Nieznany
II Wyklad id 210139 Nieznany
cwiczenia wyklad 1 id 124781 Nieznany
BP SSEP wyklad6 id 92513 Nieznany (2)
MiBM semestr 3 wyklad 2 id 2985 Nieznany
algebra 2006 wyklad id 57189 Nieznany (2)
olczyk wyklad 9 id 335029 Nieznany
Kinezyterapia Wyklad 2 id 23528 Nieznany
więcej podobnych podstron