
1
Wykład 6
6.1 Efekt Joule’a Thomsona
6.2 Podstawy termodynamiki statystycznej
6.3 Przestrzeń fazowa
6.4 Rozważania kwantowe
6.5 Zjawisko degeneracji stanów energetycznych
6.6 Mikro- i makrostany oraz prawdopodobieństwo
termodynamiczne
6.7 Modele fizyczne
6.8 Aproksymacja Stirlinga
6.9 Statystyka Bosego-Einsteina
6.10 Statystyka Fermiego-Diraca
6.11 Statystyka Maxwell’a-Boltzmann’a
6.12 Przybliżenie klasyczne modelu Maxwell’a-Bolzmann’a
6.13 Rozkład prawdopodobieństwa dla stanu równowagi

2
6.1 Efekt Joule’a Thomsona
Rozpatrzmy następujący proces rozprężania się gazu.
Rozprężanie gazu następuje w warunkach izolacji termicznej,
(dQ=0) od stanu początkowego p
i
,V
i
,T
i,
, do stanu końcowego
p
f
, V
f
, T
f
. Przyjmuje się, że p
f
< p
i
.
Izolacja termiczna
Porowata przegroda
p
i
V
i
, T
i
V
f
,
T
f
p
f
i
f
I. Stan początkowy
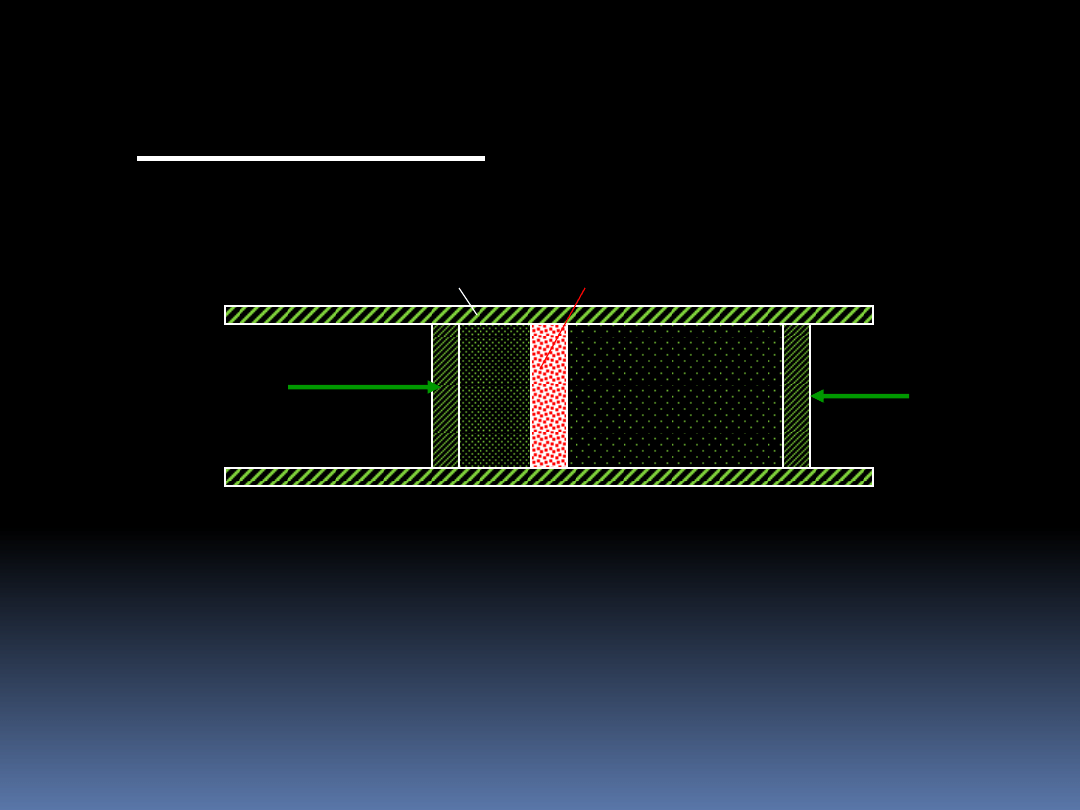
3
Izolacja termiczna
Porowata przegroda
p
i
V
i
, T
i
V
f
,
T
f
p
f
i
f
Przegroda zapewnia, że praca wykonana na molekułach gazu nie
nadaje im zbyt dużego przyśpieszenia.
II. Stan końcowy

4
Konieczne przemieszczenie środka ciężkości gazu odbywa
się praktycznie bez nadania cząstkom przyśpieszenia.
Zakładamy również, że pomiędzy stanem początkowym a
końcowym nie ma różnicy energii potencjalnej.
Dla takich warunków, zakładając stały strumień
przepływu równanie (5.8) sprowadza się do prostej postaci:
f
i
h
h
Chociaż entalpie w miejscu przekrojów i i f są dla odpowiednich
warunków takie same, mogą one znacznie różnić się podczas
przepływu przez porowatą przegrodę. Będzie to zależało od
wielkości otworów w przegrodzie i tarcia.
Jeśli dla gazu rzeczywistego wykreślilibyśmy zależność
temperatury od ciśnienia, to otrzymamy następujący wykres.
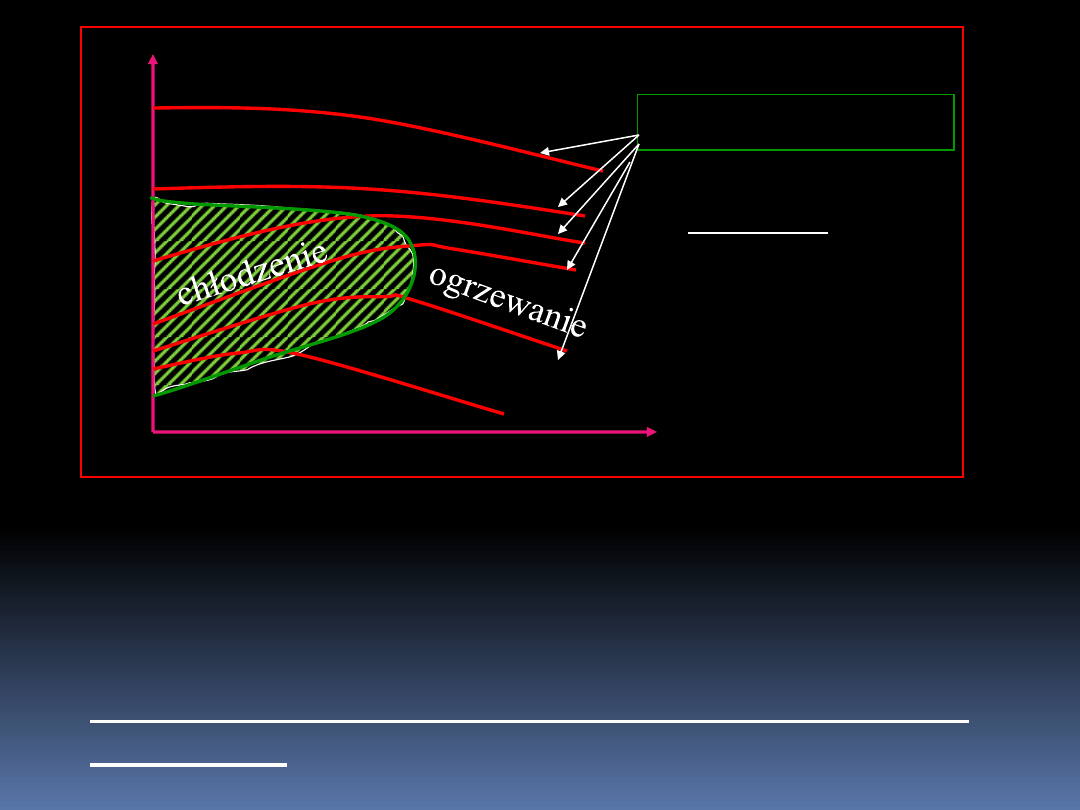
5
T
p
h = U + pV =const
izentalpie
Obwiednia maksimów krzywych izentalpowych daje nam
pewien obszar otoczony krzywą inwersji.
Nachylenie izentalpy definiuje nam współczynnik Joule’a
– Thomsona.

6
h
J
p
T
(6.1)
Dla gazu idealnego linie stałej entalpii byłyby równocześnie
izotermami. Czyli dla gazu idealnego
J
=0.
Ważność zjawiska Joule’a – Thomsona polega na tym, że
współczynnik
J
możemy zmierzyć doświadczalnie, a następnie
wyliczyć interesujące nas wielkości termodynamiczne.
Jeśli założymy, że entalpia może być funkcją ciśnienie i
temperatury, to możemy napisać:
dT
T
h
dp
p
h
dh
p
T
(6.2)
7
Wprowadzając definicję ciepła właściwego przy stałym
ciśnieniu mamy:
dT
c
dp
p
h
dh
p
T
(6.3)
Dla adiabatycznego procesu Joule’a – Thomsona, dh=0,
czyli:
p
h
T
c
T
p
p
h
0
lub
T
J
p
p
h
c
1
(6.4)

8
T
T
p
h
(6.5)
który możemy mierzyć w efekcie Joule’a – Thomsona
dla stałych temperatur przy stałych ciśnieniach.
Otrzymujemy więc, że:
J
T
p
c
(6.6)
Znajomość ciepła właściwego ma zasadnicze znaczenie przy
wyliczaniu różnego rodzaju własności termodynamicznych.
9
6.2 Podstawy termodynamiki statystycznej
Do tej pory zajmowaliśmy się termodynamiką makroskopową,
oraz zasadą zachowania energii. Wspomnieliśmy tylko o
termodynamice mikroskopowej. Obecnie zajmiemy się
sformułowaniem praw matematycznych i fizycznych modeli
dla termodynamiki mikroskopowej, które przydadzą się do
naszych rozważań.
Modele te powinny dotyczyć zjawisk, które możemy
obserwować makroskopowo.
6.2.1 Prawdopodobieństwo
Prawdopodobieństwo zajścia jednego z dwu wykluczających
się zdarzeń równa jest sumie ich prawdopodobieństw:
l
k
P
P
l
k
P
)
(

10
Prawdopodobieństwo łącznego zajścia dwóch zdarzeń
niezależnych równa jest iloczynowi ich prawdopodobieństw.
l
k
P
P
l
k
P
)
(
Jeśli mamy szereg niezależnych zdarzeń w tym samym czasie ,
takich, że każde zdarzenie ma prawdopodobieństwo P
i
, to
prawdopodobieństwo, że wszystkie zdarzenia zajdą
równocześnie jest dane przez iloczyn prawdopodobieństw
indywidualnych.
i
i
P
P
(6.7)
Jeśli mamy N nierozróżnialnych obiektów i chcemy policzyć
liczbę i możliwych ustawień po kolei, to dla pierwszego
obiektu mam N możliwości, dla drugiego obiektu jedno
miejsce jest już zajęte, wobec tego istnieje N-1 możliwości,
dla trzeciego będzie N-2 możliwości.

11
Całkowita liczba możliwych sekwencji wynosi więc:
!
1
2
)
2
(
)
1
(
N
N
N
N
N
Ze względu na nierozróżnialność cząstek, wszystkie
sekwencje będą jednakowe.
W późniejszych rozważaniach będziemy chcieli określić
liczbę możliwych sposobów, na które mikroskopowe
cząsteczki mogą zająć określone stany energetyczne, kiedy
równocześnie istnieją pewne ograniczenia jak np.. wymóg
zachowania energii i masy.
Jeśli będziemy mogli określić liczbę cząstek zajmujących
dany stan, to będziemy mogli policzyć całkowitą energię
wszystkich cząstek przeprowadzając sumowanie:
i
i i
n
E
Gdzie n
i
oznacza liczbę cząstek okupujących stan o energii
i
.

12
6.3 Przestrzeń fazowa
Na początku wykładu wspominaliśmy o analogii pomiędzy
współrzędnymi termodynamicznymi a współrzędnymi
opisującymi ruch ciał w mechanice. Wspominaliśmy również,
że własności makroskopowe są zależne od wielkości
mikroskopowych.
Jeśli bylibyśmy w stanie opisać dokładnie co dzieje się na
poziomie mikroskopowym, moglibyśmy bez problemów
wyliczać wielkości makroskopowe.
Przestrzeń fazowa jest przestrzenią sześciowymiarową na
którą składają się trzy współrzędne kartezjańskie i trzy
składowe pędu.
z
z
y
y
x
x
v
m
p
v
m
p
v
m
p

13
6.4 Rozważania kwantowe
Wiadomo, że na poziomie mikroskopowym mechanika
klasyczna musi być uzupełniona przez teorię kwantową.
Podstawowym założeniem teorii kwantowej jest fakt, że
energia jest wielkością skwantowaną, oraz że materia ma
naturę zarówno falową jak i cząstkową ,
h
E
(6.7)
gdzie
jest częstością, a h stałą Plancka (h=6.625·10
-34
J·s)

14
Transfer energii na poziomie mikroskopowym polega na
przejściu z jednego stanu kwantowego na inny stan kwantowy.
Kwant energii może być emitowany lub absorbowany.
Wiemy również, że
c
(6.8)
Szczególna teoria względności daje nam relację pomiędzy
masą a energią,
2
c
m
E
(6.9)
Masa fotonu jest więc równa,
2
2
c
h
c
E
m
(6.10)

15
Pęd fotonu jest z kolei dany przez:
h
c
h
c
m
p
(6.11)
Na poziomie mikroskopowym istnieje pewne ograniczenie
dotyczące dokładności z jaką możemy dokonać pomiarów.
Dane ono jest przez relację nieoznaczoności Heisenberga.
h
x
p
x
(6.12)
Z relacji nieoznaczoności wynika, że najlepsze co
możemy zrobić, to umieścić cząstki w elemencie
przestrzeni fazowej o wymiarach h
3
.
Sprowadza się to do tego, że jeśli mamy pudełka o takich
rozmiarach, to możemy dokładnie określić ile cząstek jest
w każdym z nich, ale nie ich dokładną pozycje.

16
Teoria kwantowa postuluje, że zarówno cząstki, jak i
promieniowanie elektromagnetyczne mają energie i pęd
skwantowany. Charakterystyczna długość fali jest dana
przez
p
h
(6.13)
Dotyczy to zarówno fali jak i cząstki materialnej o pędzie p.
Jeśli porównamy długość fali odpowiadającą poruszającej
się masie 1 kg z prędkością 1 m/s, oraz pojedynczego
elektronu o prędkości 10
6
m/s, to otrzymamy:
m
mv
h
m
mv
h
p
h
10
2
34
1
10
28
.
7
10
625
.
6

17
6.5 Zjawisko degeneracji stanów energetycznych
Oznaczmy dla określonego stanu kwantowego o energii Є
i
liczbę możliwych stanów mających energię Є
i
przez g
i
. Jeśli
możliwy jest więcej niż jeden stan o energii Є
i
to stan ten
jest zdegenerowany.
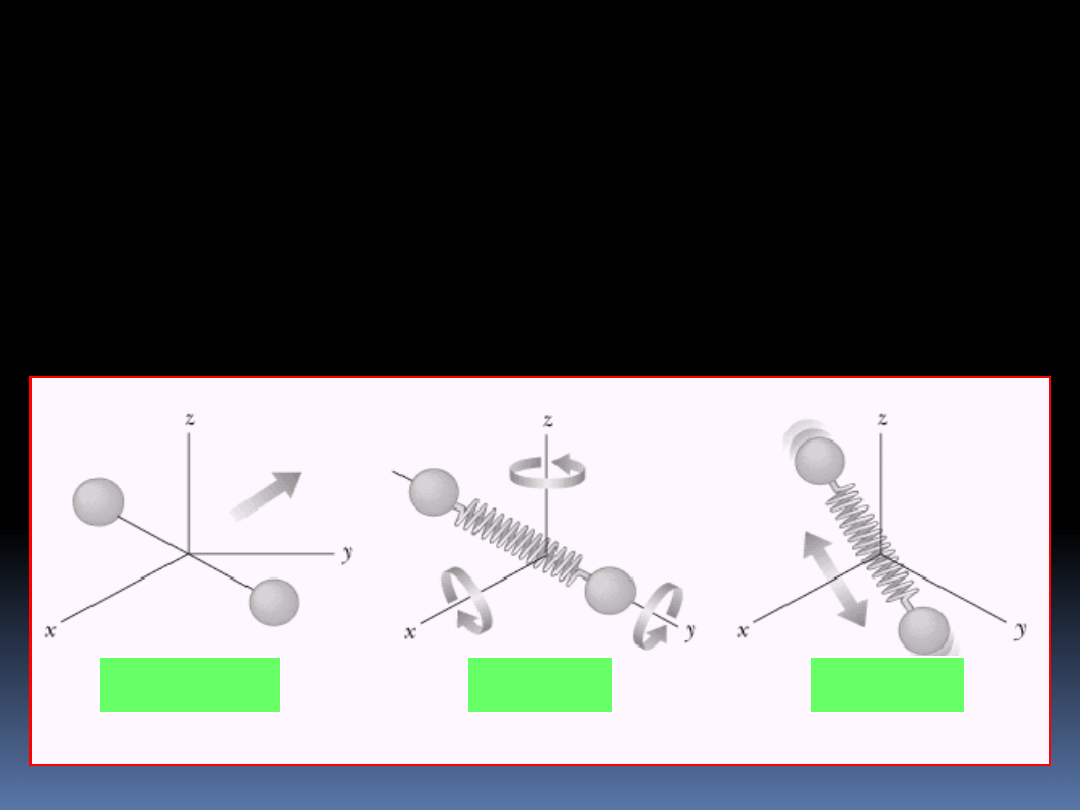
Jako przykład rozważmy pojedynczą cząstkę
charakteryzującą się trzema translacyjnymi stopniami
swobody. Przyjmując pewną jednostkę energii zobaczmy na
ile sposobów możemy utworzyć cztery stany energetyczne.
Uzyskany wynik przedstawiony jest na następnej stronie.
Stan nie zdegenerowany jest to stan dla którego g
i
= 1, co
oznacza, że każdy stan energetyczny może być zrealizowany
tylko na jeden sposób.

18
1 j.en - minimalny kwant energii
Є
i
=0
Є
i
=1j.en Є
i
=2j.en. Є
i
=3j.en
E
kx
E
ky
E
kz
E
kx
E
ky
E
kz
E
kx
E
ky
E
kz
E
kx
E
ky
E
kz
0 0 0 1 0 0 1 1 0 1 1 1
0 1 0 0 1 1 1 2 0
0 0 1 1 0 1 1 0 2
2 0 0 2 1 0
0 2 0
0 1 2
0 2 1
0 0 2 2 0 1
3 0 0
0 3 0
0 0 3
g
i
= 1 g
i
= 3 g
i
= 6 g
i
= 10
19
W tym miejscu należy zaznaczyć, że dla gazu idealnego w
temperaturze pokojowej liczba dostępnych stanów
energetycznych jest znacznie wyższa niż liczba cząsteczek,które
mają te stany obsadzać. Gaz taki jest silnie zdegenerowany,
gdyż istnieje wiele stanów o tej samej energii.
Translacja
Wibracja
Rotacja
Dla dwuatomowej cząsteczki poza energią translacyjna
istnieję jeszcze energia rotacyjna i wibracyjna.

20
6.6 Mikro- i makrostany oraz
prawdopodobieństwo termodynamiczne
Załóżmy, że mamy do czynienia z gazem monoatomowym,
który możemy przedstawić jako doskonałe kulki bilardowe.
Energię wewnętrzną gazu moglibyśmy obliczyć sumując
energię kinetyczną wszystkich molekuł. Ciśnienie moglibyśmy
określić w oparciu o pęd przekazywany ściankom zbiornika.
Aby określić mikrostan takiego układu, musielibyśmy podać
dokładne położenie i prędkość każdej cząsteczki w przestrzeni
pędowej. Takie dokładne określenie parametrów cząsteczek nie
jest potrzebne do obliczenia makroskopowo obserwowalnych
własności termodynamicznych, np.. aby policzyć energię
musimy tylko znać liczbę cząstek mających określoną energię.
Dokładnie mówiąc, musimy znać liczbę cząstek w każdym
sześciowymiarowym elemencie przestrzeni fazowej, przy czym
nie musimy wiedzieć, która cząsteczka jest w którym elemencie.

21
Jeśli liczba cząstek w każdym elemencie przestrzeni fazowej jest
określona, bez zwracania uwagi na to, która cząstka jest w
którym elemencie, mówimy, że został określony makrostan.
Przed dokonaniem analizy modeli fizycznych, konieczny jest
pewien wstęp matematyczny. Chodzi o określenie liczby
kombinacji i permutacji, które można osiągnąć wkładając bile
do pudełek. Później bile będą określały cząstki, a pudełka
poziomy energetyczne i stany kwantowe, które mogą być
zajmowane przez cząsteczki.
Będziemy chcieli określić makrostan, który jest najbardziej
prawdopodobny. Będzie to stan o największej możliwej liczbie
mikrostanów, czyli stan, który może występować na największą
możliwą liczbę sposobów.
Określimy tzw prawdopodobieństwo termodynamiczne
równe liczbie mikrostanów odpowiadających danemu
makrostanowi.

22
W rzeczywistości jest to liczba możliwych kombinacji czy
ustawień rozważanych cząstek.
Możemy to zaprezentować na przykładzie dwóch kostek do
gry, przy pomocy których chcemy w jednym rzucie uzyskać
siedem oczek. Te siedem oczek stanowi nasz makrostan.
Wiemy, że istnieje 6 kombinacji na wyrzucenie 7. Mówimy
wtedy, że
= 6. Na wyrzucenie 12 istnieje tylko 1
kombinacja, czyli
= 1.
Należy być świadomym faktu, że liczba możliwych ustawień
jest proporcjonalna do prawdopodobieństwa, czyli aby
studiować prawdopodobieństwo obserwacji określonego
ustawienia, można badać zachowanie
-gi.

23
I.
Liczba sposobów, na które N rozróżnialnych cząstek może
zostać ułożone w zbiorze dużych komórek, przy czy może
być N
1
cząstek w 1 komórce
N
2
cząstek w 2 komórce,
N
i
cząstek w i-tej komórce.
Ograniczeniem jest N
i
N.
Wewnątrz każdej i-tej komórki znajduje się g
i
mniejszych
rozróżnialnych komórek, w których te N
i
cząstek może
zostać ułożone.
Liczba g
i
może być g
i
> N
i
lub g
i
< N
i
.
Liczba małych komórek w dużych nie musi być taka sama.
Przypadek ten jest pokazany na następnej stronie.
II. Analogicznie jak I, tyle że cząsteczki są nierozróżnialne
.
Rozważmy trzy matematyczne przypadki, które będą
odpowiadały późniejszym modelom fizycznym.
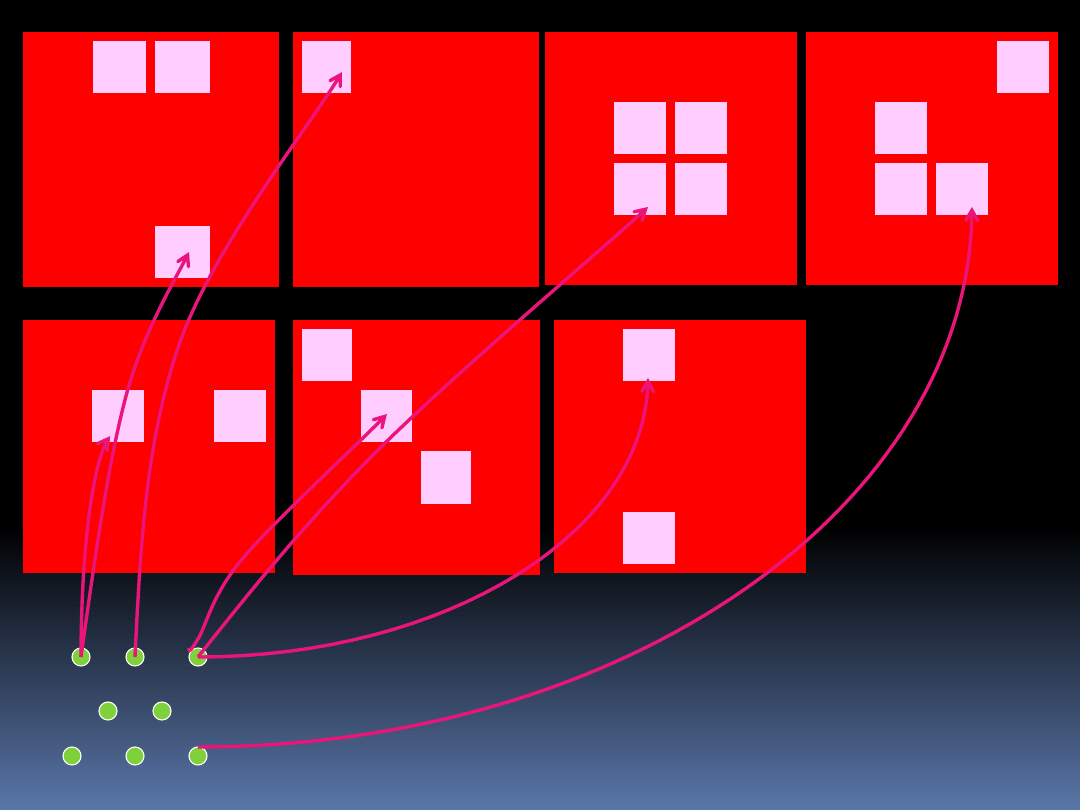
24

25
III. Analogicznie jak II, z warunkiem, że w każdej małej
komórce może być nie więcej niż jedna cząstka.
W modelach tych duże komórki odpowiadają stanom
energetycznym, a małe komórki odpowiadają liczbie stanów
kwantowych na każdym poziomie energetycznym lub
degenerację.
Przypadek I możemy policzyć następująco.
Liczba możliwych sposobów, na które N cząstek może zostać
ustawionych wynosi N!.
Liczba możliwych sposobów na ustawienia cząstek w dużej
komórce wynosi N
1
! w 1-szej komórce,
N
2
! w 2-giej komórce, itd..

26
Jeśli więc chcemy policzyć liczbę sposobów ustawienia N
cząstek w różnych dużych komórkach, musimy N! podzielić
przez liczbę możliwych ustawień w każdej komórce, czyli
!
!
!
!
2
1
N
N
N
N
lub
i
i
N
N
!
!
(6.14)
gdzie N
i
oznacza liczbę cząstek w i-tej dużej komórce.
Musimy również rozważyć liczbę możliwych sposobów na
które N
i
cząstek może może zostać rozmieszczonych w g
i
małych komórkach. Dla każdej cząstki mamy g
i
możliwości,
tak, że dla wszystkich cząstek w i-tej dużej komórce mamy
następującą liczbę możliwości:
27
i
N
i
i
i
i
g
g
g
g
(6.15)
Istnieje więc g
i
Ni
możliwych sposobów ułożenia N
i
cząstek w g
i
małych komórkach wewnątrz i-tej dużej komórki. Musimy więc
zmodyfikować równanie (5.9) aby to uwzględnić.
i
N
i
N
N
i
i
g
g
g
N
N
2
1
2
1
!
!
lub
i
i
N
i
N
g
N
i
!
!
(6.16)

28
Dla II przypadku
dotyczącego cząstek nierozróżnialnych
przytoczymy tylko wyrażenie na prawdopodobieństwo
termodynamiczne.
Dla określonej dużej komórki prawdopodobieństwo
termodynamiczne ma postać:
!
!
1
!
1
i
i
i
i
i
N
g
N
g
(6.17)
Całkowite prawdopodobieństwo termodynamiczne otrzymuje
się przez wzięcie iloczynu prawdopodobieństw dla
pojedynczych komórek.

29
i
i
i
i
i
i
i
N
g
N
g
!
!
1
!
1
(6.18)
Wykorzystując wzór na całkowite prawdopodobieństwo
zdarzeń niezależnych w przypadku gdy degeneracja g
i
>> 1,
mamy
i
i
i
i
i
N
g
N
g
!
!
!
(6.19)
III przypadek
zawiera ograniczenie mówiące, że w małej
komórce możemy umieścić tylko jedną cząstkę. Możemy to
zapisać jako N
i
≥ g
i
.
Jeśli zaczęlibyśmy rozmieszczać równocześnie N
i
cząstek w g
i
małych komórkach, to 1-sza cząstka miałaby g
i
możliwości, 2-
ga g
i
-1, 3-cia g
i
–2, tak, że możliwa liczba ustawień jeśli
wszystkie cząstki byłyby rozróżnialne, byłaby równa

30
)!
(
!
)]
1
(
[
)
2
)(
1
(
i
i
i
i
i
i
i
i
N
g
g
N
g
g
g
g
Ponieważ cząstki są nierozróżnialne, aby otrzymać możliwą
liczbę ustawień, wyrażenie to musimy podzielić przez N
i
!,
czyli
!
)
(
!
!
i
i
i
i
i
N
g
N
g
(6.20)
Możliwa liczba ustawień we wszystkich komórkach jest
więc równa
i
i
i
i
i
i
i
N
g
N
g
)!
(
!
!
(6.21)

31
6.7 Modele fizyczne
Sformułujemy teraz kilka modeli dla opisu mikroskopowego
zachowania się materii. Rozważać będziemy tylko cząstki
materialne, a nie np.. kwanty promieniowania
elektromagnetycznego, oraz przyjmijmy, że rozważane układy są
izolowane.
Dla wszystkich modeli robimy następujące podstawowe założenia;
1. Całkowita energia układu pozostaje stała,
2. Całkowita liczba cząstek układu pozostaje stała,
3. W rozważaniach uwzględniamy dużą liczbę cząstek, taką, że
ich zachowanie może być opisane przez analizę statystyczną,
4. Wszystkie mikrostany są równie prawdopodobne, tzn., że
cząstka może z równym prawdopodobieństwem zajmować
różne elementy przestrzeni fazowej.

32
Będziemy rozważali trzy modele.
1. Model Maxwella-Bolzmanna (MB)
Cząstki są rozróżnialne i mogą obsadzać różne kwantowe
stany energetyczne, które oznaczymy wskaźnikiem i. Na i-tym
poziomie energetycznym znajduje się wiec N
i
cząstek mających
energię Є
i
.Wartości energii Є
i
są skwantowane i istnieje wiele
sposobów uzyskiwania tej energii przez cząstki.
Np. Cząstki mające jedynie kinetyczną energię związaną z
translacją mogą ją mieć złożoną na różne sposoby ze
składowych energii translacyjnej.
Ponieważ tą samą energię różne cząstki mogą realizować na
różne sposoby, musimy dla ogólności założyć, że każda grupa
cząstek (na i-tym poziomie energetycznym) może zajmować g
i
stanów kwantowych, z których każdy ma energię Є
i
.

33
Nie ma ograniczeń na liczbę cząstek, które mogą okupować
poziom Є
i
, oraz na liczbę stanów kwantowych należących do
każdego poziomu energii.
2. Model Bose’go - Einsteina
Założenia fizyczne są takie same jak w modelu 1. , tyle, że
cząstki są nierozróżnialne. Nie ma również ograniczenia na
liczbę cząstek i stanów kwantowych składających się na
poziom o energii Є
i
.
3. Model Fermiego - Diraca
Model ten ma identyczne założenia jak model 2., tyle tylko,
że każdy stan kwantowy może być obsadzany przez nie więcej
niż jedną cząstkę, co sprowadza się do warunku g
i
≤ N
i
.
Te trzy modele pozwalają analizować dużą liczbę zjawisk
mikroskopowych.

34
Wszystkie trzy modele przyjmują, że określony kwantowy
stan energetyczny może zostać obsadzony na różne sposoby.
Statystyka
Rodzaj cząstek
Energia
skwantowana
Liczba
cząstek
MB
BE
FD
Rozróżnialne
Nierozróżnialne
Nierozróżnialne
Tak
Tak
tak
Dowolna
Dowolna
Jedna
Zadaniem naszej analizy statystycznej jest otrzymanie
rozkładu energii dla warunków równowagi w każdym z modeli
przy zachowaniu stałej energii całkowitej i liczby cząstek.
Innymi słowy będziemy chcieli określić liczbę cząstek
obsadzających dany poziom, co da nam liczbę cząstek na
każdym poziomie dla najbardziej prawdopodobnych
warunków. Najbardziej prawdopodobny rozkład będzie to
rozkład dla stanu równowagi.

35
Najbardziej prawdopodobnym stanem, będzie stan dostępny
dla największej liczby permutacji.
Chcemy więc określić najbardziej prawdopodobny makrostan
układu.
6.8 Aproksymacja Stirlinga
Ponieważ będziemy się zajmowali silniami dużych liczb,
musimy znaleźć pewne uproszczone wyrażenia. Chcąc np..
policzyć lnx ! dla x >>1, możemy napisać:
n
i
i
x
x
x
1
ln
ln
3
ln
2
ln
!
ln
(6.22)
Suma ta jest przybliżona przez powierzchnię pod krzywą:
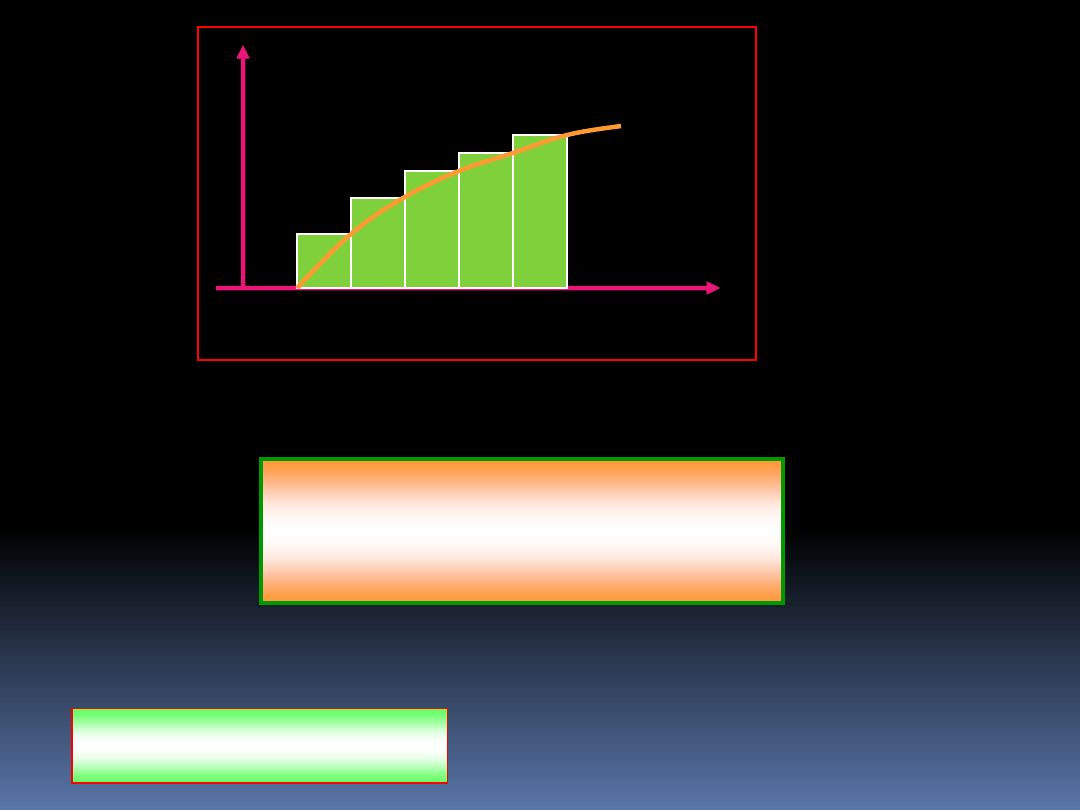
36
1 2 3 4 5 6
y
x
y=lnx
Dla dużych x możemy napisać;
1
ln
!
ln
1
ln
!
ln
1
x
x
x
x
x
dla
dx
x
x
x
Dla dużych x możemy zaniedbać 1 i mamy wtedy,
x
x
x
x
ln
!
ln
Jest to przybliżenie Stirlinga.

37
6.9 Statystyka Bosego-Einsteina
Chcemy otrzymać rozkład równowagowy dla fizycznego
modelu Bosego-Einsteina. Z wzoru
(6.13)
mamy:
i
i
i
i
i
g
N
g
N
)!
1
(
!
)
1
(
Chcemy znaleźć maksymalną wartość prawdopodobieństwa
termodynamicznego
przy warunku:
const
N
N
i
i
(6.23)

38
const
N
U
i
i
i
(6.24)
i
oznacza energię każdej cząstki obsadzającej i-ty
poziom energetyczny.
Jeśli żądamy, aby prawdopodobieństwo termodynamiczne
miało wartość maksymalną, to taką wartość musi też mieć ln
.
i
i
i
i
i
g
N
g
N
)!
1
ln(
!
ln
)!
1
ln(
ln
Jeśli zarówno N
i
i g
i
są >>1, to możemy względem tych
wielkości zaniedbać 1 i użyć wzoru Stirlinga.
,
i
i
i
i
i
i
i
i
i
i
i
i
i
g
g
g
N
N
N
g
N
g
N
g
N
ln
ln
)
(
)
ln(
)
(
ln
(6.25)
Wyrażenie to można jeszcze uprościć.
oraz

39
i
i
i
i
i
i
i
i
i
g
g
N
N
g
N
g
N
ln
ln
)
ln(
)
(
ln
Maksimum wartości prawdopodobieństwa otrzymamy
dla warunku:
0
)
(ln
i
N
(5.27)
Warunek ten oznacza, że wariacja z ln
jest zerowa dla
małych odstępstw N
i
od rozkładu równowagi, lub
i
i
N
N
)
(ln
0
)
(ln
Dla równania
(6.27)
warunek ten przyjmuje postać:
(5.26)

40
0
ln
i
i
i
i
i
N
N
g
N
(6.28)
Zachowanie energii wewnętrznej jest równoważne równaniu:
i
i
N
N
U
U
0
czyli
,
0
i
i
i
N
(6.29)
Z kolei warunek zachowania liczby cząstek jest
równoważne równaniu:
i
i
N
N
N
N
0

41
czyli
0
i
i
N
(6.29)
Mamy więc trzy warunki, które muszą być spełnione aby
otrzymać maksymalne prawdopodobieństwo termodynamiczne.
Bez warunku
(6.24)
i
(6.25)
otrzymalibyśmy z r.
(6.29)
warunek:
0
ln
i
i
i
N
g
N
Gdy określimy całkowitą liczbę cząstek nie wszystkie wartości N
i
są niezależne. Również warunek zachowania energii wewnętrznej
nakłada dodatkowe ograniczenia na niezależność N
i
.
Ażeby w oparciu o równania (5.27), (6.28) i (6.29) uzyskać na
niezależność wielkości N
i
, możemy zastosować metodę mnożników
Lagrange’a. Jeżeli pomnożymy
r.(6.28)
przez stałą liczbę
będącą
funkcją całkowitej energii układu, a równanie
(6.29)
przez stałą

42
zależną od całkowitej liczby cząstek układu i dodamy
otrzymane wielkości do równania (5.23), to otrzymamy
0
)
1
ln(
i
i
i
i
N
i
N
g
(6.30)
Równanie powyższe uwzględnia poprzez stałe
i
ograniczenia
dotyczące energii i liczby cząstek, tak, że wielkości N
i
możemy
uważać za niezależne. Maksymalną wartość prawdopodobieństwa
termodynamicznego otrzymujemy więc dla warunku:
0
)
1
ln(
i
i
i
N
g
co jest równoważne,
1
1
i
i
i
e
A
g
N
(6.31)

43
W poprzednim równaniu stała A = e
. Stałe
i
odgrywają
podobna rolę jak stałe całkowania i określa się je z warunków
brzegowych. Problemem tym zajmiemy się później.
6.10 Statystyka Fermiego-Diraca
i
i
i
i
i
i
i
N
g
N
g
)!
(
!
!
Pamiętamy, że w modelu Fermiego-Diraca dany stan
energetyczny może zostać obsadzony tylko przez jedną cząstkę.
Jest to równoznacznie warunkowi N
i
≥ g
i
. Warunki na
maksymalną wartość prawdopodobieństwa
termodynamicznego otrzymamy w oparciu o wyrażenie (5.16),
Po zastosowaniu wzoru Stirlinga na ln
, otrzymamy warunek
na maksymalną wartość prawdopodobieństwa równy:

44
0
ln
)
(ln
)
(ln
i
i
i
i
i
i
i
N
N
N
g
N
N
(6.32)
Pozostałe dwa warunki dotyczące energii całkowitej i
całkowitej liczby cząstek są następujące:
0
i
i
i
N
U
0
i
i
N
N
(6.33)
(6.34)
Łącząc te trzy warunki w oparciu o metodę mnożników
Lagrange’a, otrzymujemy:
0
)
1
ln(
i
i
i
i
i
N
N
g
(6.35)
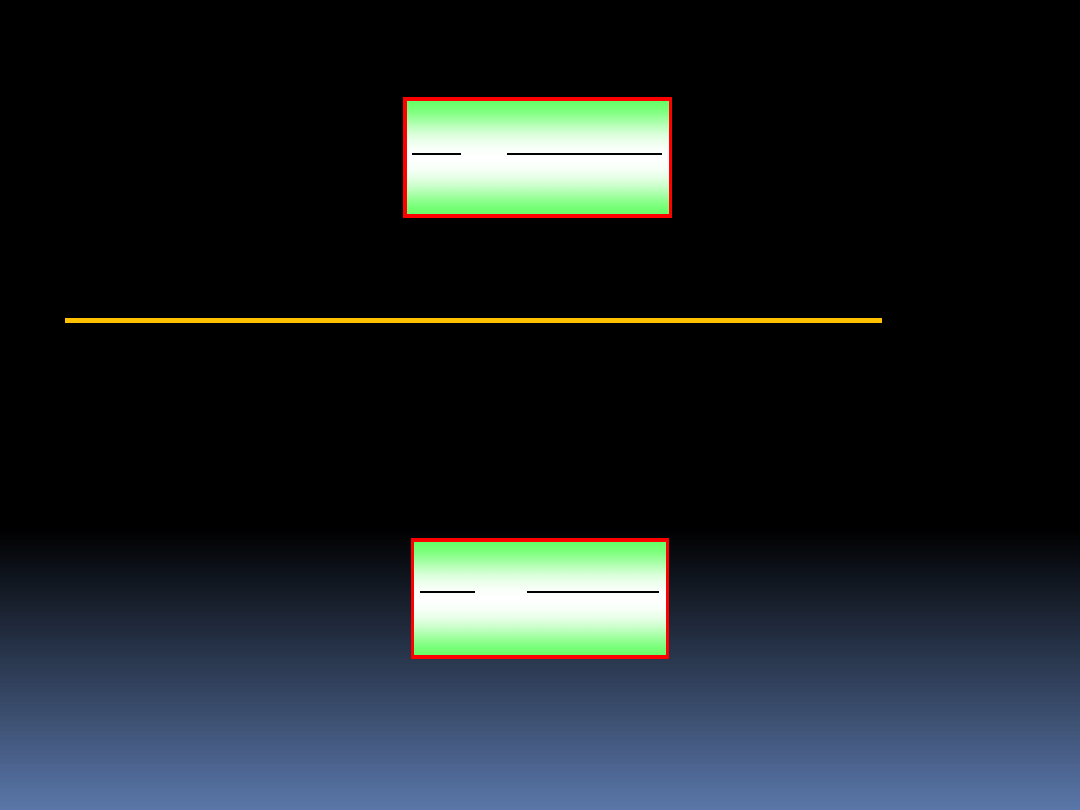
45
Po krótkich przekształceniach otrzymujemy:
1
1
i
i
i
Ae
g
N
(5.36)
6.11 Statystyka Maxwell’a-Boltzmann’a
Posługując się podobną procedurą jak w poprzednich dwóch
modelach fizycznych otrzymujemy następujący rozkład
cząstek zajmujących stany energetyczne o energii Є
i
:
i
i
i
Ae
g
N
1
(5.37)
Poznane przez nas równania
(6.31),(6.36)
i
(6.37)
są do siebie
bardzo podobne. Różnią się one tylko tym, w jaki sposób w

46
mianowniku występuje jedynka.
Załóżmy sytuację fizyczną taką, że N
i
<< g
i
. Oznacza to, że
liczba cząstek jest znacznie mniejsze niż liczba dostępnych
stanów kwantowych dla każdego poziomy energetycznego. W
tym przypadku czynnik 1 w równaniu (5.27) i (5.32) jest
bardzo mały w porównaniu do czynnika A e
Єi
i wtedy
zarówno rozkład Fermiego-Diraca jak i Bosego-Einsteina
zbliżają się do modelu Maxwell’a-Bolzmann’a.
Ten graniczny przypadek jest bardzo ważny, gdyż pozwala
nam analizować cząstki nierozróżnialne prostym rozkładem
Maxwell’a-Bolzmann’a dla N
i
<< g
i
.

47
6.12 Przybliżenie klasyczne modelu
Maxwell’a-Bolzmann’a
Aby móc mówić o przybliżeniu klasycznym musimy zaniedbać
własności kwantowe. Możemy to zrobić w następujący sposób.
Rozważmy model Maxwella-Bolzmanna dla g
i
= 1 dla wszystkich
stanów energetycznych, i załóżmy, że energia ma rozkład ciągły,
czyli nie kwantowy. Istnieje więc dla takiego ciągłego rozkładu
nieskończenie wiele możliwych stanów energetycznych.
Wobec powyższego, liczba cząstek mających energię Є
i
jest dana
przez
i
i
Ae
N
1
(6.38)
Ograniczeniem dla tego modelu jest fakt, że istnieją
nierozróżnialne cząstki mikroskopowe, co uniemożliwia analizę
pewnych substancji modelem Maxwella-Bolzmanna.

48
Wyjątek stanowią przypadki, gdy używamy go jako graniczny
przypadek modeli Fermiego-Diraca i Bosego Einsteina.
6.13 Rozkład prawdopodobieństwa dla stanu
równowagi
Do tej pory określiliśmy najbardziej prawdopodobne stany
równowagi cząstek odsadzających różne poziomy energetyczne
przy warunku stałej energii układu i stałej liczby cząstek.
Rozkłady te określają najbardziej prawdopodobny makrostan.
Znaleźliśmy postać funkcji opisującej to prawdopodobieństwo,
lecz nie wyznaczyliśmy stałych
i
. Znaleźliśmy stany, które
mają największe prawdopodobieństwo obsadzenia. Jeśli wyniki
które uzyskaliśmy dotyczą rzeczywiście najbardziej
prawdopodobnego stanu, to musi on być powiązany z
makroskopowymi , normalnie obserwowalnymi własnościami.

49
Rozważmy jak na wyliczone prawdopodobieństwo wpłynęłaby
ewentualna zmiana liczby cząstek w układzie. Prześledźmy to
na przykładzie rozkładu Maxwella-Bolzmanna.
i
i
N
i
N
g
N
i
!
!
,
)
ln
ln
(
ln
ln
ln
ln
ln
i
i
i
i
i
i
i
i
i
i
i
i
N
g
N
N
N
N
N
N
g
N
N
N
N
(6.39)
Aby uzyskać najbardziej prawdopodobny rozkład połączmy
ostatnie równanie z równaniem (5.37)
i
i
i
Ae
g
N
1
.
Otrzymamy wtedy:

50
)
(ln
ln
ln
max
i
i
i
A
N
N
N
(6.40)
Chcemy zbadać, jaki będzie wpływ zmiany cząstek N
i
na
prawdopodobieństwo
. Chcemy porównać (
max
+
) z
max
, gdzie
jest odstępstwem od
max
spowodowane
zmianą
N
i
od najbardziej prawdopodobnego rozkładu. W
oparciu o równanie
(6.39)
możemy napisać:
)
ln(
)
(
ln
)
(
ln
)
ln(
i
i
i
i
i
i
i
i
i
N
N
N
N
g
N
N
N
N
(6.41)
Odejmując od tego równania równanie (5.35) otrzymujemy:
i
i
i
i
i
i
i
i
i
i
i
N
N
N
N
N
N
N
g
)
ln(
)
1
ln(
ln
ln
(6.42)
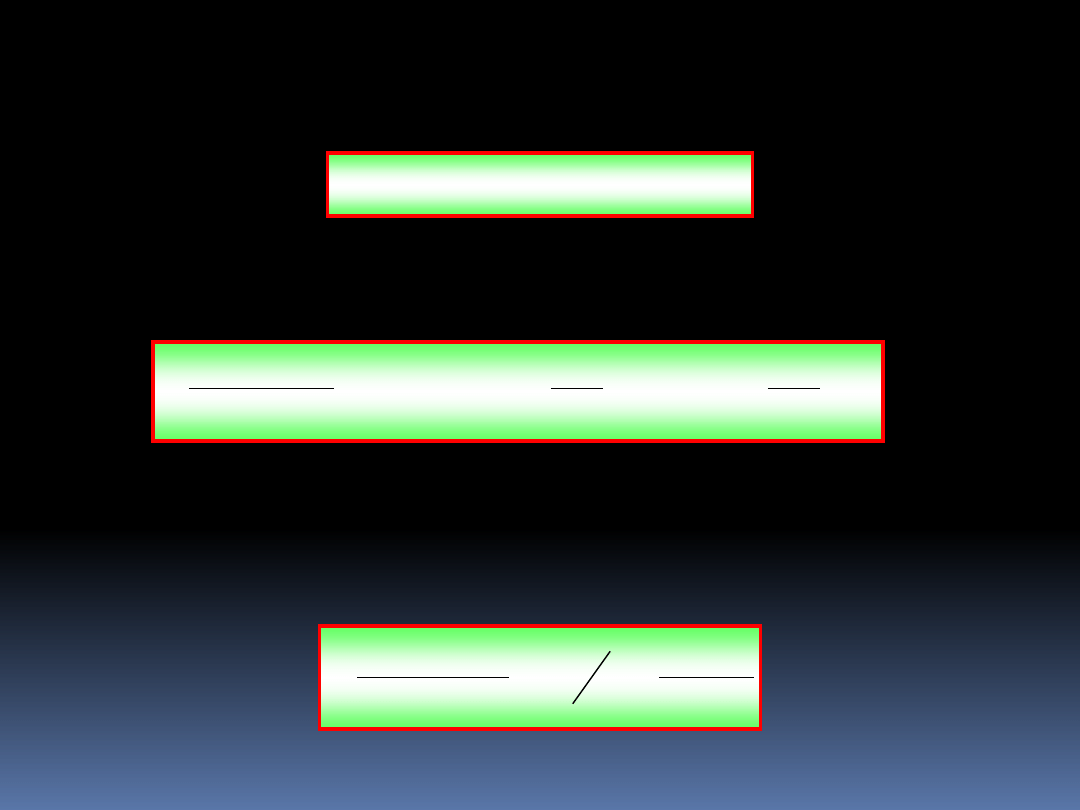
51
Jednym z warunków na maksymalną wartość
prawdopodobieństwa
max
jest
(ln
) = 0, lub (patrz
r. (6.39)
),
0
)
ln
(ln
i
i
i
i
N
N
g
(6.43)
Odejmując to równanie od
r.(6.42)
, otrzymujemy:
i
i
i
i
i
i
i
i
N
N
N
N
N
N
)
1
ln(
)
1
ln(
ln
max
max
(6.44)
Zakładając, że
N
i
<< N
i
możemy równanie (6.44)
doprowadzić do postaci:
i
i
i
N
N
2
max
max
)
(
2
1
ln
(6.45)
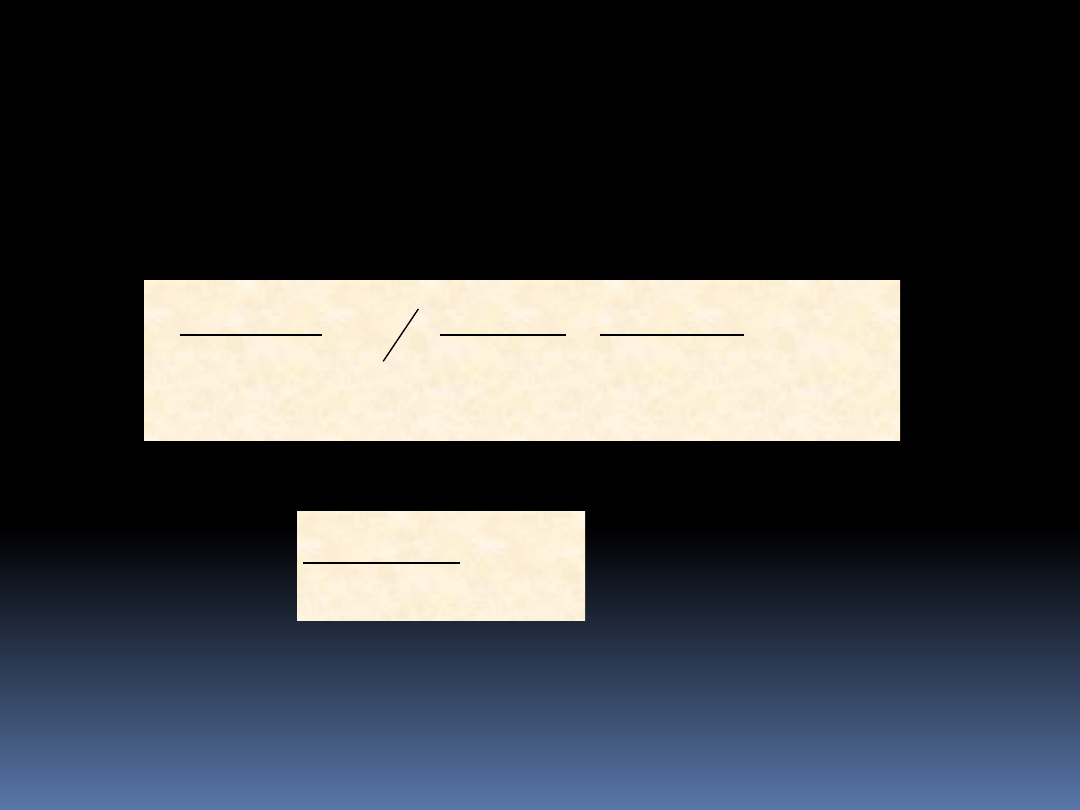
52
Rozważmy przykład, w którym dwa stany mają tą samą energię
i w sumie 6x10
23
cząstek. Dla najbardziej prawdopodobnego
rozkładu będzie w każdej z nich 3x10
23
cząstek. Załóżmy, że 0.1
procenta cząstek zmienia komórkę. Mamy wtedy,
N
1
= N
2
=3x10
23
,
N
1
= -
N
2
= (0.01)·3·10
23
= 3·10
21
19
10
3
max
max
e
czyli
19
23
2
21
23
2
21
max
max
10
3
10
3
)
10
3
(
10
3
)
10
3
(
2
1
ln
Widzimy więc, że prawdopodobieństwo zmienia się
nieznacznie.

53
7. Zestawienie najwazniejszych wzorow i definicji
7.1 Funkcje termodynamiczne:
Energia wewnetrzna -
Definicja ciepla -
Definicja entalpii -
Definicja entropii -
ad
el
W
dU
)
(
(I zasada)
el
el
W
dU
Q
pV
U
H
T
dQ
dS
/
(II zasada)
o
T
g
k
S
ln
lim
0
(III zasada)

54
7.2 Warunki mozliwosci zachodzenia procesow
Dla ukladu izolowanego adiabatycznie -
Dla ukladu zamknietego -
Warunki calkowe -
Warunki na parametry -
0
S
(II zasada)
0
S
T
W
U
o
el
B
A
o
el
S
T
Q /
0
T
S
V
p
V
p
0
V
p
C
C
0
,
T
p
c
Wyszukiwarka
Podobne podstrony:
AGH Wyklad 4 id 52883 Nieznany (2)
AGH Wyklad 8 id 52885 Nieznany (2)
AGH Wyklad 9 id 52886 Nieznany (2)
AGH Wyklad 3 id 52882 Nieznany (2)
LOGIKA wyklad 5 id 272234 Nieznany
ciagi liczbowe, wyklad id 11661 Nieznany
AF wyklad1 id 52504 Nieznany (2)
Neurologia wyklady id 317505 Nieznany
ZP wyklad1 id 592604 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
or wyklad 1 id 339025 Nieznany
II Wyklad id 210139 Nieznany
cwiczenia wyklad 1 id 124781 Nieznany
BP SSEP wyklad6 id 92513 Nieznany (2)
MiBM semestr 3 wyklad 2 id 2985 Nieznany
algebra 2006 wyklad id 57189 Nieznany (2)
olczyk wyklad 9 id 335029 Nieznany
Kinezyterapia Wyklad 2 id 23528 Nieznany
więcej podobnych podstron