
ZESZYTY PROBLEMOWE POSTĘPÓW NAUK ROLNICZYCH 2009 z. 534: 163-171
DYNAMIKA FORMOWANIA ZARODKÓW SOMATYCZNYCH
W KULTURACH in vitro TULIPANA
Małgorzata
Maślanka
, Anna
Bach
Katedra Roślin Ozdobnych, Uniwersytet Rolniczy im. H. Kołłątaja w Krakowie
Wstęp
Tulipan, ze względu na długotrwałą i mało wydajną drogę rozmnażania, jest
obiektem wielu badań, mających na celu zwiększenie plonu oraz przyspieszenie jego
uprawy. Obiecującą technologią produkcji tulipana jest somatyczna embriogeneza, ze
względu na bardzo szybki i wydajny sposób rozmnażania
[D
E
V
ROOMEN
1997].
Somatyczne zarodki, powstające z komórek innych niż zygota, czyli na drodze
rozmnażania bezpłciowego, poprzez manipulowanie składem pożywki, mogą tworzyć
się w dużej ilości, w stosunkowo krótkim czasie
[K
Ę
PCZYŃSKA
2006].
Liczba uzyskanych
zarodków, obok ich jakości, decyduje o przydatności somatycznej embriogenezy do
masowej produkcji roślin. W przypadku tulipana nie opracowano, jak dotąd, metody
szybkiego i synchronicznego otrzymywania licznych somatycznych zarodków, pomimo
poznania już mechanizmów kontrolujących te procesy.
Celem przeprowadzonych badań było określenie wpływu czasu trwania kultury
na efektywność formowania zarodków somatycznych (terminu pojawienia się
pierwszych zarodków globularnych i torpedo oraz ich liczby) u tulipana. Zbadano także
wpływ różnych stężeń auksyny na dynamikę formowania zarodków.
Materiał i metody
Badania przeprowadzono na tulipanach odmiany ‘Apeldoorn’ (należącej do grupy
mieszańców Darwina) i ‘Rosy Wing’ (z grupy pojedynczych późnych). Jako
eksplantaty inicjalne zastosowano zalążnie, wyizolowane z chłodzonych przez 12
tygodni, w 5
°
C, cebul o obwodzie 11-12 cm. Zdezynfekowane eksplantaty cięto na 1-2-
mm fragmenty (plastry) i wykładano do szalek Petriego na pożywki zawierające sole
mineralne według
M
URASHIGE
i S
KOOG
[1962]
, 25 lub 50
µ
M Picloramu; 0,25-10
µ
M BA,
3% sacharozy, zestalone 0,7% agarem. Kultury prowadzono w ciemności, w 20
°
C.
Tworzący się żółty, embriogeniczny kalus odejmowano od tkanki matecznej,
namnażano na jednej z pożywek inicjalnych, a następnie poddano działaniu 10 lub 5
µ
M Picloramu oraz 1
µ
M BA, w celu formowania zarodków somatycznych, zgodnie
z procedurą według
B
ACH
i P
TAK
[2001].
W czasie 20 tygodni prowadzenia kultury określono procent eksplantatów
różnicujących zarodki globularne oraz liczbę, powstałych z 1 g kalusa, zarodków w
M. Maślanka, A. Bach
164
stadium torpedy (długości 5-10 mm), w zależności od genotypu, stężenia auksyny i
czasu trwania kultury.
Analizę histologiczną formujących się struktur sporządzono w oparciu
o preparaty mikroskopowe, wykonane metodą parafinową według
F
ILUTOWICZA
i K
UśDOWICZA
[1951].
Doświadczenie wykonano w 5 powtórzeniach po 5 eksplantatów.
Wyniki opracowano statystycznie za pomocą metody analizy wariancji. Porównanie
ś
rednich i określenie grup jednorodnych wykonano przy użyciu testu Duncana, z
uwzględnieniem poziomu istotności
α
= 0,05.
Wyniki i dyskusja
Różnicowanie zarodków w fazie rozwoju globularnego
Do rozwoju somatycznych zarodków u tulipana niezbędne jest obniżenie stężenia
auksyny w pożywce lub jej usunięcie
[G
UDE
,
D
IJKEMA
1997].
Różnicowanie zarodków
stymuluje również obecność cytokinin, najsilniej podczas powstawania zarodków w
stadium globularnym, któremu towarzyszą intensywne podziały komórkowe
[S
ZWEYKOWSKA
1994].
Kultury zwykle prowadzi się w ciemności, stymulującej m.in.
rozwój zarodków globularnych
[B
ACH
,
W
ARCHOŁ
2000]
oraz obniżającej stopień
deformacji zarodków w stadium torpedy
[M
AŚLANKA
,
B
ACH
2007].
ś
rednie oznaczone tymi samymi literami nie różnią się istotnie na poziomie istotności
α
=0,05; means marked
with the same letter du not differ significantly at the significance level
α
=0.05
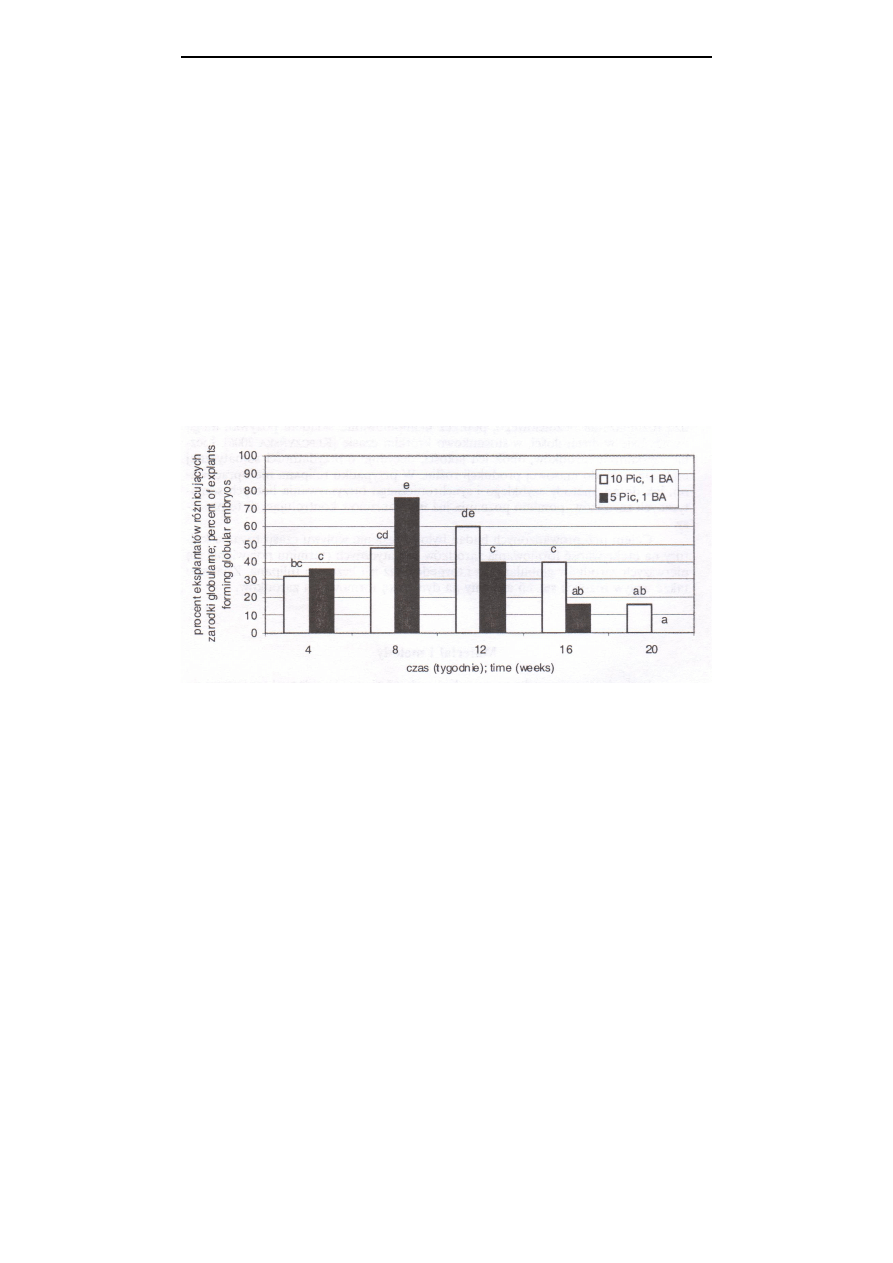
Rys. 1. Wpływ czasu trwania kultury i stężenia auksyny na różnicowanie zarodków globularnych
u odmiany ‘Apeldoorn’
Fig. 1.
Effect of cultivation time and auxin concentration on the globular embryo diffe-
rentiation of cv. ‘Apeldoorn’
W przeprowadzonym doświadczeniu, formowanie zarodków globularnych
zachodziło na drodze embriogenezy pośredniej, przez kalus. Różnicowanie to miało
miejsce od pierwszych tygodni doświadczenia, ale nasiliło się po 2-3 miesiącach
prowadzenia kultury. W przypadku odmiany ‘Apeldoorn’ i pożywki z 5
µ
M auksyny,
najwyższy procent eksplantatów formujących zarodki globularne, wynoszący 76%,
odnotowano po 8 tygodniach trwania kultury. Stosując 10
µ
M Picloramu, większe
różnicowanie zarodków, równe 60%, otrzymano po 12 tygodniach od założenia
DYNAMIKA FORMOWANIA ZARODKÓW SOMATYCZNYCH ...
165
doświadczenia, w stosunku do pozostałego okresu kultury. Wraz z upływem czasu
trwania kultury obniżała się wydajność kalusa embriogenicznego w tworzeniu
zarodków, a po 20 tygodniach pod wpływem 5
µ
M Picloramu nie obserwowano
różnicowania nowych zarodków (rys. 1).
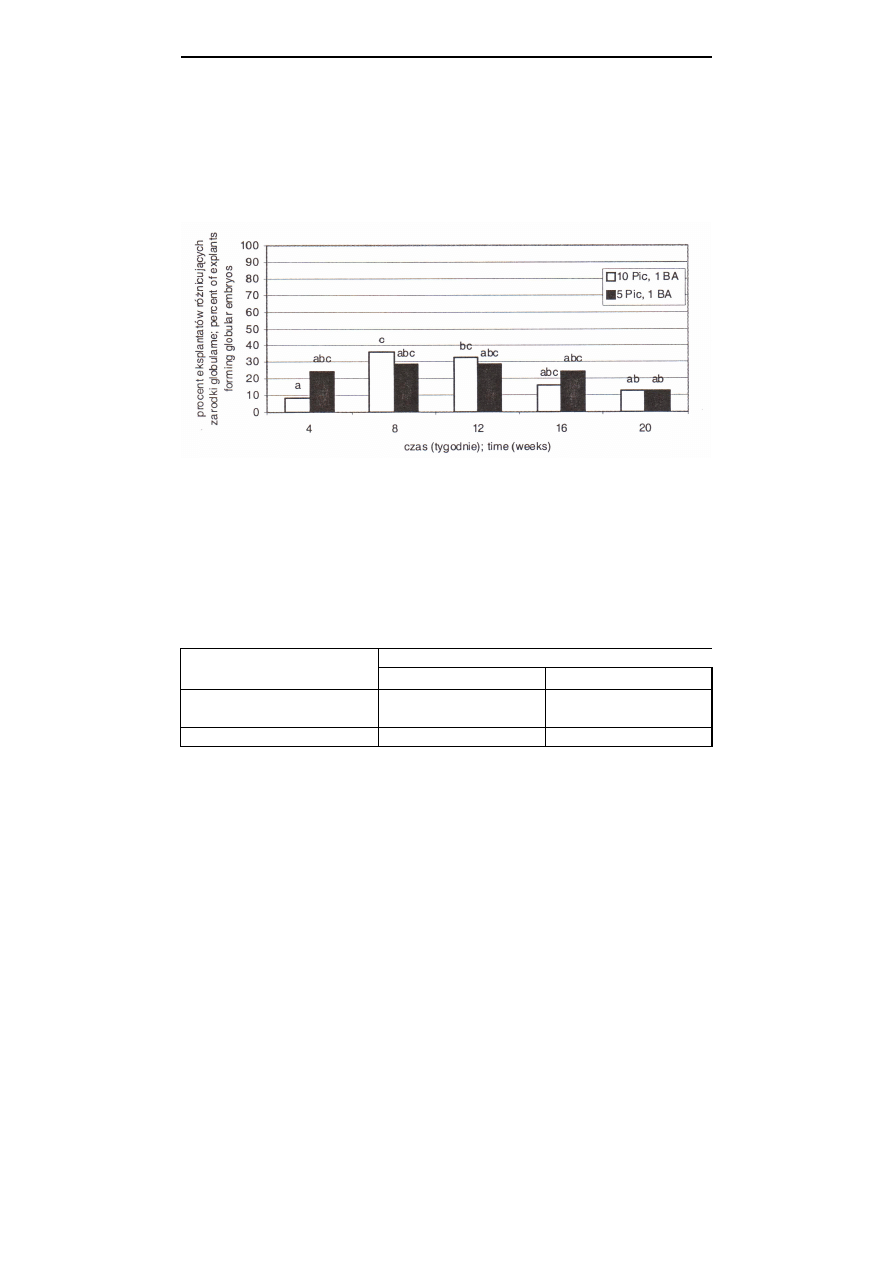
U tulipana ‘Rosy Wing’ zaobserwowano intensywniejsze różnicowanie zarodków
globularnych po 2-3 miesiącach, w stosunku do całego okresu kultywacji, niezależnie
od stężenia auksyny (rys. 2).
objaśnienia jak w rys. 1; explanations see Fig. 1
Rys. 2. Wpływ czasu trwania kultury i stężenia auksyny na różnicowanie zarodków globularnych
u odmiany ‘Rosy Wing’
Fig. 2.
Effect of cultivation time and auxin concentration on the globular embryo diffe-
rentiation of cv. ‘Rosy Wing’
Tabela 1; Table 1
Procent eksplantatów różnicujących zarodki globularne, w zależności od genotypu
i stężenia auksyny, przez 20 tygodni prowadzenia kultury
Percentage of explants forming globular embryos, depending on genotype
and auxin concentration, for 20 weeks of cultivation
Pożywka; Medium
Odmiana; Cultivar
Apeldoorn
Rosy Wing
10
µ
M Picloram, 1
µ
M BA
39,2 b
20,8 a
5
µ
M Picloram, 1
µ
M BA
33,6 b
23,2 a
Ś
rednia; Average
36,4 b
22,0 a
objaśnienia jak w rys. 1; explanations see Fig. 1
Oceniając wpływ stężenia auksyny na różnicowanie zarodków, u obu odmian
tulipana stwierdzono, że badana cecha nie była zależna od różnych stężeń Picloramu
(tab. 1). Różnicowanie zarodków globularnych uzależnione było natomiast od
genotypu.
Odmiana ‘Apeldoorn’ efektywniej formowała początkowe stadia zarodków
(36,4% eksplantatów) niż ‘Rosy Wing’ (22% eksplantatów; tab. 1).
Kalus embriogeniczny obu badanych odmian tulipana, utrzymywany na po-
ż
ywkach z 10 lub 5
µ
M Picloramu oraz 1
µ
M BA, stopniowo tracił embriogeniczny
charakter i różnicował coraz mniej zarodków. W kulturach kalusa przetrzymywanych
M. Maślanka, A. Bach
166
przez dłuższy czas na pożywce z auksyną lub cytokininą następują zwykle zmiany
epigenetyczne, polegające na względnie trwałym uniezależnieniu się od egzogennych
regulatorów. Procesowi temu sprzyja prowadzenie kultur w ciemności
[O
RLIKOWSKA
1997].
Być może kalus tulipana po kilku miesiącach kultury in vitro traci stopniowo
wrażliwość na obecne w pożywce auksyny i cytokininy, albo też stosowane regulatory
w niższych stężeniach działają słabiej. O działaniu regulatorów roślinnych decyduje nie
tylko ich rodzaj i koncentracja, ale także wrażliwość eksplantatu na te regulatory w
momencie aplikacji. Działanie substancji wzrostowych zależy także od wieku kultur
[O
RLIKOWSKA
1997].
Niestety zdarza się, że kalus embriogeniczny ma powolny wzrost i
szybko traci kompetencję do embriogeniczności
[R
AGHAVAN
1997].
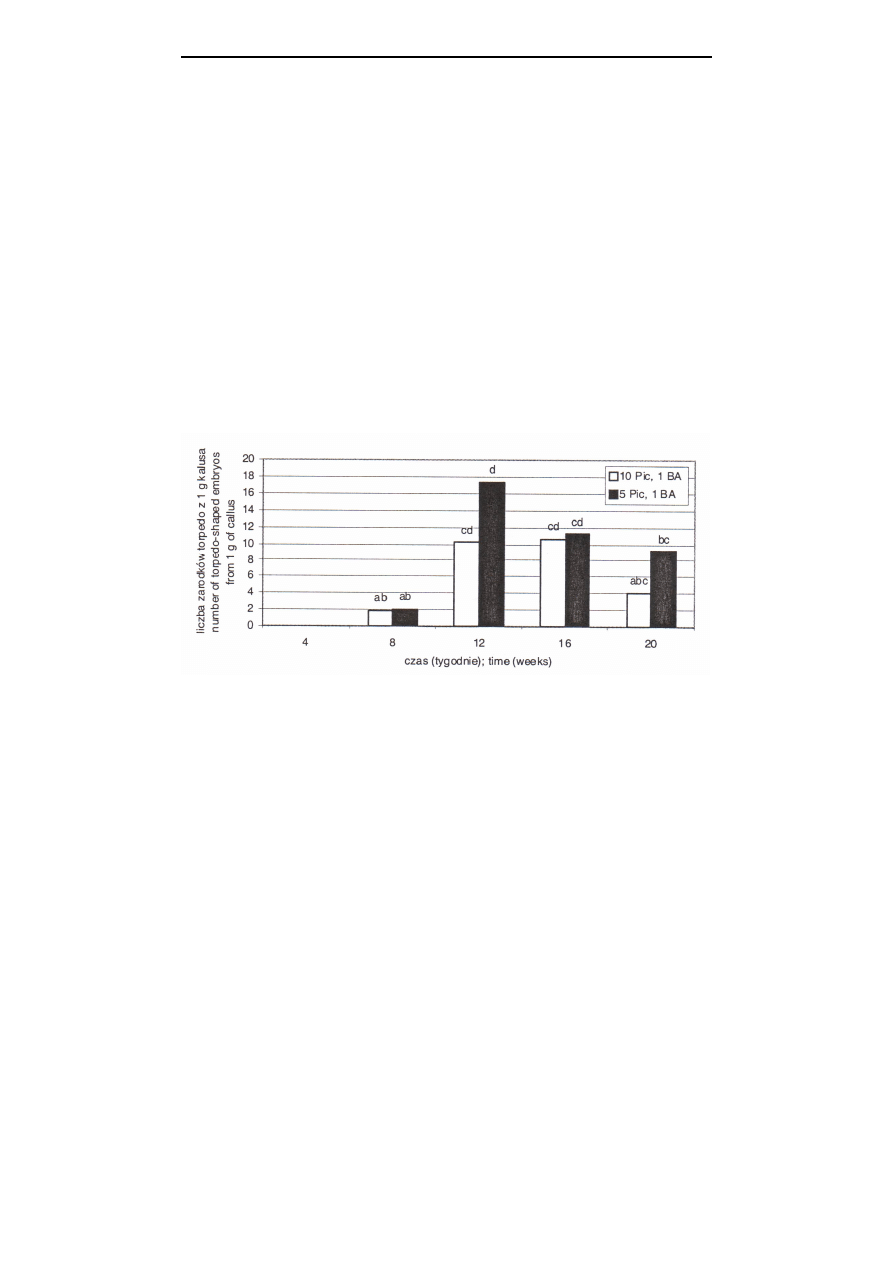
Różnicowanie zarodków w stadium torpedy
Somatyczne zarodki tulipana w stadium torpedy, długości 5-10 mm, obser-
wowano w 8 i 12 tygodniu prowadzenia kultury, odpowiednio u odmiany ‘Apeldoorn’ i
‘Rosy Wing’. U obu badanych odmian więcej zarodków uformowało się po 12
tygodniach kultury, w porównaniu z pozostałym okresem trwania doświadczenia (rys.
3, 4).
B
OUMAN
i in. [1999]
otrzymywali w pełni wykształcone zarodki tulipana po 10
tygodniach na pożywkach niezawierających auksyn.
B
ACH
i P
TAK
[2001]
natomiast
obserwowały formowanie się pierwszych zarodków w 12. tygodniu od chwili założenia
kultur.
objaśnienia jak w rys. 1; explanations see Fig. 1
Rys. 3. Wpływ czasu trwania kultury i stężenia auksyny na liczbę zarodków w stadium torpedy
u odmiany ‘Apeldoorn’
Fig. 3.
Effect of cultivation time and auxin concentration on the number of torpedo-shaped
embryos of cv. ‘Apeldoorn’
Stężenie auksyny nie miało wpływu na liczbę otrzymanych zarodków w stadium
torpedy. U obu badanych odmian, więcej (o ponad 30%) uformowanych zarodków na
pożywce z 5
µ
M Picloramu nie stanowiło istotnej różnicy w stosunku do pożywki ze
stężeniem Picloramu równym 10
µ
M (tab. 2).
P
TAK
i B
ACH
[2007]
największą liczbę
somatycznych zarodków tulipana uzyskały na pożywkach z przeważającym udziałem
Picloramu nad BA.

DYNAMIKA FORMOWANIA ZARODKÓW SOMATYCZNYCH ...
167
objaśnienia jak w rys. 1; explanations see Fig. 1
Rys. 4. Wpływ czasu trwania kultury i stężenia auksyny na liczbę zarodków w stadium torpedy
u odmiany ‘Rosy Wing’
Fig. 4.
Effect of cultivation time and auxin concentration on the number of torpedo-shaped
embryos of cv. ‘Rosy Wing’
Tabela 2; Table 2
Liczba zarodków w stadium torpedy, z 1 g kalusa, w zależności od genotypu i stężenia auksyny,
przez 20 tygodni prowadzenia kultury
Number of torpedo-shaped embryos, from 1 g of callus, depending on genotype and auxin
concentration, for 20 weeks of cultivation
Pożywka; Medium
Odmiana; Cultivar
Apeldoorn
Rosy Wing
10
µ
M Picloram, 1
µ
M BA
5,32 ab
1,6 a
5
µ
M Picloram, 1
µ
M BA
7,96 b
2,6 a
Ś
rednia; Average
6,64 b
2,1 a
objaśnienia jak w rys. 1; explanations see Fig. 1
Podobnie jak w przypadku różnicowania zarodków globularnych, liczba
uzyskanych zarodków w stadium torpedy także zależała od genotypu rośliny. Średnio
6,64 zarodków otrzymano z 1 g kalusa tulipana ‘Apeldoorn’ w ciągu 20 tygodni,
niezależnie od pożywki. Odmiana ‘Rosy Wing’ uformowała w tych samych warunkach
trzykrotnie mniej zarodków (tab. 2). Porównana przez autorów
[B
ACH
, P
TAK
2002]
odmiana ‘Apeldoorn’ również charakteryzowała się większą efektywnością procesu
somatycznej embriogenezy w stosunku do odmiany ‘Red Matador’ (mieszaniec
Darwina). Z kolei w badaniach
P
ODWYSZYŃSKIEJ
i in. [1997]
odmiana ‘Apeldoorn’ okazała
się mieć najsłabsze zdolności do różnicowania, w porównaniu z innymi odmianami
tulipana.
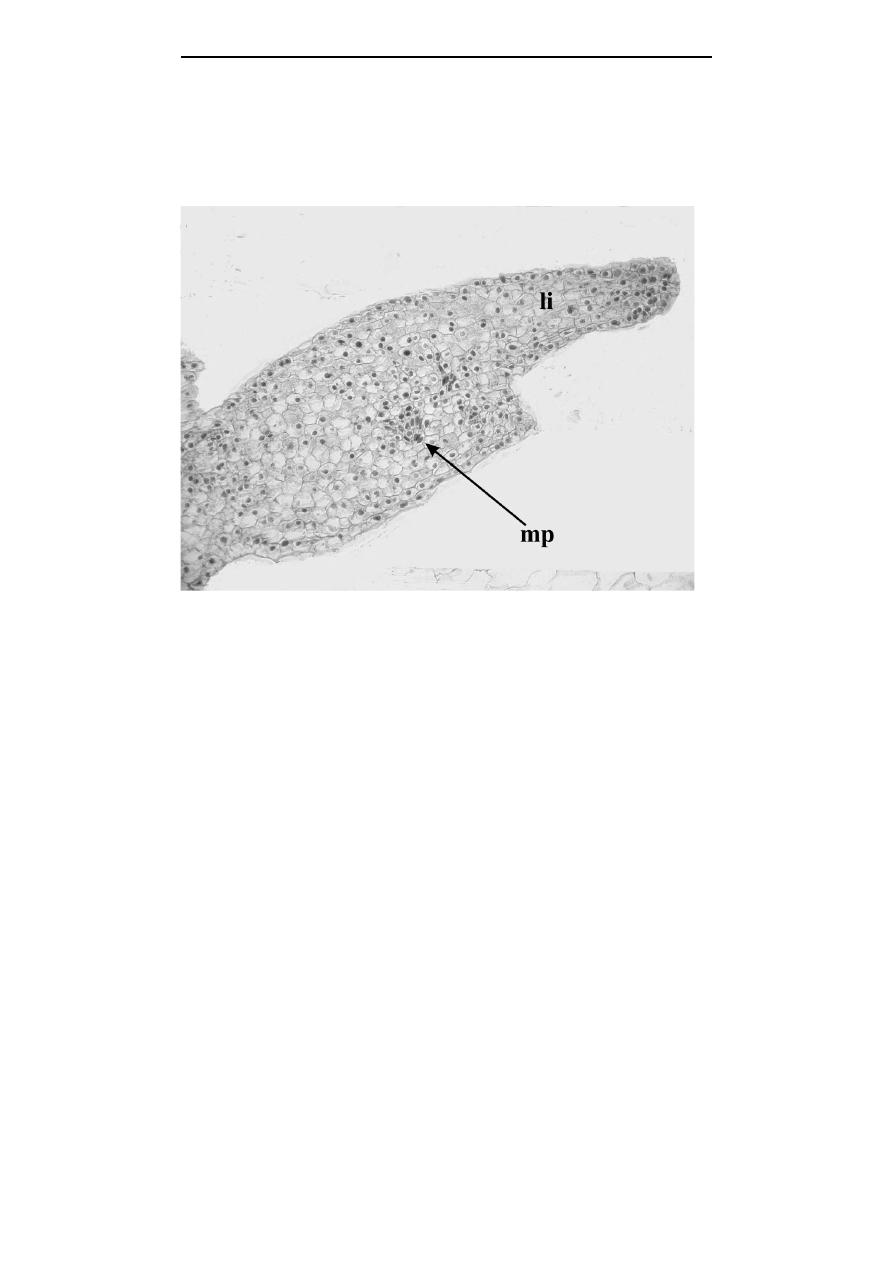
Analiza histologicza
Analiza histologiczna otrzymanych regularnych, dwubiegunowych struktur,
z uformowanym liścieniem, pasmem wiązek przewodzących i merystemem pędowym
potwierdziła, że w przeprowadzonych badaniach istotnie formowały się zarodki
M. Maślanka, A. Bach
168
somatyczne, które swoją budową odpowiadały zarodkom zygotycznym (fot. 1).
Niestety, zregenerowane zarodki tulipana nie posiadały korzenia. Wzdłuż somatycznych
zarodków tulipana
P
ODWYSZYŃSKA
i M
ARASEK
[2003]
również zaobserwowały podłużne
pasma wiązek naczyniowych, nie odnotowały natomiast formowania się korzonka
zarodkowego. Brak korzeni u somatycznych zarodków tulipana można tłumaczyć
wysoką temperaturą (20-23
°
C) kultur in vitro i obecnością cytokinin, które opóźniają
ich rozwój
[P
ODWYSZYŃSKA
,
M
ARASEK
2003].
Fot. 1. Przekrój podłużny przez somatyczny zarodek tulipana (pow. 30
×
, li - liścień, mp -
merystem pędowy)
Photo 1.
Longitudinal section of the tulip somatic embryo (magnification 30
×
, li - cotyledon,
mp - shoot meristem)
Wnioski
1.
Długość okresu prowadzenia kultury odgrywała istotną rolę w somatycznej
embriogenezie tulipanów. Wzrost różnicowania zarodków globularnych ob-
serwowano do 8-12 tygodnia kultury in vitro, a formowanie zarodków w stadium
torpedy nasiliło się po 3 miesiącach kultury.
2.
Stężenie auksyny w zakresie 5 i 10
µ
M nie miało istotnego wpływu na róż-
nicowanie zarodków globularnych i formowanie torped.
3.
Wydajność somatycznej embriogenezy zależała od genotypu. Zarodki globularne
różnicowało średnio 36% eksplantatów ‘Apeldoorn’ i 22% ‘Rosy Wing’. Tulipan
‘Apeldoorn’ uformował większą liczbę zarodków somatycznych (średnio 6,6) niż

DYNAMIKA FORMOWANIA ZARODKÓW SOMATYCZNYCH ...
169
‘Rosy Wing’ (średnio 2,1) z 1 g kalusa.
4.
Analiza histologiczna potwierdziła formowanie zarodków somatycznych
w stadium torpedy.
Literatura
B
ACH
A.,
P
TAK
A. 2001.
Somatic embryogenesis and plant regeneration from ovaries of
Tulipa gesneriana L. in in vitro cultures. Acta Horticulturae 560: 391-394.
B
ACH
A.,
P
TAK
A. 2002.
Nowa metoda mikrorozmnażania tulipana (Tulipa gesneriana L.)
z tkanek zalążni. Zesz. Probl. Post. Nauk Rol. 483: 13-19.
B
ACH
A.,
W
ARCHOŁ
M. 2000.
Effect of light quality on proliferation of embryogenic
callus of Hyacinthus orientalis cv. Delft’s Blue. Acta Biologica Cracoviensia 42: 17.
B
OUMAN
H.,
L
ANGENS
M.,
S
CHOO
W.,
D
IJKEMA
M. 1999.
Somatic embryogenesis of tulip.
Acta Biologica Cracoviensa 41: 34.
D
E
V
ROOMEN
C.O.N. 1997.
Farm management aspects of somatic embryogenesis for tulip
bulb production. Acta Horticulturae 430: 383-388.
F
ILUTOWICZ
A.,
K
UśDOWICZ
A. 1951.
Mikrotechnika roślinna. PWRiL, Warszawa.
G
UDE
H.,
D
IJKEMA
M.H.G.E. 1997.
Somatic embryogenesis in tulip. Acta Horticulturae
430: 275-280.
K
ĘPCZYŃSKA
E. 2006.
Kiełkowanie i konwersja somatycznych zarodków in vitro. Bio-
technologia 4(75): 78-94.
M
AŚLANKA
M.,
B
ACH
A. 2007.
Wpływ kwasu abscysynowego oraz światła na wzrost
i rozwój zarodków somatycznych tulipana (Tulipa gesneriana L.). Zesz. Probl. Post.
Nauk Rol. 523: 155-161.
M
URASHIGE
T.,
S
KOOG
F. 1962.
A revised medium for rapid growth and bioassays with
tobacco tissue culture. Plant Physiology 15: 473-497.
O
RLIKOWSKA
T. 1997.
Regulatory roślinne w kulturach in vitro, w: Regulatory wzrostu i
rozwoju roślin. Zastosowanie w ogrodnictwie, rolnictwie, leśnictwie i w kulturach
tkanek. Jankiewicz S.L. Praca zbiorowa, PWN, Warszawa: 219-247.
P
ODWYSZYŃSKA
M.,
M
ARASEK
A. 2003.
Effects of thidiazuron and paclobutrazol on
regeneration potential of tulip flower stalk explants in vitro and subsequent shoot
multiplication. Acta Societatis Botanicorum Poloniae 72(3): 181-190.
P
ODWYSZYŃSKA
M.,
M
ARASEK
A.,
G
ABRYSZEWSKA
E. 1997.
Indukcja tworzenia pędów
przybyszowych i zarodków somatycznych w kulturach in vitro tulipana. Zeszyty Nau-
kowe AR w Krakowie 318: 195-198.
P
TAK
A.,
B
ACH
A. 2007.
Somatic embryogenesis in tulip (Tulipa gesneriana L.) flower
stem cultures. In Vitro Cellular and Developmental Biology - Plant 43: 35-39.
R
AGHAVAN
V. 1997.
Molecular embryology of flowering plants. Somatic embryogenesis.
Cambridge University Press: 467-499.
S
ZWEYKOWSKA
A. 1994.
Procesy różnicowania w kulturach tkanek i komórek roślinnych.
Prace Ogrodu Botanicznego Polskiej Akademii Nauk 5/6: 9-18.

M. Maślanka, A. Bach
170
Słowa kluczowe:
tulipan, somatyczna embriogeneza, zarodki globularne, torpedo
Streszczenie
Kalus embriogeniczny tulipanów odmian ‘Apeldoorn’ i ‘Rosy Wing’, uzyskany
z eksplantatów zalążni, wykładano na pożywki z obniżoną zawartością substancji
wzrostowych, w stosunku do pożywki namnażającej, w celu formowania zarodków
somatycznych. W czasie 20 tygodni prowadzenia kultury tkanki embriogenicznej, na
pożywkach z 10 i 5
µ
M Picloramu, określano procent eksplantatów różnicujących
zarodki w fazie rozwoju globularnego w zależności od genotypu, stężenia auksyny i
czasu trwania kultury. Określano również liczbę, powstałych z 1 g kalusa, zarodków w
stadium torpedy.
Największy procent eksplantatów różnicujących zarodki globularne odnotowano
po 8 i 12 tygodniach prowadzenia kultury, wynoszący odpowiednio 62% i 50% dla
odmiany ‘Apeldoorn’ oraz 32% i 30% dla odmiany ‘Rosy Wing’. Również po 3
miesiącach kultury uzyskano
najwięcej zarodków w stadium rozwoju torpedo (blisko 14
szt. u ‘Apeldoorn’ i 4 szt. u ‘Rosy Wing’), po tym czasie obniżała się liczba
pozyskiwanych zarodków. Formowanie zarodków somatycznych uzależnione było od
genotypu badanej rośliny. Średnio 6,64 zarodków otrzymano z kalusa odmiany
‘Apeldoorn’ w ciągu 20 tygodni, niezależnie od pożywki, co stanowiło trzykrotną,
istotną przewagę nad odmianą ‘Rosy Wing’.
DYNAMICS OF SOMATIC EMBRYO FORMATION IN TULIP
in vitro CULTURES
Małgorzata Maślanka, Anna Bach
Department of Ornamental Plants, Agricultural University, Kraków
Key words:
tulip, somatic embryogenesis, globular and torpedo-shaped embryos
Summary
Embryogenic callus of tulips cv. ‘Apeldoorn’ and ‘Rosy Wing’, obtained from
ovary explants, was put on medium with a lower level of growth regulators, as
compared to the proliferation medium, in order to produce somatic embryos. During 20
weeks of the embryogenic tissue cultivation, treated with 10 and 5
µ
M Picloram, the
effect of genotype, auxin concentration and cultivation time on the globular embryo
differentiation were investigated. The number of torpedo-shaped embryos obtained from
1g of callus were also examined.
The highest percentage of explants forming globular embryos were observed after
8 and 12 weeks of cultivation. For ‘Apeldoorn’ it was 62 and 50%, and for ‘Rosy Wing’
32 and 30%, respectively. After three months of the embryogenic callus cultivation, the
highest number of torpedo-shaped embryos (about 14 for ‘Apeldoorn’ and 4 for ‘Rosy
Wing’) were obtained. However, during the prolongation of culture the embryo number
decreased.
Somatic embryo formation closely depended on the genotype. During 20 weeks
of cultivation, ‘Apeldoorn’ tulip produced, on the average, 6,64 embryos, independently
of medium composition. It trebled the results of ‘Rosy Wing’.

DYNAMIKA FORMOWANIA ZARODKÓW SOMATYCZNYCH ...
171
Dr inż. Małgorzata Maślanka
Katedra Roślin Ozdobnych
Uniwersytet Rolniczy im. H. Kołłątaja
al. 29 Listopada 54
31-425 KRAKÓW
e-mail: maslankam@ogr.ar.krakow.pl
Wyszukiwarka
Podobne podstrony:
in vitro, studia rolnictwo, rok IV
Kultury in vitro roslin rozmnazanie klonalne
In vitro antitumor actions of extracts
In vitro truskawka id 212540 Nieznany
1 1 Podstawowe definicje; główne kierunki przemian rozwojowych roślinnych tkanek in vitro(1)
Życie ludzkie świętość czy zabawka nt in vitro
In vitro, Sem 1, TMR3
6 Hodowle komórek skóry w warunkach in vitro
Kościół katolicki wobec zapłodnienia In vitro, Etyka, Bioetyka
IN VITRO GRZECH CZY SZANSA
in vitro 2
In vitro liliowce
In vitro a współczesna cywilizacja, RODZINA
In vitro groźne, godność życia-in vitro
wyklad V in vitro
in vitro cd07w2
Dr Półtawska o in vitro, bioetyka
więcej podobnych podstron