
16. Pochodne kwasów karboksylowych.
(konwersatorium, gr. A1 – Chemia, II rok, 2014/2015Z)
Zagadnienia
a) Nazewnictwo systematyczne
i zwyczajowe pochodnych kwasów karboksylowych: chlorków
i bezwodników kwasowych, estrów (w tym laktonów), amidów (w tym laktamów) oraz nitryli.
b) Nazewnictwo systematyczne i zwyczajowe związków wielofunkcyjnych. Reguły ważności grup
funkcyjnych (kwasy karboksylowe > estry > amidy > nitryle > aldehydy > ketony > alkohole >aminy >
alkeny > alkiny).
c) Substytucja nukleofilowa przy grupie acylowej: a) mechanizmy reakcji (!) (bezpośrednia substytucja
poprzez tetraedryczny produkt pośredni oraz substytucja katalizowana kwasem); b) względna reaktywność
pochodnych kwasów karboksylowych; c) zależność szybkości reakcji od objętości podstawników R grupy
acylowej, wielkości nukleofila oraz sprzężenia grupy karbonylowej (w obrębie jednego typu pochodnych
kwasów karboksylowych).
d) Zastosowanie substytucji nukleofilowej przy grupie acylowej:
• otrzymywanie kwasów karboksylowych i ich pochodnych R
1
COG (G=Cl, OH, R
2
COO,
NH
2
/NHR
3
/NR
3
R
4
) na drodze ich wzajemnych przekształceń: a) hydroliza (R
1
COG +H
2
O→R
1
COOH,
kat. H
+
lub OH
-
); b) alkoholiza chlorków i bezwodników kwasowych (R
1
COG+R
2
OH→R
1
COOR
2
,
ew. kat. H
+
); c) amonoliza (R
1
COG /oprócz amidów/+NH
3
/lub aminy I-rz. i II-rz./→R
1
CONH
2
/lub
amidy II-rz. i III-rz./);
• otrzymywanie alkoholi: a) redukcja kwasów karboksylowych, chlorków kwasowych lub estrów za
pomocą LiAlH
4
(→alkohole I-rz.); b) reakcja chlorków kwasowych lub estrów z odczynnikami
Grignarda (→alkohole III-rz.);
• otrzymywanie aldehydów lub ketonów: a) redukcja chlorków kwasowych za pomocą tri-tert-butoksy-
hydroglinianu litu (Li
+
Al[OC(CH
3
)
3
]
3
H; →aldehydy); b) redukcja estrów za pomocą wodorku
diizobutyloglinowego (DIBAH lub DIBAL-H, [(CH
3
)
2
CHCH
2
]
2
AlH, -78ºC; →aldehydy); c) reakcja
chlorków kwasowych ze związkami diorganomiedziowymi (tzw. odczynnikami Gilmana, R'
2
Cu
-
Li
+
;
→ketony);
• otrzymywanie amin (redukcja amidów za pomocą LiAlH
4
/podobnej redukcji ulegają również azydki i
nitryle);
• otrzymywanie laktonów (wewnątrzcząsteczkowa estryfikacja odpowiednich hydroksykwasów, kat. H
+
)
oraz laktamów (wewnątrzcząsteczkowa cyklizacja
γ
- i
δ
-aminokwasów lub aminoestrów).
e) Inne, laboratoryjne metody otrzymywania pochodnych kwasów karboksylowych: a) chlorki kwasowe (kwas
karboksylowy+chlorek tionylu /SOCl
2
/ lub chlorek oksalilu /(COCl)
2
/); b) bezwodniki kwasowe
(odwadnianie kwasów dikarboksylowych o odpowiedniej strukturze /tylko w przypadku otrzymywania
niektórych bezwodników wewnątrzcząsteczkowych/); c) estry (i. estryfikacja Fischera /kwas karboksy-
lowy+alkohol, kat. H
+
/; ii. anion karboksylanowy+alifatyczny halogenek I-rz. lub II-rz. (S
N
2);
iii. transestryfikacja estrów /podstawienie istniejącej grupy alkoksylowej inną gr. alkoksylową/); d) amidy
(i. kwas karboksylowy+amoniak lub amina, wysoka temperatura /metoda małoefektywna i rzadko
stosowana/; ii. przegrupowanie Beckmanna oksymów /kat. H
+
lub PCl
5
/); e) nitryle (i. I-rz. halogenek
alkilowy+CN
-
(S
N
2); ii. dehydratacja amidów I-rz. pod wpływem SOCl
2
/stosuje się też P
2
O
5
, POCl
3
lub
bezwodnik octowy/; iii. wymiana grupy diazoniowej na gr. –CN /reakcja Sandmeyera z CuCN; →nitryle
aromatyczne/; iv. addycja nukleofilowa CN
-
do ketonów lub aldehydów /→cyjanohydryny/).
f) Reakcje nitryli: a) hydroliza (H
2
O, kat. H
+
lub OH
-
; →amidy lub powstające w wyniku dalszej hydrolizy
kwasy karboksylowe); b) redukcja (i. LiAlH
4
; aminy /pośrednia imina ulega dalszej redukcji kolejną
cząsteczką LiAlH
4
/; ii. wodorek diizobutyloglinowy /DIBAH lub DIBAL-H/, [(CH
3
)
2
CHCH
2
]
2
AlH, -78ºC;
→aldehyd /pośrednia imina nie ulega dalszej redukcji; może być hydrolizowana do aldehydu/); c) reakcja
z odczynnikami Grignarda (→ketony /w wyniku hydrolizy pośrednich anionów iminowych/).
g) Inne (wybrane) reakcje z udziałem pochodnych kwasów karboksylowych: a) degradacja Hofmanna amidów
I-rz. (Br
2
, OH
-
; →aminy); b) acylowanie Friedla-Craftsa (zw. aromatyczny+chlorek lub bezwodnik
kwasowy, kat. np. AlCl
3
; →ketony).
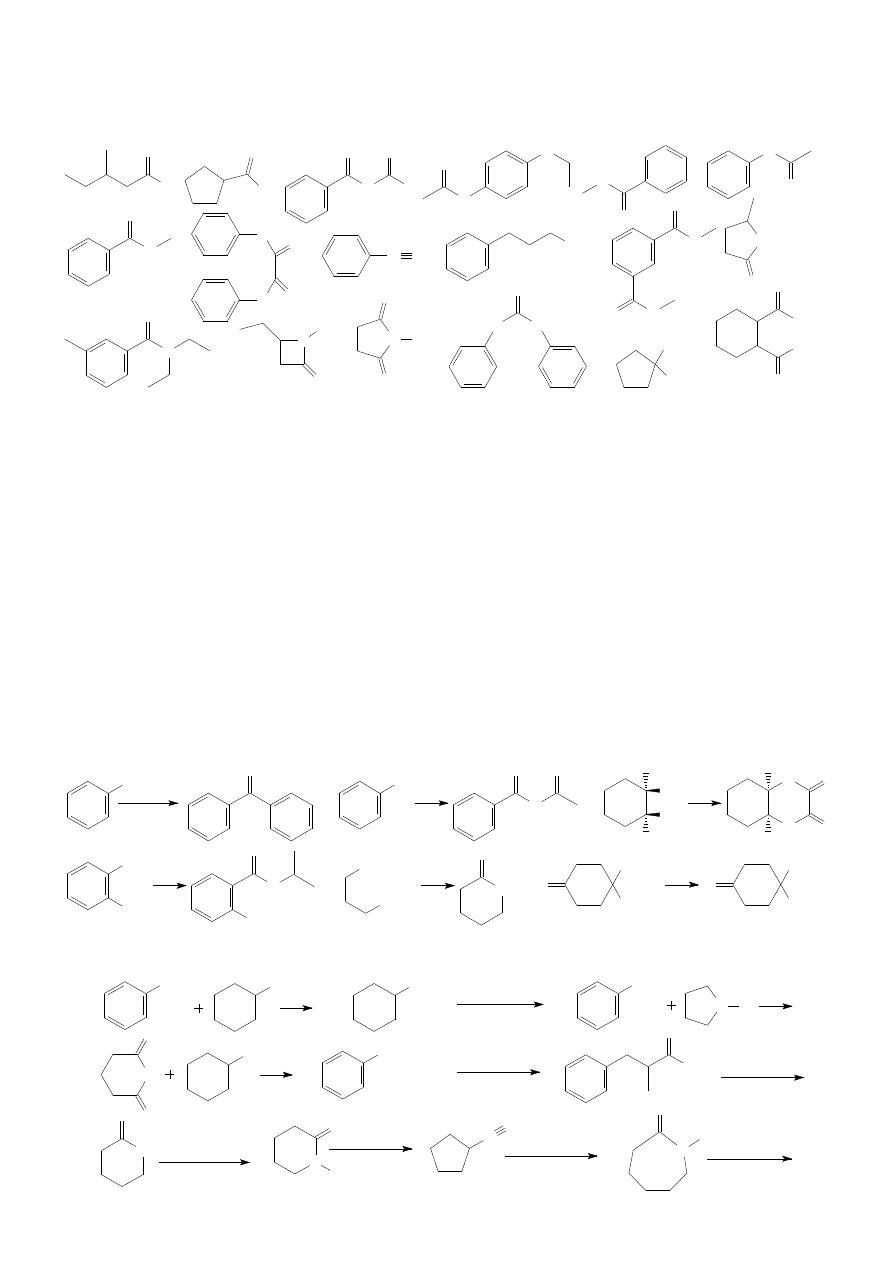
Zadania
1. Nazwij poniższe związki.
a)
b)
c)
d)
f)
g)
e)
O
Cl
O
O
O
H
O
N
H
O
H
N
O
O
O
O
O
C
N
O
Cl
h)
CN
i)
j)
k)
O
O
O
O
l)
O
O
O
O
O
O
m)
O
N
n)
N
O
H
o)
N
O
O
Br
p)
O
O
O
OH
CN
s)
r)
O
NH
2
O
H
2. Narysuj wzory strukturalne następujących związków.
a)
α
-metylo-
γ
-walerolaktam
b) bezwodnik bursztynowy
c) ftalimid
d)
β
-bromomaślan p-nitrofenylu
e) N-fenylo-N,2-dimetylopropanoamid
f) chlorek propanoilu
3. Wskaż główne produkty reakcji chlorku benzoilu z poniższymi reagentami. Przedstaw dokładny
mechanizm reakcji dla przypadku b).
a) etanol
b) octan sodu
c) anilina
d) anizol (kat. AlCl
3
)
e) nadmiar bromku fenylomagnezowego, następnie rozcieńczony kwas
4. Zaproponuj produkty poniższych reakcji. Przedstaw dokładny mechanizm przemiany a).
a) anilina + bezwodnik octowy (kat. H
+
)
b) fenol + bezwodnik mrówkowo-octowy
c) anizol + bezwodnik bursztynowy (kat. AlCl
3
)
d) 2-amino-1-fenyloetanol + bezwodnik octowy (1 mol)
e) 2-amino-1-fenyloetanol + bezwodnik octowy (nadmiar)
5. Zaproponuj sposób wydajnego przeprowadzenia poniższych syntez.
a)
COCl
O
b)
COOH
O
O
O
c)
H
H
OH
OH
H
H
O
O
O
O
d)
COOH
COOH
COOH
O
O
e)
CHO
CH
2
OH
O
O
f) O
COOCH
3
COOCH
3
O
CH
2
OH
CH
2
OH
6. Przedstaw i nazwij produkty poniższych reakcji.
a)
b)
c)
d)
e)
COCl
OH
COOCH
3
CH
3
NH
2
ogrzew.
COCl
N
H
O
O
O
NH
2
COOCH
2
CH
3
1. LiAlH
4
2. H
2
O
f)
N
O
H
2. H
2
O
1. LiAlH
4
g)
h)
O
O
1.PhMgBr
(nadmiar)
2. H
2
O
i)
1. CH
3
MgI
2. H
2
O
C
N
j)
N
O
H
NaOH
H
2
O
O
NH
2
Br
2
, NaOH
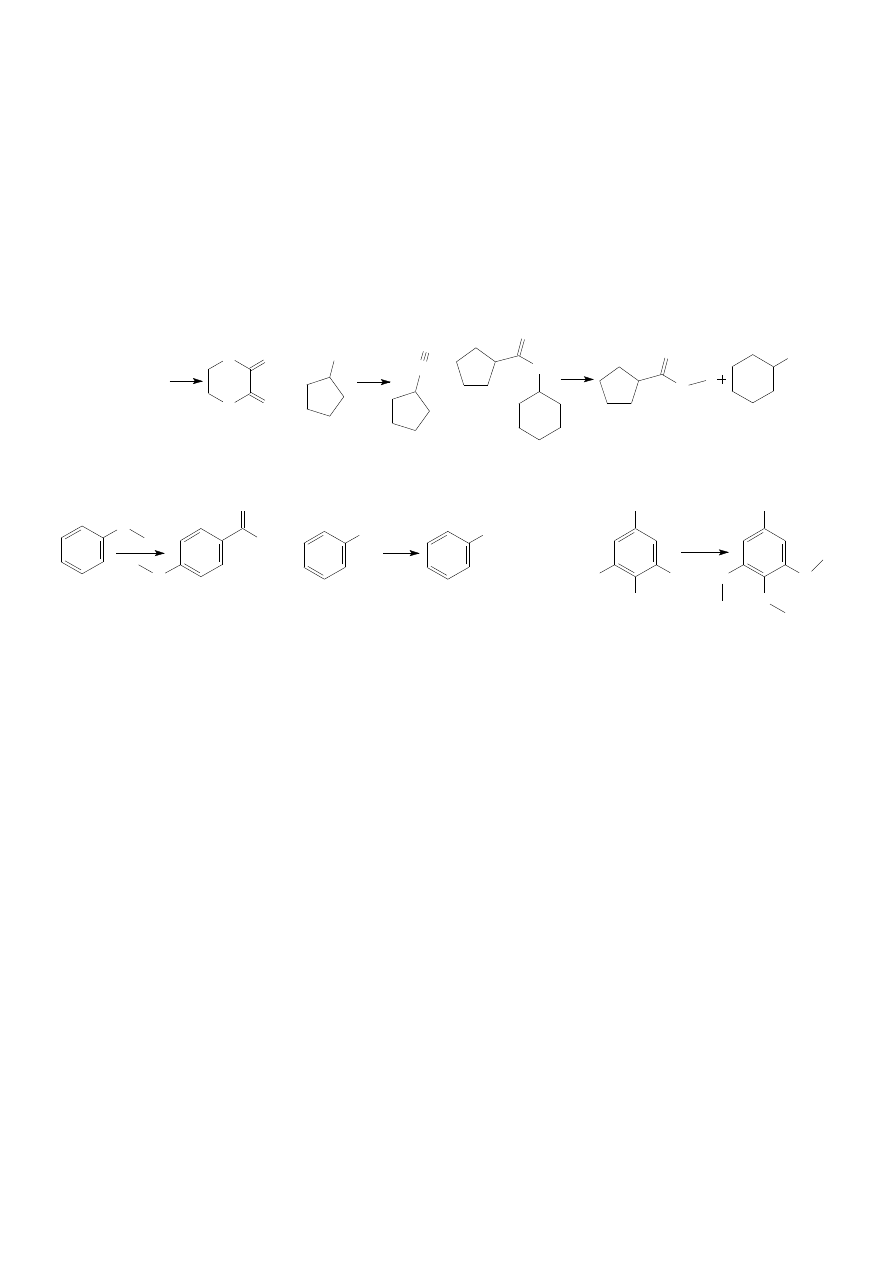
7. W każdej grupie wskaż związek najszybciej i najwolniej ulegający hydrolizie w środowisku zasadowym.
I. a) bezwodnik benzoesowy
b) chlorek acetylu
c) acetanilid
II. a) 2,2-dimetylopropionian metylu
b) benzoesan tert-butylu
c) octan izobutylu
8. Przedstaw sposób przeprowadzenia poniższych syntez (niektóre z nich wymagają więcej niż jednego
etapu).
a) alkohol izopentylowy → octan izopentylu (olejek bananowy)
b) kwas 3-etylopentanowy → 3-etylopentanonitryl
c) izobutyloamina → N-izobutyloformamid → N-metyloizobutyloamina
d) octan etylu → 3-metylopentan-3-ol
e) cykloheksyloamina → N-cykloheksyloacetamid
f) bromocykloheksan → dicykloheksylometanol
g)
szczawian
dimetylu
N
H
H
N
O
O
h)
CH
2
OH
C
N
i)
O
O
O
O
OH
9. Zaproponuj sposób przeprowadzenia poniższych, wieloetapowych syntez, używając przedstawionych
substratów i innych niezbędnych reagentów.
CH
2
Br
CH
2
CH
2
NH
2
b)
c)
COOH
HO
OH
OH
CH
2
CH
2
NH
2
O
O
O
kwas galusowy
meskalina
a)
O
O
O
NH
2
Wyszukiwarka
Podobne podstrony:
16 Pochodne kwasow karboksylowych materiały dodatkowe
15 Pochodne kwasów karboksylowych (08 11 2011)
kwasy i pochodne Synteza pochodnych kwasów karboksylowych – estrów
wyk 10 pochodne kwasów karboksylowych
pochodne kwasów karboksylowych
tabelka pochodne kwasow karboksylowych, farmacja cm umk, Farmacja III rok, chemia leków
15 Pochodne kwasow karboksylowych materiały dodatkowe
pochodne kwasow karboksylowych, Chemia organiczna
15 Pochodne kwasów karboksylowych (08 11 2011)
!!!Właściwości nasyconych kwasów karboksylowych
Właściwości i zastosowanie kwasów karboksylowych
kawsy i mydła - chemia, Właściwości kwasów karboksylowych o rodniku alifatycznym
otrzymywanie i reakcje kwasow karboksylowych
Estry i tłuszcze, ESTRY KWASÓW KARBOKSYLOWYCH
wyklad 16 Kataliza kwasowo zasadowa
17 Estry kwasow karboksylowych
ściąga z kwasów karboksylowych
więcej podobnych podstron