

1.
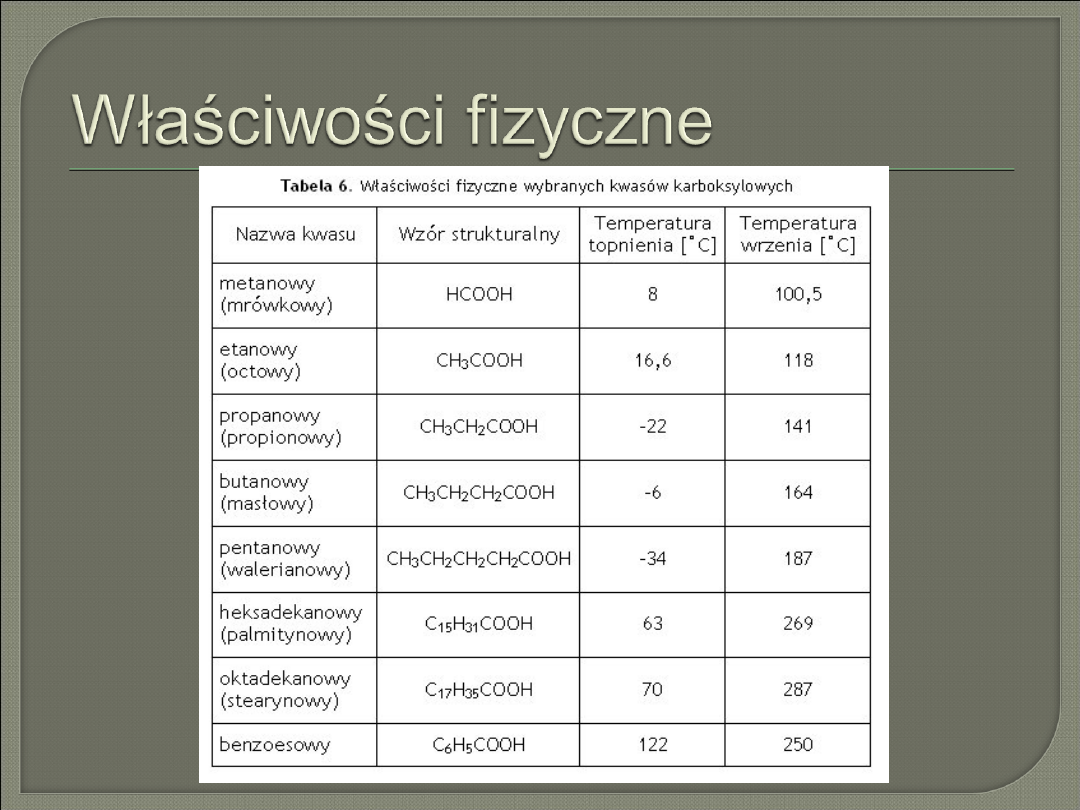
Właściwości fizyczne
2.
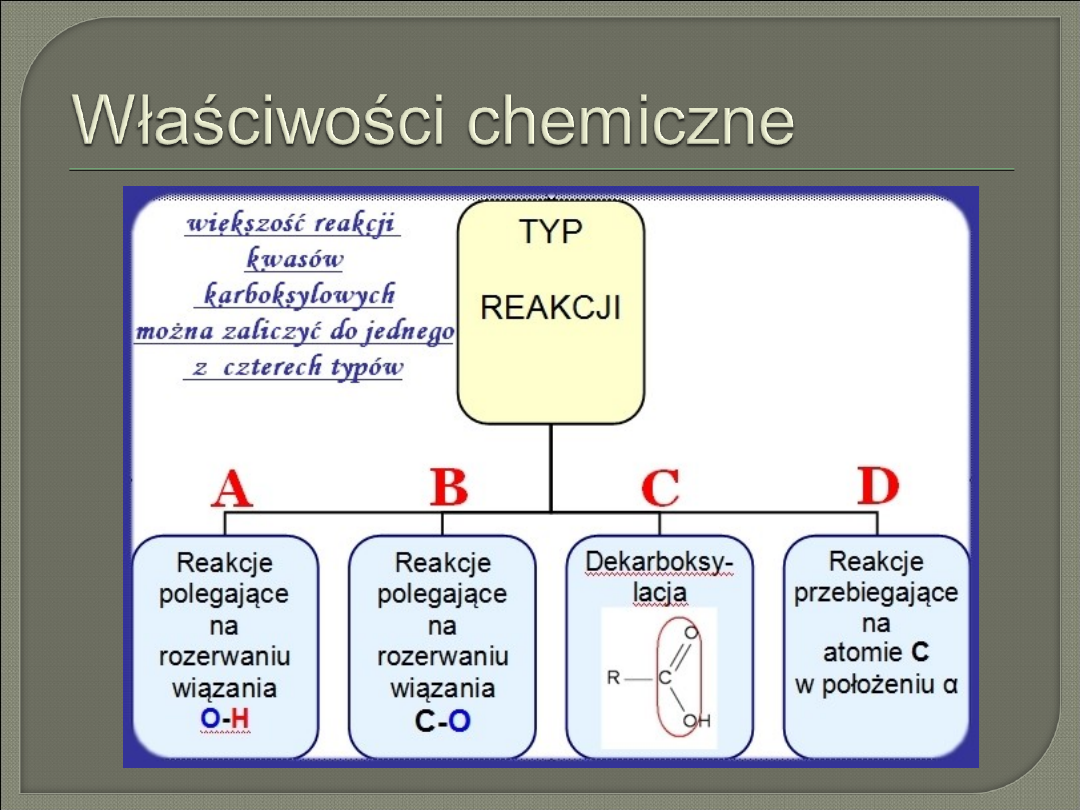
Właściwości chemiczne - zarys
3.
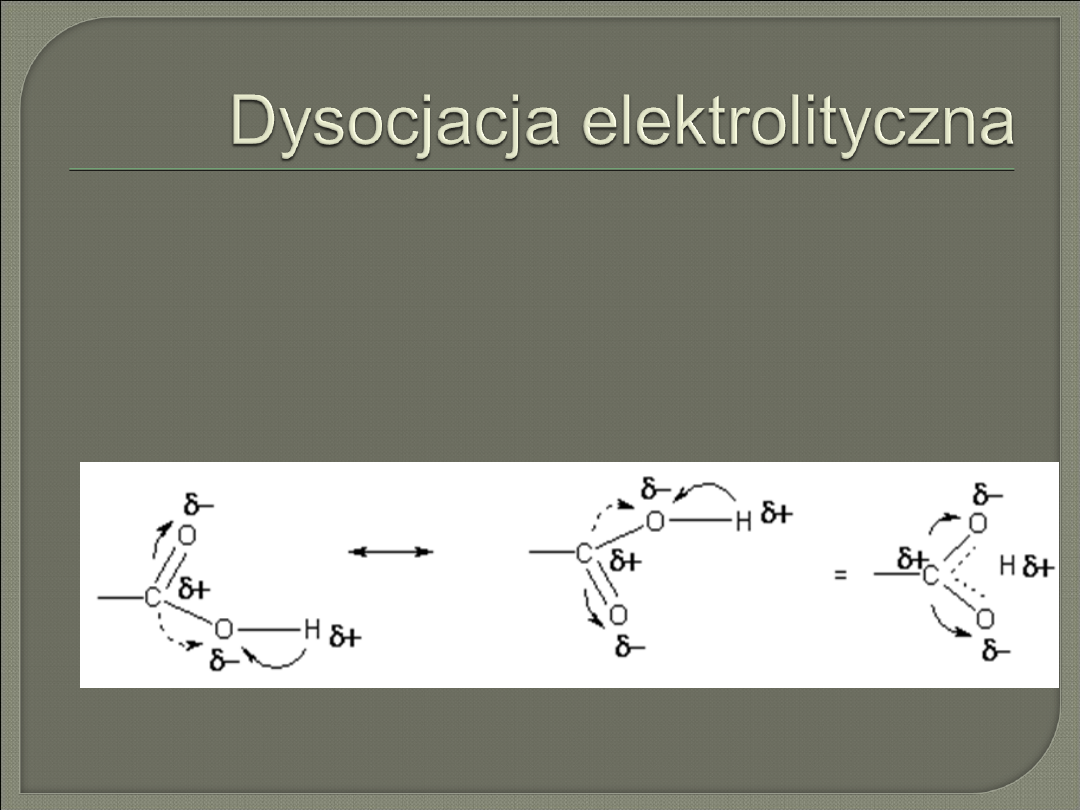
Dysocjacja elektrolityczna
4.
Moc kwasu
5.
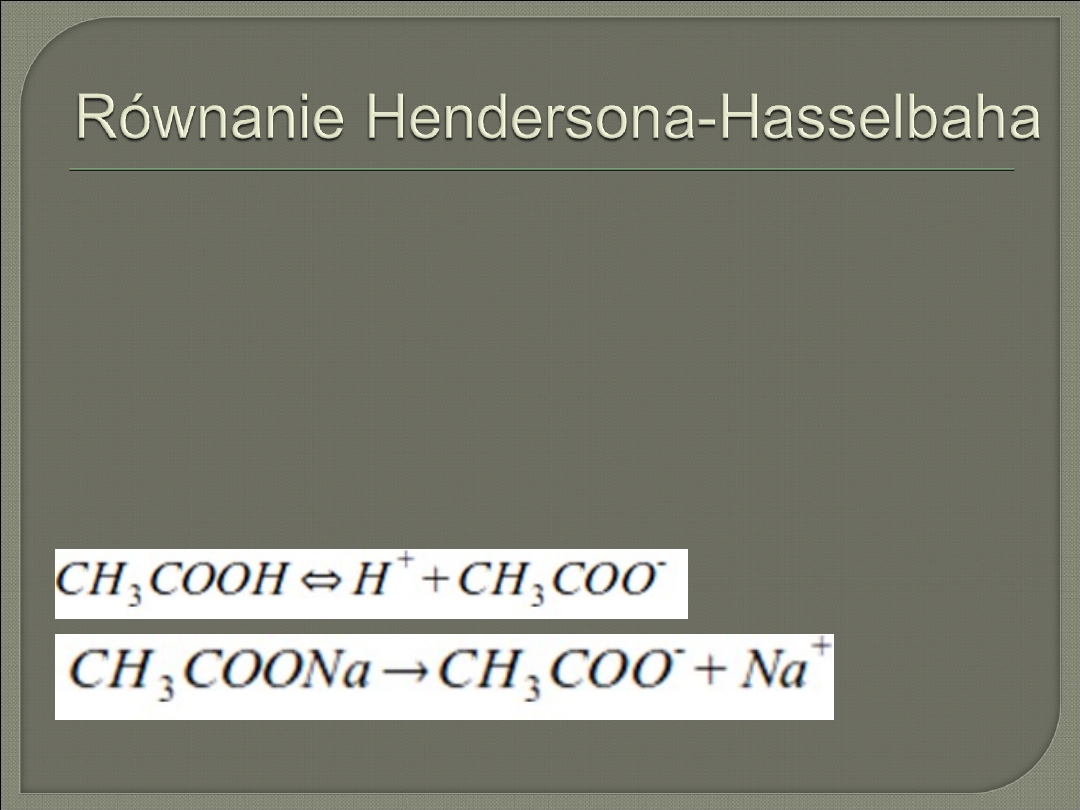
Równanie Hendersona-Hasselbacha
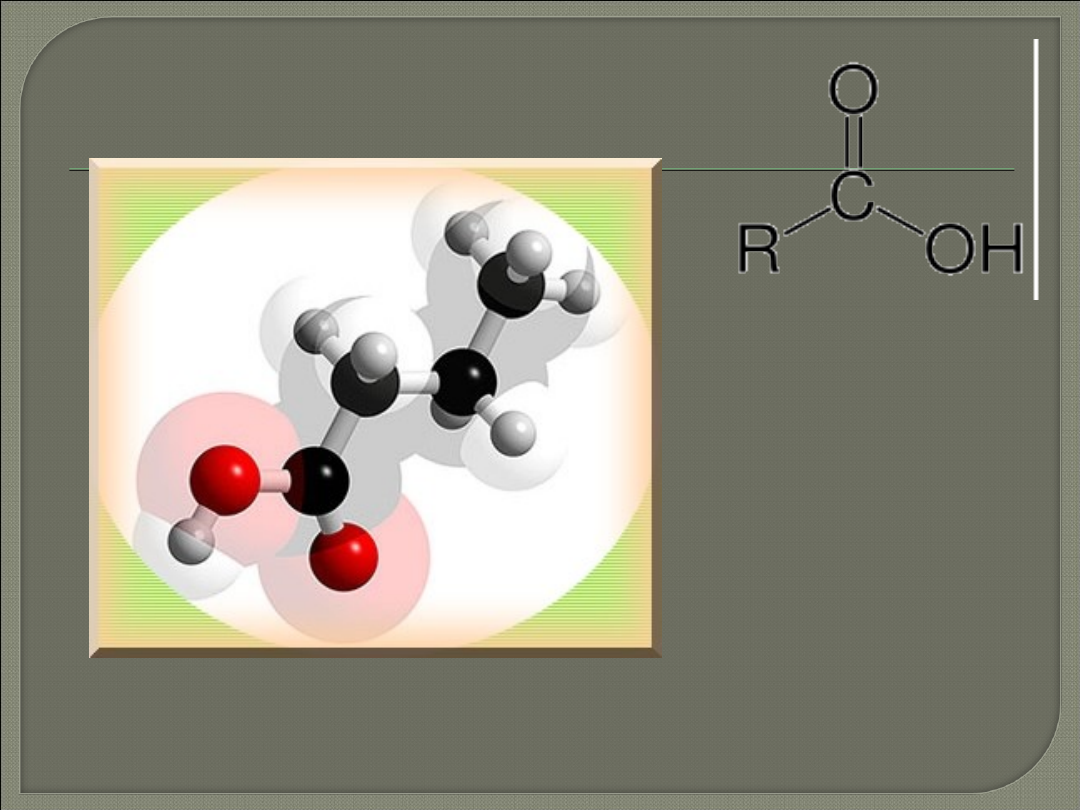

Kwas metanowy (mrówkowy)
– bezbarwna ciecz o
ostrym i duszącym zapachu oraz właściwościach
parzących, stężony powoduje poparzenia skóry,
opary podrażniają błony śluzowe, związek palny,
dobrze rozpuszczalny w wodzie
Kwas etanowy (octowy)
– bezbarwna ciecz o
przenikliwym zapachu, związek palny, dobrze
rozpuszczalny w wodzie (6% lub 10% roztwór wodny
to ocet), stężony w temp. 16,6
o
C krzepnie w kryształy
podobne do lodu (lodowaty kwas octowy)

•
Rozpuszczalność kwasów karboksylowych w wodzie
maleje wraz ze wzrostem liczby atomów C w cząsteczce
kwasu, kwasy metanowy, etanowy, propanowy i
butanowy rozpuszczają się
bez ograniczeń, od 5 do 8 at. C rozpuszczają się bardzo
słabo,
od 9 at. C są praktycznie nierozpuszczalne w wodzie.
•
Kwasy mają wysokie temp. topnienia i wrzenia (wyższe
niż woda), jest to skutek powstających wiązań
wodorowych
(efekt polarności wiązania w grupie karbonylowej = C =
O
i hydroksylowej – OH ) i asocjacji cząsteczek
O …. H – O
// \
CH
3
– C C – CH
3
…. wiązanie wodorowe
\ //
O – H ….O

•
Kolejne - do
9 atomów C
w cząsteczce -monokarboksylowe
kwasy karboksylowe są oleistymi, lepkimi cieczami
nierozpuszczalnymi
w wodzie, powyżej
9 atomów C
w cząsteczce są ciałami
stałymi, bezwonnymi i nierozpuszczalnymi w wodzie.
•
Wraz ze wzrostem liczby atomów C w cząsteczce
oddziaływanie polarnej grupy karboksylowej – tworzącej
wiązania wodorowe
z cząsteczkami wody - maleje, a wzrasta oddziaływanie
grupy węglowodorowej o niskiej polarności – nie mającej
zdolności tworzenia wiązań wodorowych.
•
Cząsteczka kwasu składa się z dwóch części: hydrofilowej
(lubiącej wodę) – grupa karboksylowa i grupy hydrofobowej
– nielubiącej wody – grupy węglowodorowej (R - , Ar -).
•
CH
3
– CH
2
– CH
2
– CH
2
– CH
2
– COOH
•
grupa hydrofobowa
grupa hydrofilowa
•
O zdolności rozpuszczalności związków organicznych w wodzie
decyduje stosunek wielkości gr.
hydrofobowej do gr.
hydrofilowej.
H
RCOO
RCOOH
Ilościowa miara „siły działania” kwasu.
pK
a
= - log[K
a
]
Im pK
a
jest mniejsze, tym moc kwasu jest większa
Moc kwasu określa m.in zdolność do wypierania reszty
kwasowej z soli w roztworach, a dokładnie decyduje o
tym, w którą stronę jest przesunięta równowaga
reakcji kwasu z daną solą. Kwas o większej mocy w reakcji
z daną solą wypiera spontanicznie resztę kwasową
pochodzącą ze słabszego kwasu, w wyniku czego
powstaje słabszy kwas i sól mocnego kwasu. Reakcje w
drugą stronę - tj. słabszego kwasu z solą mocniejszego
kwasu też mogą zachodzić, ale ich równowaga jest silnie
przesunięta w stronę substratów.

Wiąże wartość pH z mocą kwasu pK
A
Jest ono przydatne do:
Oszacowania pH buforu
Odnajdywanie pH równowagi reakcji
chemicznej
Obliczanie punktu izoelektrycznego białek

Roztworem buforowym
(buforem,moderatorem) jest złożony roztwór, który
praktycznie nie zmienia wartości swojego pH po
dodaniu do niego niewielkiej ilości silnego kwasu
lub zasady (a także po rozcieńczeniu). Własność tę
posiadają roztwory słabych kwasów i ich soli z
mocnymi zasadami lub słabych zasad i ich soli z
mocnymi kwasami oraz dwóch różnych soli.
pH buforu octanowego
Bufor octanowy jest przykładem buforu o pH mniejszym od 7,
a więc jest buforem kwasowym. Roztwór taki składa się ze
słabego kwasu i soli tego kwasu z mocnym wodorotlenkiem;
w przypadku buforu octanowego jest to oczywiście kwas
octowy CH
3
COOH oraz jego sól sodowa - octan sodu
CH
3
COONa.
W takim roztworze zachodzą 2 reakcje :

Warto zauważyć, że sól dysocjuje całkowicie(czyli
cała ilość octanu sodu rozpada się na jony),
natomiast kwas tylko w niewielkim stopniu. Stan
taki pozwala opisać dysocjację kwasu octowego
stałą dysocjacji kwasowej Ka oraz przyjąć kilka
koniecznych uproszczeń:

Jako, że sól dysocjuje całkowicie, a kwas tylko w niewielkim stopniu
można bez większego błędu zaniedbać ilość jonów octanowych
pochodzących z dysocjacji kwasu i przyjąć, że ich równowagowe
stężenie jest równe stężeniu octanu sodu. Podobnie jest w
przypadku stężenia równowagowego kwasu, gdyż duża ilość
powstałych w wyniku dysocjacji soli jonów octanowych cofa
praktycznie całkowicie dysocjację kwasu, dlatego można przyjąć,
że jest ono równe stężeniu początkowemu.
Powyższe przybliżenia podstawiamy do równania stałej dysocjacji:

Otrzymaną zależność przekształcamy wyciągając stężenie
równowagowe kationów wodorowych, następnie obie strony
logarytmujemy ujemnym logarytmem dziesiętnym. Ujemny
logarytm dziesiętny ze stałej dysocjacji jest nazywany
wykładnikiem stałej dysocjacji i oznaczany jako pKa (moc kwasu).
Ostatecznie otrzymujemy zależność określającą pH buforu
octanowego(równania Hendersona-Hasselbalcha da tegoż buforu).


Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
Właściwości i zastosowanie kwasów karboksylowych
REAKCJE ALIFATYCZNYCH NASYCONUCH KWASÓW KARBOKSYLOWYCH
kawsy i mydła - chemia, Właściwości kwasów karboksylowych o rodniku alifatycznym
15 Pochodne kwasów karboksylowych (08 11 2011)
kwasy i pochodne Synteza pochodnych kwasów karboksylowych – estrów
sprawozdanie 3, Właściwości białek i kwasów nukleinowych
otrzymywanie i reakcje kwasow karboksylowych
Estry i tłuszcze, ESTRY KWASÓW KARBOKSYLOWYCH
wyk 10 pochodne kwasów karboksylowych
pochodne kwasów karboksylowych
16 Pochodne kwasów karboksylowych
16 Pochodne kwasow karboksylowych materiały dodatkowe
17 Estry kwasow karboksylowych
ściąga z kwasów karboksylowych
amidy kwasow karboksylowych
tabelka pochodne kwasow karboksylowych, farmacja cm umk, Farmacja III rok, chemia leków
Właściwosci tlenków kwasowych i zasadowych, Liceum, testy
Właściwości i zastosowanie kwasów
więcej podobnych podstron