
Fizyka Ciała Stałego
Ć
wiczenie Nr 7
BADANIE PRZEJŚCIA ZOL-ŻEL DLA
ROZTWORÓW WODNYCH ŻELATYNY

2

3
1
.
Cel ćwiczenia
1.
Poznanie procesów: przejścia zol-żel i przejścia żel-zol.
2.
Poznanie własności żelu.
3.
Poznanie słabych wiązań, odpowiedzialnych za tworzenie się żelu.
4.
Badanie wpływu udziału procentowego składników na właściwości żelu powstającego z
roztworów wodnych materiałów biologicznego pochodzenia.
5.
Wykonanie badania temperatury przejścia żel-zol dla kilku próbek o różnych udziałach
procentowych żelatyny w wodzie.
2. Wprowadzenie
Pojecie żelu przypisuje się ogromnej grupie roztworów syntetycznych lub naturalnych polimerów i
zawiesin koloidalnych, które w pewnych warunkach posiadają cechy sztywności charakterystyczne dla
ciała stałego.
Struktura żelu może być osiągnięta poprzez procesy chemiczne i fizyczne. Wśród mechanizmów
ż
elowania opartych na procesach chemicznych należy wymienić reakcje chemiczne jak kopolimeryzacja,
wulkanizacja, polikondensacja, które prowadzą do rozgałęzionej sieci liniowego polimeru i są najczęściej
domeną polimerów syntetycznych. Do procesów fizycznych żelowania można zaliczyć te, w których
pewne punkty różnych łańcuchów polimerów ulegają asocjacji lub zapętleniu, co prowadzi do powstania
sieci żelu. Częściowa krystalizacja liniowego łańcucha albo konformacyjne przejście typu kłębek-helisa
powoduje powstawanie termicznie odwracalnych żeli, tzn. żelowanie zachodzi pod wpływem fizycznych
oddziaływań, Rysunek 1b i 1d. Tego typu sieci żelujące tworzą polimery biologiczne, jak żelatyn i agar.
Obydwa te biopolimery tworzą żel w roztworach wodnych przy obniżeniu temperatury. Jonowe
kompleksy są innymi przykładami mechanizmu żelowania spotykanymi w przyrodzie; na przykład
ż
elowanie pektyn w obecności wapnia które tworzą charakterystyczne struktury tzw. „egg-box”, rysunek
1c. Koloidalne żele są tworzone przez sferyczne cząsteczki tworzące aglomeraty w procesie hydrolizy i
kondensacji, jakie zachodzą np. w mleku lub w mikroemulsjach. Niektóre syntetyczne polimery jak
polietylen, polistyren, polialkohol winylowy, poliakrylonitryl, polichlorek winylu tworzą żele w
selektywnie dobranych rozpuszczalnikach poprzez szybkie schłodzenie poniżej temperatury krystalizacji,
zachowując potem trwałość także w podwyższonej temperaturze. Trzeba także wymienić żele kruche, w
których sieć przestrzenna jest utworzona z fazy stałej o znacznej sztywności jak np. silikażel, utworzony z
uwodnionych cząsteczek SiO
2
lub SnO
2
czy Fe
2
O
2
. Rysunek 1 przedstawia schematycznie niektóre
struktury sieci powstające w procesie żelowania.
Rys. 1. Nanocząsteczkowe struktury żeli:
a) struktura sieci rybackiej (najczęściej żele
chemiczne),
b) potrójna helisa żelatyny,
c) struktury pektyn w obecności jonów wapnia
(ang. egg-box), podwójne helisy żelu agaru,
e) struktura wysokocząsteczkowego polietylenu
(ang. Shish-kebab).

4
Nie ma ograniczenia, jeśli chodzi o liczbę układów, które można otrzymać w postaci żelu.
Konsystencja żelu jest często spotykana w wielu dziedzinach przemysłu, jak technologia żywności,
farmaceutyka i kosmetyka, ale także w procesie powlekania papierów czy farb.
Własności żelu tzw. fizycznego wynikają z istnienia sieci przestrzennej zbudowanej z
makrocząsteczek polimeru, o strukturze utrwalonej przez oddziaływania z rozpuszczalnikiem. Strukturę
tą można porównać do sieci rybackiej, gdy komórki tej sieci wypełnia druga faza (rozpuszczalnik). Żel
powstaje w odpowiednich warunkach (temperatura, pH) z zolu tj. z roztworu polimeru poprzez
koagulację prowadzącą do związania cząsteczek dużą liczbą słabych wiązań (wiązań wodorowych) z
utworzeniem ciągłej struktury sieciowej. Warunki dla tworzenia się żelu i cechy tych materiałów można
ująć w następujących punktach:
- żele są tworzone przez oddziaływujące ze sobą substancje z których jedna, faza stała, jest
rozpuszczalna lub zdyspergowana w fazie ciekłej,
- obydwa składniki żelu, faza ciekła i stała, tworzą układ ciągłej sieci,
- sieć przestrzenna żelu posiada pewne cechy ciała stałego i jest elastyczna w pewnym zakresie
naprężeń,
- sieć przestrzenna żelu tworzy się dzięki istnieniu słabych oddziaływań jak wiązania wodorowe
oraz
van der Wasala,
- żele tzw. fizyczne istnieją w pewnej temperaturze odwracalnie.
Teoria tworzenia żeli opiera się na efekcie tworzenia się pewnej liczby wiązań w elastycznym
układzie jak to przedstawia teoria perkolacji.
Chemik bardzo często spotyka w swej praktyce zawodowej układy nieuporządkowane(chaos,
nieporządek częściej spotykamy w przyrodzie niż układy uporządkowane). Np. ciała amorficzne stanowią
naturalny układ, w którym w bardzo obficie występują niesforne geometrie. Teoria perkolacji mówi o
przepływie cechy w obrębie pewnej populacji elementów, gdzie istotnym jest stężenie elementów o
charakterystycznej cesze. Teoria ta zajmuje się efektem zmiennego zakresu wzajemnych oddziaływań w
układach nieuporządkowanych. Z fizycznego punktu widzenia, najbardziej pociągającym aspektem jest
istnienie ostrego przejścia fazowego, w wyniku którego nagle pojawiają się oddziaływania
dalekozasięgowe. To przejście fazowe nazywa się progiem perkolacji tj. progowe stężenie składnika,
powyżej którego tworzy się żel, a poniżej którego stężenie składnika jest niewystarczające do utworzenia
ciągłej sieci. Teoria ta daje się zastosować do opisu bardzo szerokiego kręgu zjawisk fizycznych.
Przykłady są zawarte w Tabeli 1.
5
Tabela 1. Zastosowanie teorii perkolacji
Zjawisko fizyczne albo układ
Przejście
Ż
elowanie polimerów, wulkanizacja
ciecz - żel
Przepływ cieczy w ośrodku porowatym
lokalne - rozciągłe przenikanie wody
Rozprzestrzenianie się choroby w populacji
ograniczona zachorowalność - epidemia
Komunikacja lub sieć oporników
niepołączone - połączone
Kompozyty materiałów przewodzących i
izolacyjnych
izolator - metal
Kompozyty metalu i nadprzewodnika
normalny - nadprzewodzący
Nieciągłe cienkie warstwy metaliczne
izolator - metal
Powstawanie gwiazd w galaktykach spiralnych
nierozprzestrzeniane się - rozprzestrzenianie się
Kwarki w materii jądrowej
zawarte w nukleonach - uwolnione
Cienkie warstwy ciekłego helu na powierzchni
normalny - nadciekły
Rozproszone atomy metalu w izolatorze
izolator - metal
Rozcieńczone magnetyki
paramagnetyzm - ferromagnetyzm
Krawędź ruchliwości w półprzewodnikach
amorficznych
stany zlokalizowane - stany rozciągłe
Przeskoki o zmiennym zasięgu w
półprzewodnikach amorficznych
analogia do sieci oporników
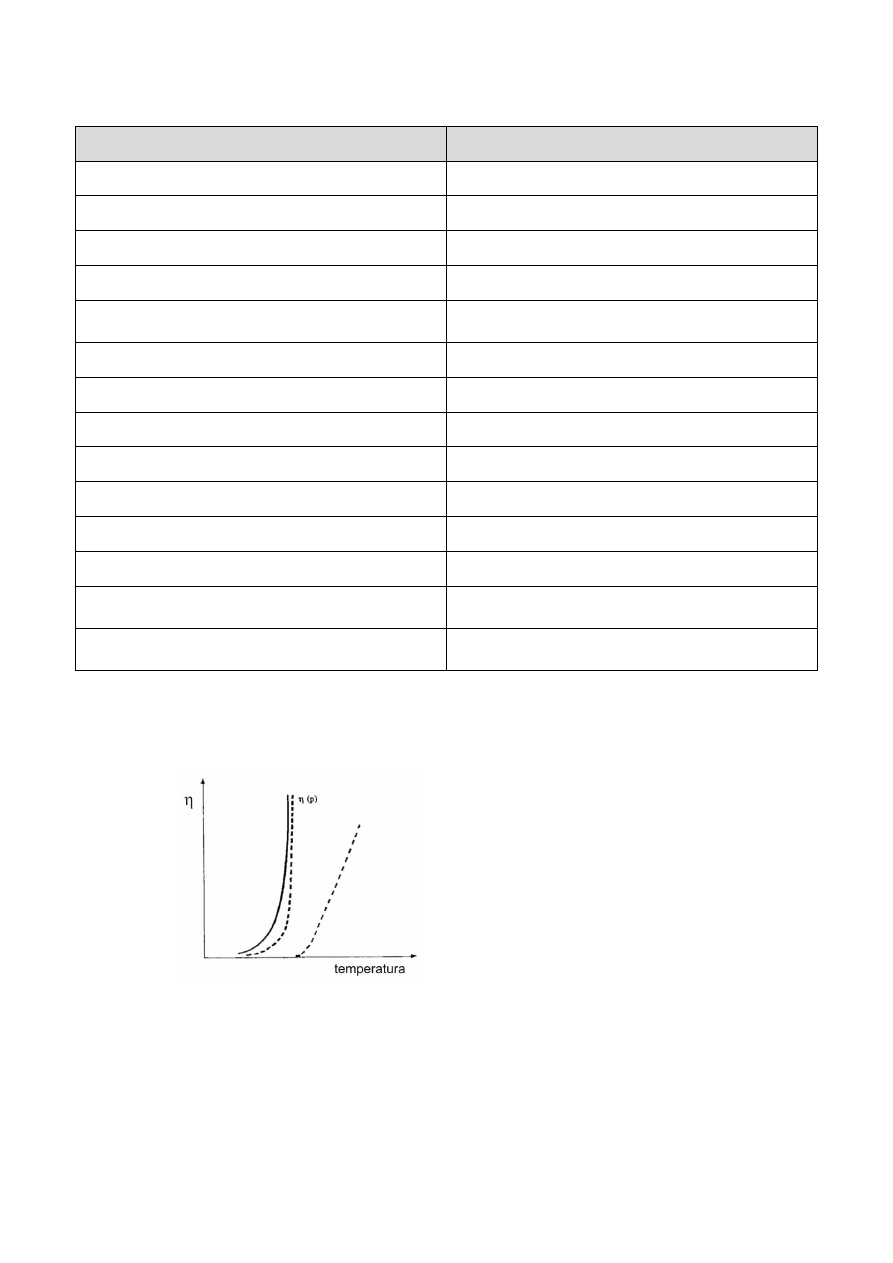
Własności żelu (tzw. sztywność) zależą od temperatury oraz udziału składników mieszaniny, co
najlepiej przedstawia nam krzywa przejścia zol żel na Rysunku 2.
Rys. 2. Krzywe przejścia zolu w żel. Zmiany
lepkości z temperaturą.
W przypadku żelu termicznie odwracalnego krzywe przejścia zol-żel i żel-zol się pokrywają, albo
są nieznacznie przesunięte względem siebie. Przesunięcie takie zależy od szybkości ogrzewania.
Naszym zadaniem jest wykonanie badań przejścia żel-zol dla roztworów wodnych żelatyny.
Ż
elowanie zolu żelatyny zachodzi w temperaturze bliskiej pokojowej w stosunkowo krótkim czasie.
Podwyższanie temperatury powstałego żelu powoduje rozerwania słabych wiązań wodorowych i
przejście żelu w zol. Żel, po dostarczeniu odpowiedniej energii cieplnej, przechodzi samorzutnie w stan
zolu, stan ciekły. Do zbadania tego procesu posłuży nam obserwacja zmiany położenie kulki na

6
powierzchni płytki żelu. Na płytce żelu kulka zachowuje się jak na powierzchni ciała sztywnego. Podczas
ogrzewania żelu, gdy próbka przechodzi w stan zolu, kulka tonie w cieczy.
3. Wykonanie pomiarów
Do oceny stopnia żelowania zastosujemy metodę obserwacji kulki stalowej położonej na
powierzchni próbki żelu, która jest umieszczona na ogrzewanym stoliku. Obserwacja położonej kulki z
użyciem pomiarowego układu optycznego/katetometru pozwoli nam ustalić temperaturę, w której kulka
zacznie się zagłębiać w materiale-żelu. Będzie to oznaczało, że obecna w żelu sieć wiązań wodorowych
polimer-polimer, polimer-woda uległa zniszczeniu pod wpływem dostarczonej energii cieplnej.
Temperatura, w której zaobserwujemy opadanie kulki w materiale jest temperaturą przejścia żel-zol.
1) Przygotowanie roztworów żelatyny,
1.
przygotować naważki żelatyny o stężeniach: 5, 10, 20 % wagowych,
2.
rozpuścić żelatynę w wodzie do postaci klarownego roztworu, podgrzewając.
2) Przygotowanie żeli,
1.
wodne roztwory żelatyny schłodzić w lodówce w ciągu 30 minut.
3) Przygotować grzejnik do wygrzewania żeli.
4) Przygotować lunetę do obserwacji powierzchni żelu i położenia kulki stalowej.
5) Wyznaczyć temperaturę przejścia żel-zol.
1.
Ustawić poziomą linię w lunecie jako styczną do powierzchni kulki znajdującej się na
powierzchni płytki żelu.
2.
Przygotować miernik temperatury i zanurzyć końcówkę termopary w żelu.
3.
Włączyć ogrzewanie i obserwować zmiany położenia krzywizny kulki za pomocą katetometru.
4.
Zapisujemy w Tabeli położenie stycznej do krzywizny kulki i odpowiednio temperaturę.
5.
Wykonujemy obserwacje aż do zanurzenia się kulki w materiale.
UWAGA: w niektórych przypadkach przy wyższych stężeniach polimeru, możemy obserwować
początkowo odwrotne efekty zmiany położenia kulki; kulka podnosi się do góry. Rejestrujemy zmiany od
początku opadania kulki.
6.
Schłodzić grzejnik.
7.
Następnie powtórzyć czynności pomiarowe dla pozostałych próbek żeli.
8.
Roztwory żelatyny schłodzić ponownie i powtórzyć cykl pomiarów.
4. Opracowanie wyników
1.
Wykonać wykresy zależności położenia krzywizny kulki (jednostki umowne) w funkcji
temperatury.
2.
Wykreślić dwie styczne do krzywej i wyznaczyć temperaturę przejścia żel-zol jako punkt
przecięcia stycznych.
3.
Wyznaczyć temperaturę przejścia żel-zol dla wszystkich próbek.
4.
Wykonać wykres zależności temperatury przejścia żel-zol od składu procentowego składników.

7
Sprawozdanie powinno zawierać
1.
Opis stanu roztworów wodnych żelatyny po schłodzeniu dla kolejnych próbek.
2.
Opis zmian, jakie zaobserwowano podczas ogrzewania próbek żelu.
3.
Wykresy zależności położenia krzywizny kulki w funkcji temperatury z wykreślonymi
stycznymi i zaznaczoną temperaturą przejścia żel-zol.
4.
Wartości temperatur przejścia żel-zol.
5.
Wykres zależności temperatury przejścia żel-zol od składu procentowego składników.
6.
Dyskusję wyników z omówieniem odwracalności procesu żelowania roztworów żelatyny.
7.
Dyskusję błędów, jakimi mogą być obarczone wyniki.
Polecana literatura:
1.
S. Minc, L. Stokarczyk, Elementy Fizykochemii koloidów, PWN W-wa 1956,
2.
Scheludko, Chemia Koloidów, WNT W-wa 1969,
3.
Basiński, Zarys Fizykochemii koloidów, PWN W-wa 1975
Wyszukiwarka
Podobne podstrony:
fcs lab 5 id 169065 Nieznany
fcs lab 4 id 169064 Nieznany
fcs lab 9 id 169068 Nieznany
PO lab 5 id 364195 Nieznany
lab [5] id 258102 Nieznany
lab [1] id 258099 Nieznany
chemia fizyczna lab id 112228 Nieznany
Lab 4 id 257946 Nieznany
Lab 1 id 257555 Nieznany
Bsi 08 lab id 93519 Nieznany
lab(2) id 258733 Nieznany
lab 3 2 id 259509 Nieznany
lab [3] id 258100 Nieznany
LAB 9 id 258268 Nieznany
Arduino Lab 1 id 68202 Nieznany
Pr 1st 1 1 m01 lab id 382178 Nieznany
ModSym lab id 305590 Nieznany
Lab 8 id 258226 Nieznany
Lab 3 3 id 259511 Nieznany
więcej podobnych podstron