
Pułapkowanie spinowe tlenku azotu
Przygotowanie do ćwiczenia:
Fizyczne podstawy elektronowego rezonansu paramagnetycznego (ERP). Parametry
widma ERP. Oddziaływanie nadsubtelne (3,4).
Wstęp
W niektórych sytuacjach detekcja paramagnetyków metodą ERP jest niemożliwa.
Powodem może być duża reaktywność danego związku (krótki czas życia) albo
poszerzenie sygnału (krótkie czasy relaksacji). W tego typu przypadkach często
stosuje się technikę pułapkowania spinowego. Polega ona na obserwacji widma ERP
tzw. adduktu spinowego, który powstaje w reakcji badanej cząsteczki paramagnetycznej
z pułapką spinową. Pułapką spinową może być dowolna substancja egzo- lub
endogenna zdolna do tego typu reakcji. Addukty spinowe cechują się:
*
charakterystycznym i łatwym w detekcji sygnałem ERP
*
dużą stabilnością w porównaniu z substancją pułapkowaną
W układach biologicznych najczęstszymi substancjami badanymi z wykorzystaniem
pułapkowania spinowego są wolne rodniki, a zwłaszcza anionorodnik ponadtlenkowy
i tlenek azotu (1).
Tlenek azotu stał sie w ostatnich latach przedmiotem zainteresowania przedstawicieli
różnych dyscyplin naukowych. Wiązało się to m.in. z odkryciem, że NO pełni istotną
rolę w utrzymaniu homeostazy układu krążenia, w przewodnictwie nerwowym oraz
w niespecyficznej odpowiedzi obronnej organizmu (2, 5, 10).
NO jest w normalnych warunkach paramagnetycznym gazem, dlatego może być
mierzony za pomocą techniki ERP. Niestety, sygnał wolnego NO widoczny jest tylko
w przypadku pomiaru próbek gazowych. W roztworach wodnych sygnał ulega
znacznemu poszerzeniu i w możliwych do uzyskania stężeniach, a tym bardziej niskich
stężeniach fizjologicznych, jest niewykrywalny. Większość opracowanych metod
polega na obserwacji specyficznych połączeń NO z różnymi pułapkami spinowymi,
zarówno endogennymi (np. hemoglobina, żelazo niehemowe), jak i egzogennymi (np.
DETC - diethyldithiocarbamate, sól sodowa kwasu dietyloditiokarbamowego) (5).
Podczas systematycznych badań (z wykorzystaniem spektroskopii ERP) tkanek
prawidłowych i nowotworowych w temperaturze ciekłego azotu uzyskano bardzo
charakterystyczne sygnały, które określono jako ''sygnały trypletowe'' (sygnały

składające się z trzech linii struktury nadsubtelnej, wynikajacej z oddziaływania
niesparowanych elektronów z jądrami azotu
14
N (I=1); tym mianem określa się
potocznie sygnały nitrozohemoprotein). Interpretacja genezy tych sygnałów przez długie
lata była dość ogólnikowa. W każdym razie nie dopatrywano się żadnego związku
pomiędzy sygnałami trypletowymi, a funkcjonowaniem układu odpornościowego.
Sytuacja ta zmieniła się w latach 80-tych, gdy okazało się, że cytotoksycznie
aktywowane makrofagi produkują tlenek azotu (5, 9).
Analiza struktury widma ERP białek hemowych (5, 8)
Badania nad tym zagadnieniem pomogły w rozszyfrowaniu natury chemicznej
związków, które mogą być źródłem sygnałów trypletowych. Przede wszystkim
wykazano, że 3 linie widma ERP jakie pojawiają się po zmieszaniu hemoglobiny
z tlenkiem azotu nie stanowią niezależnych sygnałów singletowych, lecz są trzema
składnikami struktury nadsubtelnej tego samego sygnału ERP. Następnie udowodniono,
że przesunięcie wartości g (współczynnika spektroskopowego rozszczepienia,
charakteryzującego oddziaływanie centrów paramagnetycznych danego typu
z zewnętrznym polem magnetycznym) względem g wolnorodnikowego, spowodowane
jest lokalizacją elektronu w sąsiedztwie ciężkiego jądra, które zidentyfikowano jako
żelazo
57
Fe. Tak więc, źródłem omawianego sygnału ERP jest kompleks tlenku azotu
z hemoglobiną, przy czym tlenek skompleksowany jest z żelazem w szóstej pozycji
koordynacyjnej, tam gdzie zwykle obecny jest tlen lub cząsteczka wody (rys.1). W tym
układzie niesparowany elektron, pochodzący od cząsteczki NO, zlokalizowany jest na
orbitalu wewnętrznej powłoki jonu dwuwartościowego żelaza hemowego.
Nitrozohemoglobina, czyli hemoglobina ze skompleksowanym tlenkiem azotu, zrobiła
karierę jako model w badaniach nad oddziaływaniem białek hemowych z ligandami,
a zwłaszcza tlenem i tlenkiem węgla. Okazało się, że kompleks Hb-NO jest około 1000
razy trwalszy niż z Hb-CO, a 500 000 razy trwalszy, niż Hb-O
2
(10).
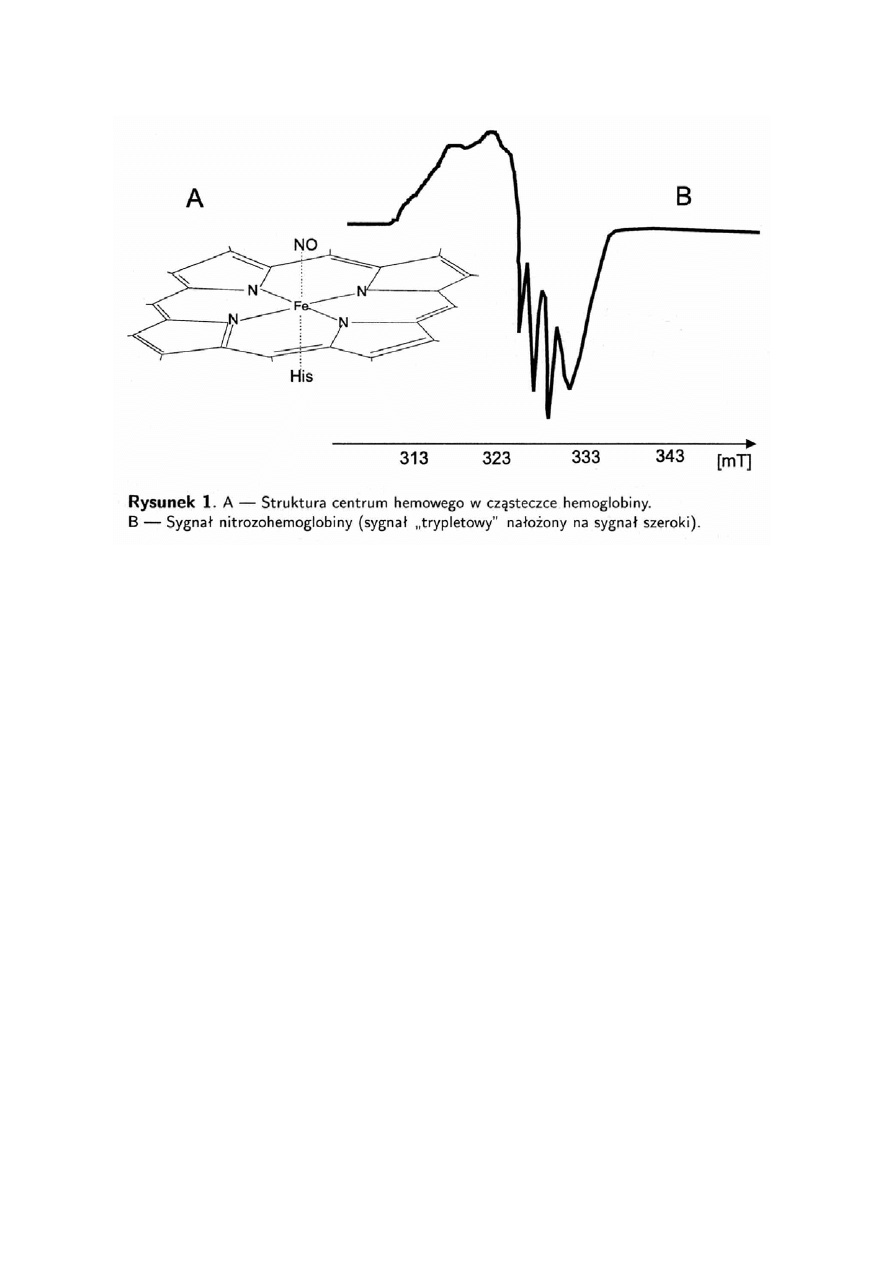
Kompleksy NO z hemoproteinami (nitrozylohemowe) występują w formie
sześciokoordynacyjnej, której odpowiada szeroki sygnał ERP oraz
pięciokoordynacyjnej, dającej sygnał trypletowy. ''Tryplet'' pojawia się jako efekt
zwiększenia prawdopodobieństwa lokalizacji elektronu na azocie, gdy białkowa część
cząsteczki jest zmodyfikowana np.przez: dehydratację cząsteczki, siarczan dodecydu
sodu lub sześciofosforan inozytolu (IHP). Jest wysoce prawdopodobne, że czynniki
modyfikujące kompleks Hb-NO zaburzają system His-Fe-NO wywołując zmiany
w konformacji cząsteczki białkowej- stwierdzono to dla sześciofosforanu inozytolu. IHP
powoduje rozerwanie wiązania między atomem żelaza układu hemowego i histydyną
łańcucha peptydowego. Według innej teorii sygnał z trzema liniami rozszczepienia
nadsubtelnego pochodzi od zniekształconego kompleksu sześciokoordynacyjnego,
w którym wiązanie Fe-His nie jest rozerwane ale znacznie wydłużone.
Badania nitrozowanych podjednostek α i β hemoglobiny oraz wpływu IHP na ich
strukturę wykazały, że jedynie kompleksy NO z hemem łańcucha α mogą wykazywać
trzy linie struktury nadsubtelnej.
Ponadto modelowe badania kompleksów nitrozohemoglobiny wykazały, że stałe
asocjacji NO z podjednostkami α i β są jednakowe, natomiast różnice dotyczą stałych
dysocjacji.
Na ustalanie się równowagi w kompleksach nitrozohemoglobiny w wyniku
przemieszczania się NO między podjednostkami α i β wpływa także pH.
Przemieszczanie się ligandu następuje przy pH wynoszącym około 6, przy pH >8
proces ten nie zachodzi.
Bardzo istotnym czynnikiem wpływającym na stosunek kompleksów
pięciokoordynacyjnych, którym odpowiada sygnał trypletowy, do
sześciokoordynacyjnych (sygnał szeroki) jest wysycenie hemoglobiny tlenkiem azotu
(hemoglobina jest wysycona tlenkiem azotu gdy wszystkie jej podjednostki wiążą NO).
Zmniejszeniu sygnału trypletowego towarzyszy nasilenie sygnału szerokiego wraz ze
zwiększaniem się wysycenia hemoglobiny tlenkiem azotu.
Struktura widma ERP żelaza niehemowego w układach biologicznych (5, 6, 8)
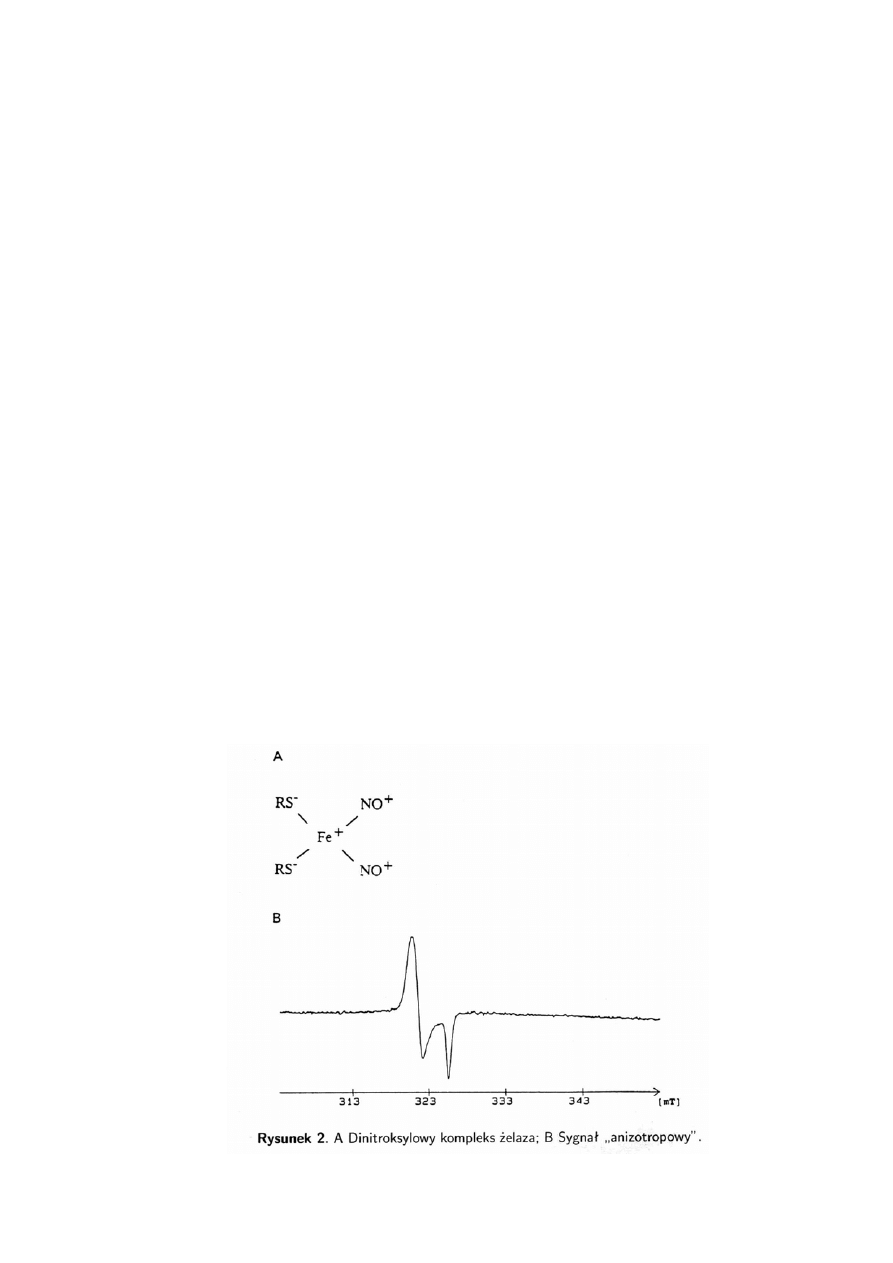
W widmach ERP kompleksów NO z żelazem niehemowym obserwujemy sygnał
anizotropowy. Przeprowadzono również w tym przypadku liczne obserwacje tego
sygnału w tkankach nowotworowych i zdrowych organach oraz analizę jego cech.
W przypadku kompleksu z żelazem niehemowym oddziaływanie jonu centralnego jest
tak silne, że niesparowany elektron przesuwa się całkowicie w jego obręb, całość
uzyskuje charakter jonu paramagnetycznego, a sygnał takiego kompleksu nie posiada
w ogóle struktury nadsubtelnej. Badania te doprowadziły do stwierdzenia, że centrami
paramagnetycznymi odpowiedzialnymi za wspomniany sygnał anizotropowy są
dinitroksylowe kompleksy żelaza (DNIC) z endogennymi ligandami zawierającymi grupy
SH. Tlenek azotu związany z żelazem występuje w postaci jonu nitrozoniowego (NO
+
)
(rys. 2).

Większość DNIC związana jest z grupami sulfhydrylowymi w białkach. W komórce
powstają także niskocząsteczkowe kompleksy DNIC z ligandami tiolowymi np. cysteiną,
jednak ich ilość jest bardzo mała w porównaniu z kompleksami białkowymi.
Problemem, który budzi znaczne kontrowersje, jest pochodzenie żelaza występującego
w DNIC. Według niektórych autorów pochodzi ono z białek żelazowo-siarkowych,
głównie z mitochondrialnego łańcucha przenośników elektronów. Białka te po
przyłączeniu NO ulegają inaktywacji.
Jednak inni badacze uważają, że w tworzeniu DNIC bierze udział głównie luźno
związane żelazo i grupy sulfhydrylowe różnych białek. Za tą drugą koncepcją
przemawia fakt, iż większość powstających w komórkach kompleksów DNIC nie jest
zlokalizowana w mitochondriach, lecz w cytozolu.
Na podstawie wiedzy jaką dysponujemy obecnie nie można jednoznacznie określić
charakteru żelazowych centrów wiążących NO w komórce. Nie ma całkowitej pewności,
czy obserwowane za pomocą spektroskopii ERP kompleksy nitrozylożelazowe
bezpośrednio wyrażaja wywołane przez NO uszkodzenia komórki. Mogą być jednak
dobrym jego wyznacznikiem.
Literatura
1.
"Spin Labeling. Theory and Applications" w Biological Magnetic Resonance, vol.
8, pod redakcją L.J. Berliner, J. Renben, Plenum, New York, NJ, 1989
2.
A. Dembińska-Kieć, "Biosynteza i fizjologiczna funkcja tlenku azotu",
w Molekularne mechanizmy przekazywania sygnałów w komórce, pod red. L.
Konarskiej, rozdział 10, str. 177-189, PWN, Warszawa, 1995
3.
Z. Kęcki, "Podstawy spektroskopii molekularnej", PWN, Warszawa 1992
4.
S.J. Łukiewicz, "Spektroskopia in vivo elektronowego rezonansu
paramagnetycznego w biologii i medycynie", w Problemy biocybernetyki
i inżynierii biomedycznej, pod red. M. Nałęcza, tom 2 Biopomiary, str.329-366,
Wydawnictwa Komunikacji i Łączności, Warszawa, 1990

5.
Nitric Oxide in Transplant Rejection and Anti-Tumor Defense, pod redakcją S.
Lukiewicz, J.L. Zweier, Kluwer Academic Publishers, Boston, MA, USA, 1998
6.
Nitric Oxide. Principles and Actions, J. Lancaster, Jr. (red.), Academic Press,
New York, NJ, USA, 1996
7.
M. Lomnicka, W.K. Subczynski, "Spin-label NO-metry", Curr. Top. Biophys., 21,
str.. 76-80, 1996
8.
B. Płonka, Monitorowanie generacji tlenku azotu przez makrofagi w funkcji stanu
układu odpornościowego i rodzaju gospodarza, Praca doktorska, UJ Kraków,
1998
9.
P. Płonka, Analiza mechanizmu interakcji pomiędzy nowotworem a organizmem
jego gospodarza metodą elektronowego rezonansu paramagnetycznego, Praca
doktorska, UJ Kraków, 1993
10.
G. Stochel, M. Pawelec, Z. Stasicka, "Wybrane aspekty chemii i biochemii tlenku
azotu", Wiadomości chemiczne, 51, str. 163-188, 1997
Wykonanie ćwiczenia
Ćwiczenie obejmuje:
I Pułapkowanie spinowe NO przez hemoglobinę;
II Pułapkowanie spinowe NO przez żelazo niehemowe;
III
Pułapkowanie spinowe NO w materiale biologicznym.
Przebieg ćwiczenia (wg 9):
1) Materiały
Odczynniki:
a.
50 mg hemoglobiny (Hb)
b.
10 mg chlorku żelaza (FeCl
2
* 4H
2
O)
c.
5 mg azotynu sodowego (NaNO
2
)
d.
200 mg ditionianu sodowego (Na
2
S
2
O
4
)
e.
50 ml PBS (phosphate buffered saline - zbuforowana sól fizjologiczna)
UWAGA !

Przed użyciem PBS należy przedmuchać azotem lub argonem przez 30 min
(w celu usunięcia tlenu)
Sprzęt laboratoryjny:
a.
cylinder o pojemności 50 ml (na PBS)
b.
pipeta pasteurowska (do przedmuchania PBS)
c.
4 szklane homogenizatory (małe)
d.
pipety z końcówkami jednorazowymi (0.1-1 ml, 1-5 ml)
e.
zamykane naczynka szklane o pojemności 1-5 ml (11-15 szt.)
f.
rurki ze szkła o podwyższonej wytrzymałości na różnice temperatur
o wymiarach: długość około 4 cm i wewnętrzna średnica 4mm
g.
parafilm
h.
zestaw narzędzi chirurgicznych
i.
kilka szalek Petriego
j.
ciekły azot
k.
termos z szerokim otworem do zamrażania próbek w ciekłym azocie
l.
kwarcowy Dewar palcowy do pomiarów ERP
Aparatura:
a.
spektrometr ERP pracujący w paśmie X
b.
waga laboratoryjna
Jako materiał nowotworowy mogą być użyte lite guzy białaczki limfatycznej L5178Y-R
rosnące u gospodarza syngenicznego, inbredowego (myszy DBA/2) i gospodarza
allogenicznego, outbredowego (myszy Swiss) ze względu na duże różnice
w intensywności sygnałów ERP. Standardowa technika uzyskiwania guzów tej białaczki
polega na wszczepieniu podskórnym 20 milionów komórek. Ćwiczenie należy
przeprowadzić w 11-tym dniu rozwoju choroby nowotworowej.
Inny możliwy do wykorzystania w tym ćwiczeniu nowotwór to mysia melanoma
Cloudman S91.
UWAGA!
Należy uzyskać zezwolenie na wykorzystanie zwierząt laboratoryjnych do celów
dydaktycznych (1 mysz DBA/2 i 1 mysz Swiss na grupę).
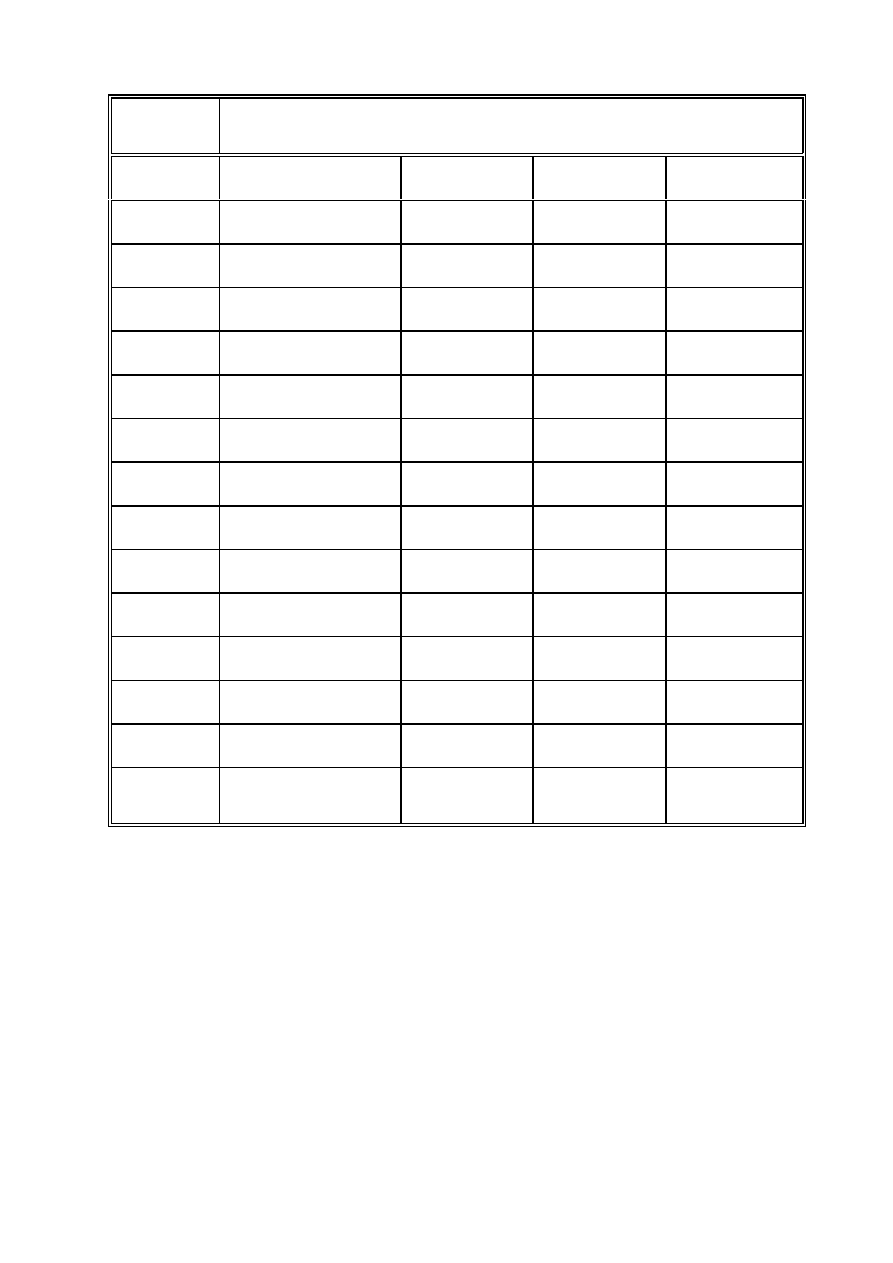
2) Przygotowanie próbek:
Nr próbki
Zawartość próbek
1
11 mg Hb
0.1ml pr.11
0.9 ml PBS
2
11 mg Hb
0.1ml pr.11
0.5 ml PBS
0.4 ml pr.14
3
11 mg Hb
0.1 ml pr.11
0.5 ml PBS
0.4 ml pr.15
4
2 mg FeCl
2
0.1 ml pr.11
0.9 ml PBS
5
2 mg FeCl
2
0.1 ml pr.11
0.5 ml PBS
0.4 ml pr.14
6
2 mg FeCl
2
0.1 ml pr.11
0.5 ml PBS
0.4 ml pr.15
7
homogenat guza*
0.1 ml pr.11
8
homogenat guza*
0.1 ml pr.11
0.4 ml pr.14
9
homogenat guza**
0.1 ml pr.11
10
homogenat guza**
0.1 ml pr.11
0.4 ml pr.14
11
118 mg Na
2
S
2
O
4
2 ml PBS
12
21 mg Na
2
S
2
O
4
5 ml PBS
13
3 mg NaNO
2
5 ml PBS
14
3 ml pr.13
2 ml pr.12
15
pr.14 (200 razy
rozcieńczona)
* guz pochodzący od gospodarza DBA/2,
** guz pochodzący od gospodarza Swiss
Kolejne czynności:
1.
ponumerować naczynka i szklane rurki (1-10)
2.
rurki zawinąć szczelnie z jednej strony parafilmem
3.
odważyć Hb, FeCl
2
oraz NaNO
2
i rozpuścić w PBS
4.
uśpić zwierzęta (przedawkowanie barbituranu albo asfyksja azotem)
5.
wyciąć guzy, odważyć po 800 mg na próbkę a następnie poddać je
homogenizacji (nie ma potrzeby przenoszenia homogenatu, homogenizatory
można wykorzystać jako naczynka 7-10)
UWAGA !
Na
2
S
2
O
4
odważyć bezpośrednio przed dodaniem PBS (aby się nie utlenił) i jak

najszybciej (pipetą) przenieść do odpowiednich naczynek
6.
118 mg Na
2
S
2
O
4
rozpuścić w 2 ml PBS, a następnie dodać po 0.1 ml do
próbek1-10 (redukcja próbek)
7.
21 mg Na
2
S
2
O
4
rozpuścić w 5 ml PBS i dodać 2 ml do pr. 14 (redukcja azotynu)
8.
rozcieńczyć pr. 14 (200 razy)
9.
dodać po 0.4 ml pr. 14 do naczynek 2, 5, 8, 10 oraz po 0.4 ml pr. 15 do
naczynek 3 i 6
Po przygotowaniu próbek (nr 1–10) 0.4 ml każdej z nich umieścić w osobnej szklanej
rurce, a następnie zamrozić w temperaturze 77 K (Uwaga! Należy ograniczyć do
minimum czas od przygotowania próbek w naczynkach do przeniesienia ich do rurek
i wreszcie zamrożenia).
Pomiary wykonać na spektrometrze ERP z użyciem kwarcowego Dewara palcowego
do badań w temperaturze ciekłego azotu.
Zarejestrować widma ERP próbek 1-10, przy parametrach: amplituda modulacji 0.5 mT
(w razie słabych sygnałów 1 mT), pole 328±25 mT, częstotliwość mikrofal 9.5 GHz, moc
20 mW.
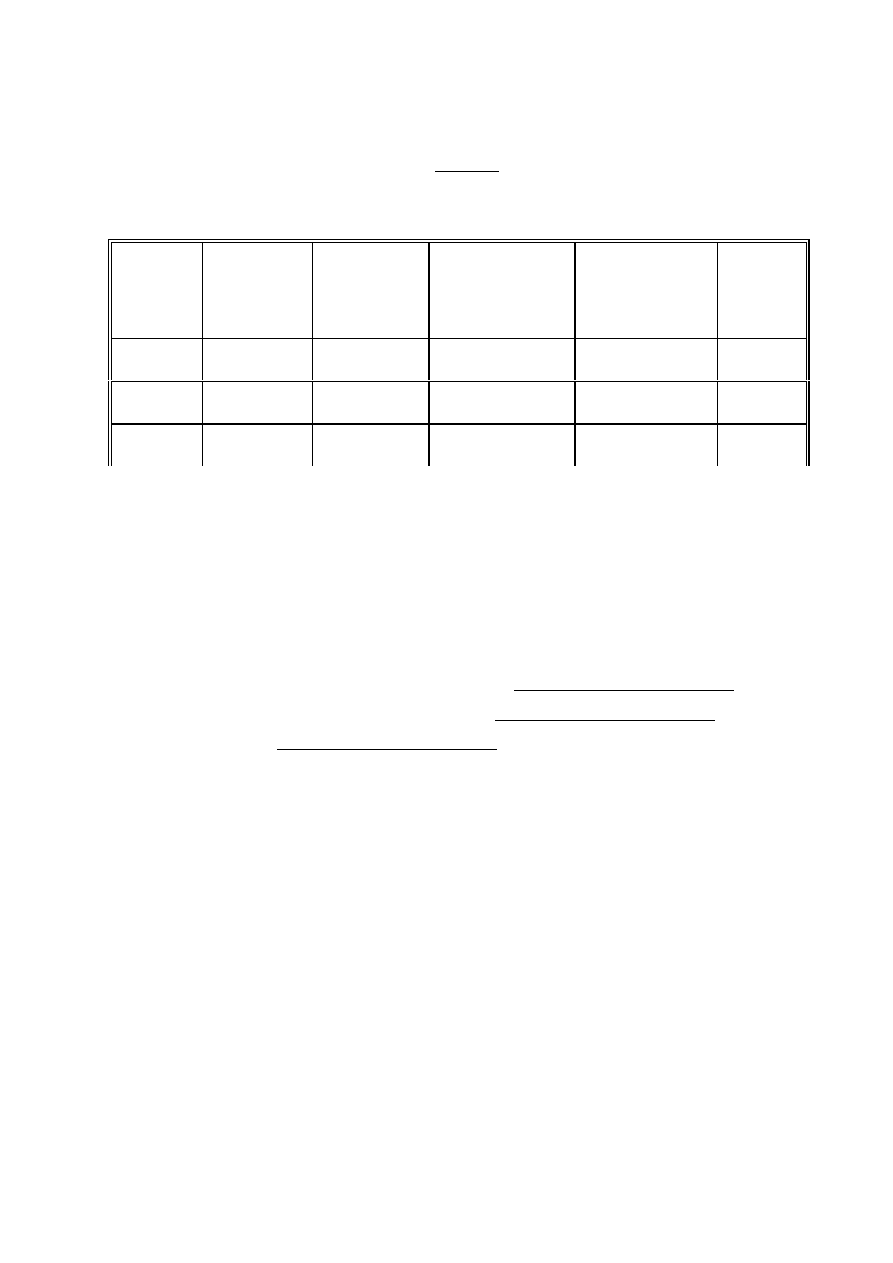
Opracowanie wyników:
A)
6 zmierzyć amplitudę sygnałów trypletowych (II linia struktury nadsubtelnej)
6 przeliczyć wszystkie amplitudy na to samo wzmocnienie
6 przedstawić w tabelce:
nr próbki
zawartość
próbki
sygnał
"trypletowy"
(+/-)
sygnał
"anizotropowy"
(+/-)
amplituda sygnału
"trypletowego"
przeliczona na to
samo wzmocnienie
UWAGI
B) Odpowiedzieć na pytania:
1. W jakim celu dodajemy dwutionian? Czy musimy go dokładnie odważyć?
2. Z czego wynikają różnice sygnału ERP kompleksów Hb i FeCl
2
z NO? Co można sądzić
na temat siły kompleksowania?
3. Z czego wynikają różnice pomiędzy sygnałami ERP z "nadmiarem" i "niedomiarem" NO?
4. Co można sądzić na temat natężenia produkcji NO w badanej tkance nowotworowej?
5. Jakie rodzaje pułapek spinowych NO występują w badanej tkance nowotworowej?
6. Czy ilość pułapek w badanej tkance nowotworowej jest nadmiarowa? Uzasadnij.
7. Które z badanych próbek pełnią rolę kontroli negatywnych, a które kontroli pozytywnych?
Wyszukiwarka
Podobne podstrony:
Schoeck Toccata op 29 No 2
29 Zdolność pracownicza
KOMPLEKSY POLAKOW wykl 29 03 2012
6 Wielki kryzys 29 33 NSL
2Ca 29 04 2015 WYCENA GARAŻU W KOSZTOWEJ
wyklad 29 i 30 tech bad
plik (29) ppt
4 JM02 JS05 24 29 złamania
2001 11 29
No Home, No Homeland raport
NO 04 A004 4 2010
więcej podobnych podstron