
Ewolucja modelu atomu
Twórcą atomistycznej teorii budowy materii był Demokryt z
Abdery, filozof grecki (przełom V i IV w. p.n.e.). Według Demokryta
atom to elementarna, niepodzielna cząstka materii („atomos” –
niepodzielny).
Swoją teorię opisał w dziele: "O małym porządku świata".
Model ten częściowo zmodyfikowany i rozszerzony w tzw. model
kinetyczno-molekularnej budowy materii wyjaśniał prawa gazowe
(m. in. Prawo Boyle’a i Mariotte’a, a także inne prawa gazowe
odkryte w XVII w).
Model ten przetrwał do XIX w.
"Nie istnieje nic oprócz atomów i
przestrzeni,
wszystko inne jest opinią"
- Demokryt z Abdery
Demokryt z Abdery (460 - 370 p.n.e.)

Joseph John Thompson badając przepływ prądu w rurze częściowo
opróżnionej z powietrza stwierdził, że atom musi mieć strukturę
złożoną, bo obojętne atomy gazu stają się w rurze (w polu
elektrycznym) nośnikami ładunku. Stąd wniosek, że atom dzieli się
na część naładowaną dodatnio (jon dodatni) i część naładowaną
ujemnie (elektron).
J.J. Thomson w 1896 r. odkrył elektron i zmierzył stosunek e/m dla
elektronu. Wyniki badań prowadziły do modyfikacji modelu atomu
jako cząstki niepodzielnej. Według Thomsona atom to kula ładunku
dodatniego, w której jak rodzynki w cieście rozmieszczone są
elektrony. Fizycy nazwali ten model „rodzynkowym”.
Joseph John Thompson
(1856-1940)
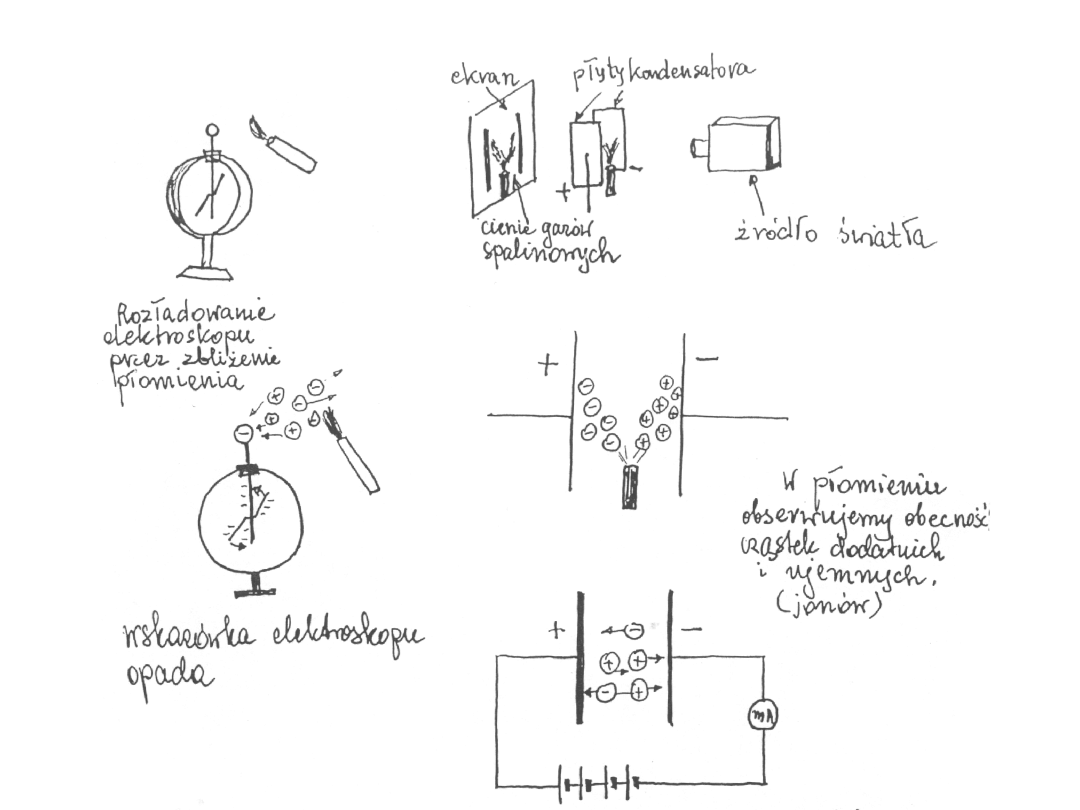
Prądy niesamoistne
Jeśli w obszarze między płytkami pojawi się czynnik jonizujący w obwodzie
płynie prąd. Po usunięciu czynnika jonizującego prąd przestaje płynąć. Prąd
ten nazywamy prądem niesamoistnym.
Można spowodować jonizację przy zderzeniach atomów neutralnych ze sobą
ogrzewając gaz do wysokiej temperatury.
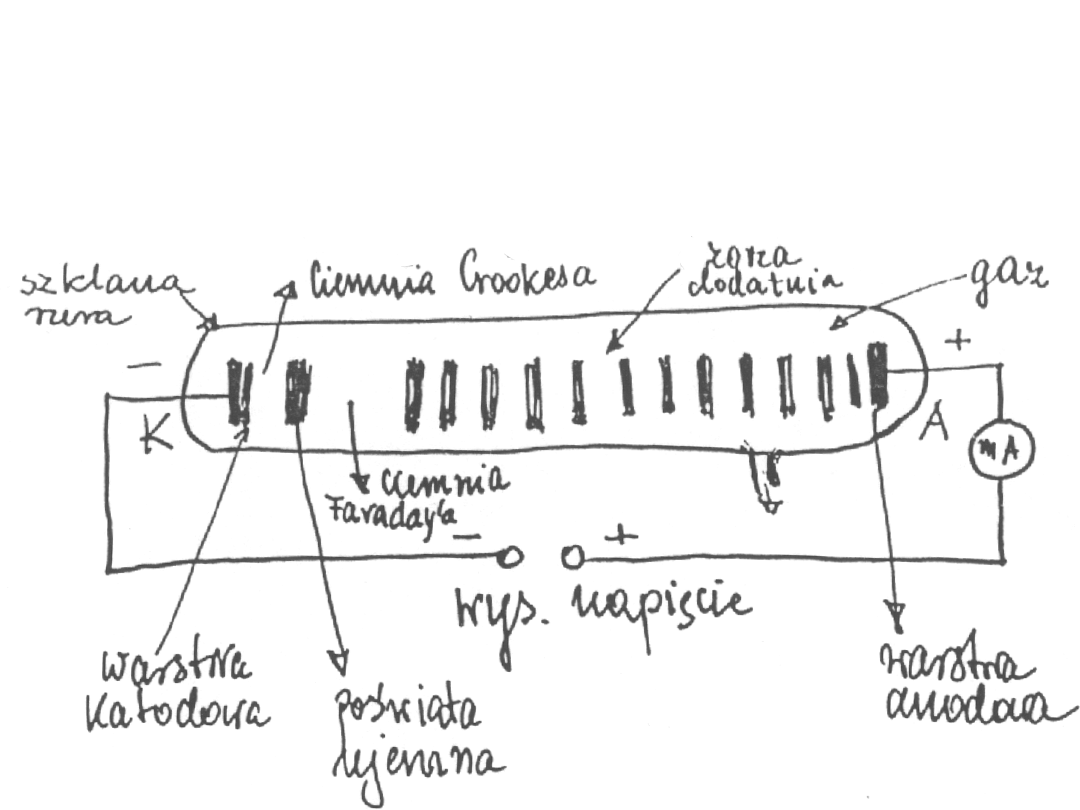
Prąd elektryczny w gazach rozrzedzonych
Przy ciśnieniu ok. 0,01 mm Hg świecenie gazu znika. Pojawia się świecenie
rury szklanej, naprzeciwko katody, seledynowym światłem.
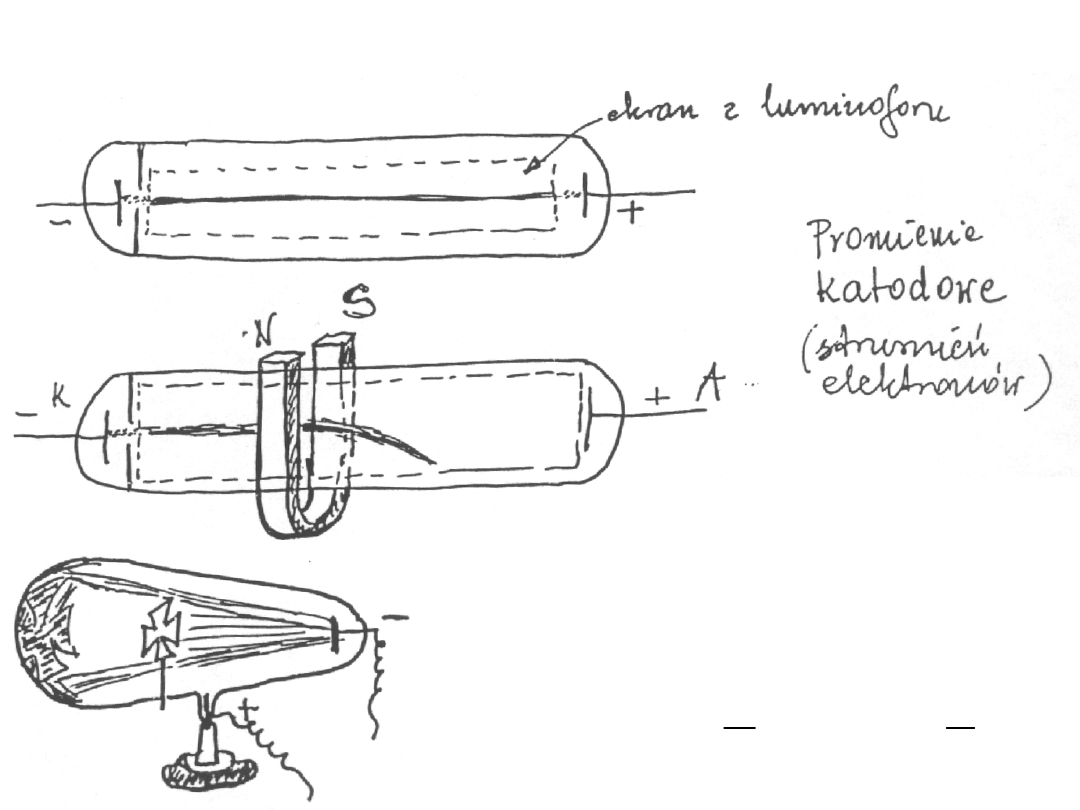
Thomson odkrył, że promienie katodowe
to strumienie bardzo lekkich cząstek o
ładunku ujemnym. Odchylając strumień
tych cząstek w polu elektrycznym i
magnetycznym wyznaczył stosunek e/m.
8
C
1,759 10
g
e
m
=
�
Wyznaczanie e/m dla elektronu przez Thomsona
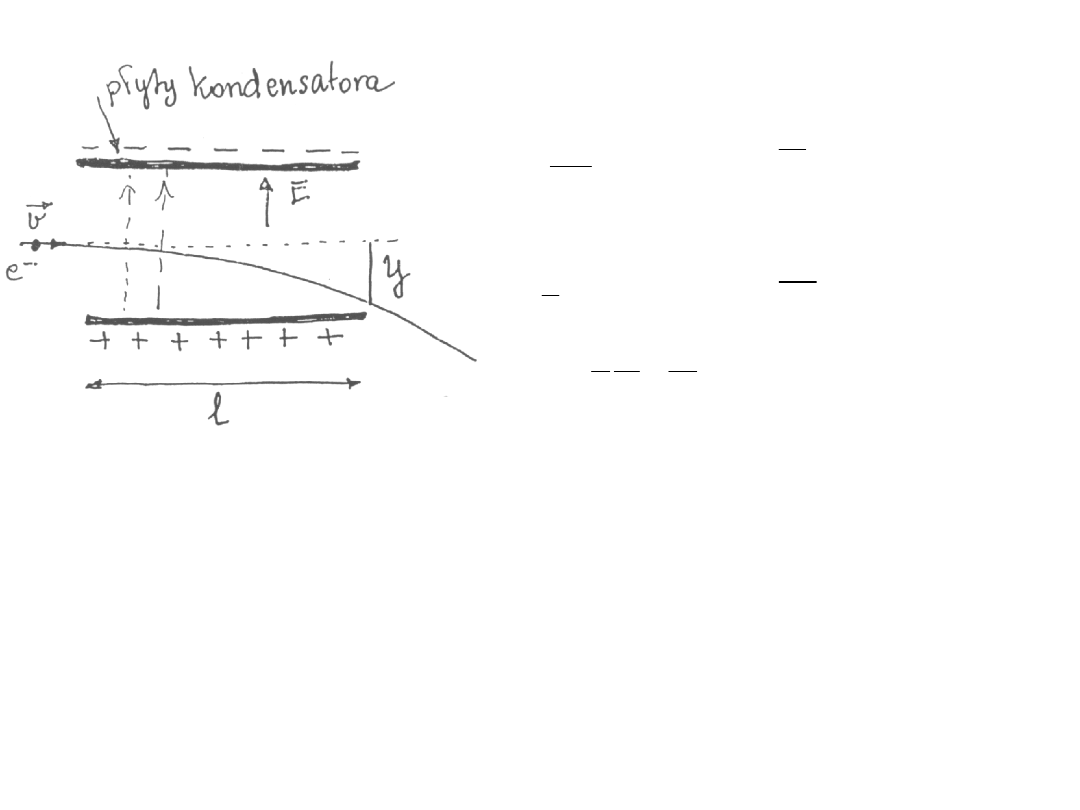
Odchylenie elektronu w polu elektrycznym
2
2
at
y
l vt
l
t
v
=
=
=
F
a
m
F eE
eE
a
m
=
=
=
2
2
1
2
e l
y
E
m v
=
(*)
gdzie:
m masa cząstki
(elektronu)
e ładunek cząstki
v prędkość cząstki
E natężenie pola
elektrycznego
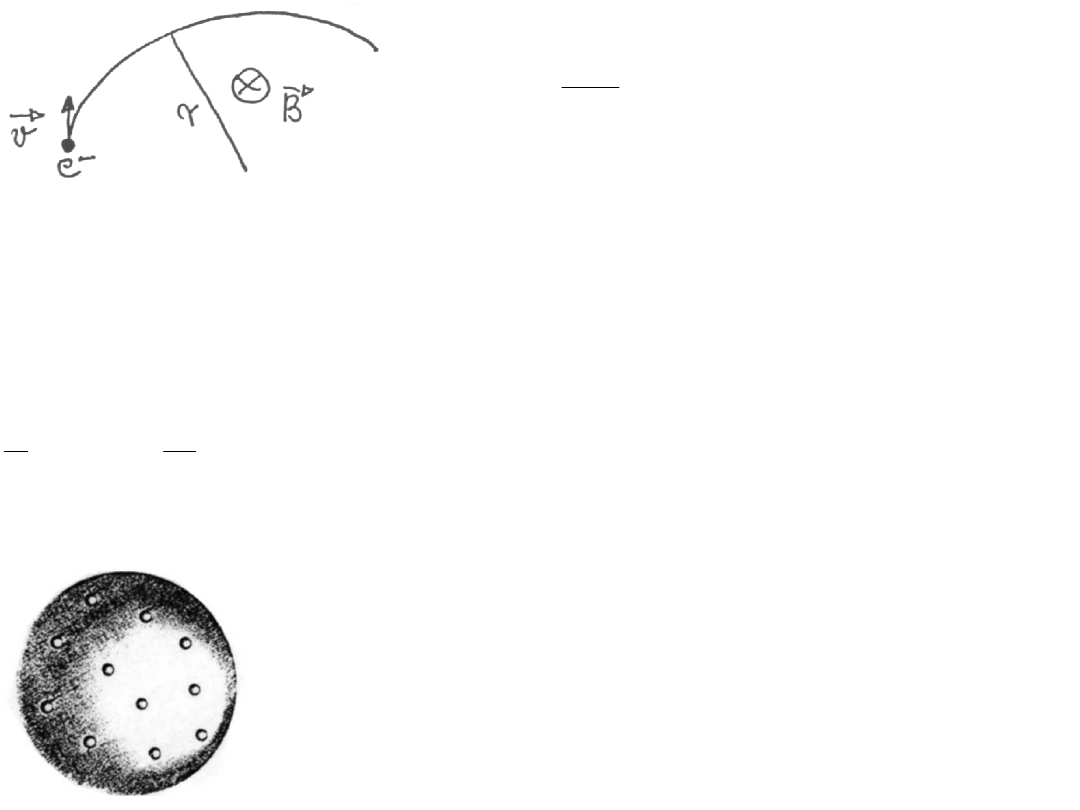
Odchylenie elektronu w polu magnetycznym
2
mv
evB
r
=
(**)
Z równań (*) i (**) można było wyznaczyć v i e/m.
Thomson stwierdził, że te czątki (elektrony) muszą być elementami atomów.
Termin „elektron” w odniesieniu do tych cząstek pojawił się później.
11
C
1,76 10
kg
e
m
=
�
Model atomu wg Thomsona
Atom na zewnątrz jest elektrycznie obojętny.

W 1911 r. Ernest Rutherford (fizyk brytyjski, pochodzący z Nowej
Zelandii) wraz ze współpracownikami Marsdenem i Geigerem badali
rozpraszanie cząstek (jąder helu ) przy przechodzeniu przez
cienkie (kilka m) folie złota. Wyniki badań wykazały, że niektóre
cząstki przechodzą przez folie bez zmiany kierunku, ale są takie,
które ulegają rozproszeniu – niektóre nawet pod bardzo dużymi
kątami.
4
2
He
Tak duże kąty rozpraszania wskazywały na to, że ładunek dodatni nie
może być w atomie rozłożony równomiernie. Z obliczeń wynikało, że
prawie cała masa i ładunek dodatni skupione są w bardzo małym
obszarze (o rozmiarach 10
-15
m), a elektrony, jak planety w układzie
słonecznym krążą wokół jądra. Model nazwano modelem
„planetarnym”. Promień toru elektronu jest rzędu 10
-10
m. A więc, jeśli
jądro wyobrazimy sobie jako kulkę o promieniu 1 m, to elektron
krążyłby wokół tej kulki po torze o promieniu 100 km. Atom zatem jest
bardzo „ażurowy”. Jeśli cząsteczka przebiega blisko jądra to jej tor
ulega dużemu odchyleniu, a jeśli daleko to tor odchyla się wcale lub
słabo.
Ernest Rutherford
(1871-1937)
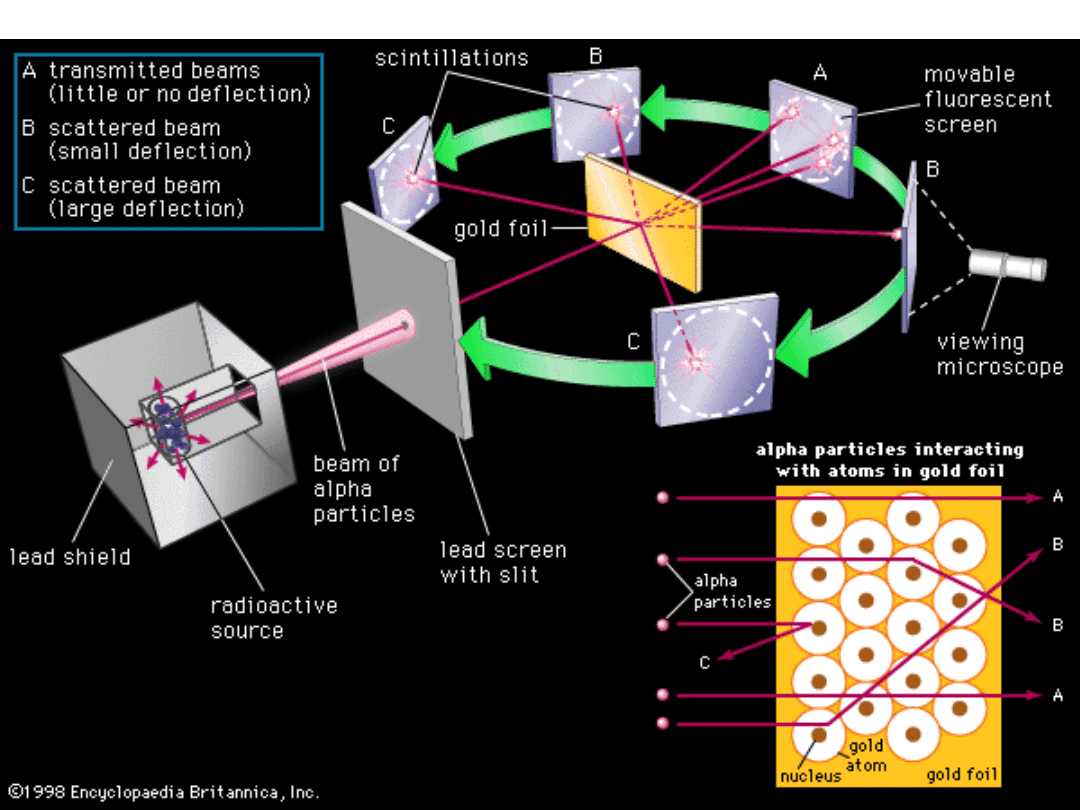
Doświadczenie Rutherforda
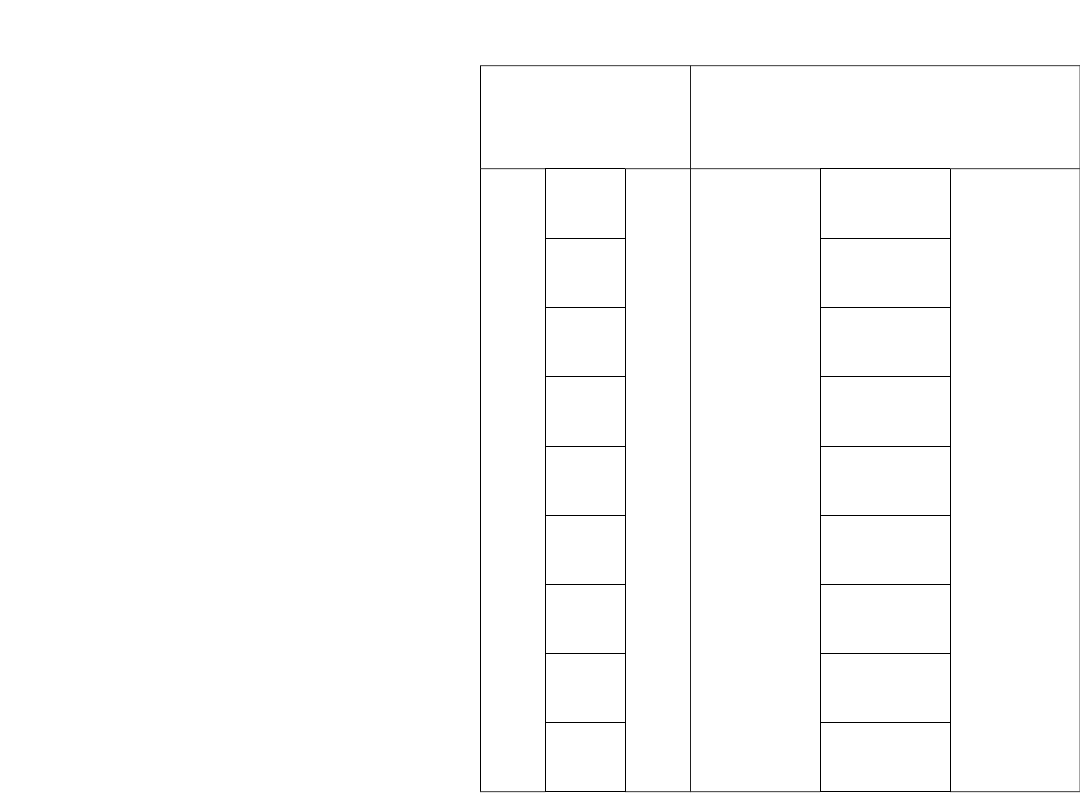
Pomiary wykonywali Geiger i Marsden.
150
135
120
105
60
45
15
10
5
Kąt odchylenia
Eksperymentalna liczba
Zliczeń cząstek odchylonych
33
43
52
69
477
1435
120570
502570
8289000
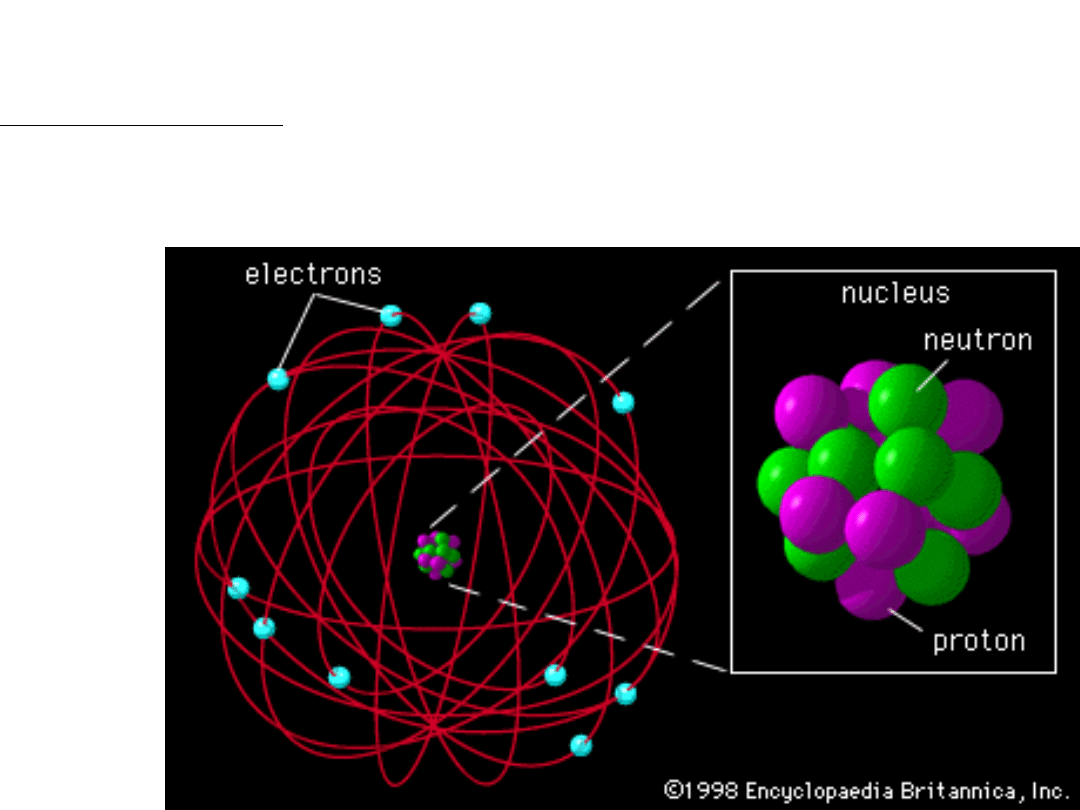
Model Thomsona nie wyjaśniał wyników eksperymentu Rutherforda. Nie
można było wyjaśnić odchyleń cząstek pod tak dużymi kątami.
Hipoteza Rutherforda
Cały dodatni ładunek atomu rozmieszczony jest w jego jądrze i zajmuje
objętość bardzo małą w porównaniu do objętości całego atomu.
Przy takim założeniu otrzymał Rutherford następujący wynik:
Liczba cząstek (
dN
dW
) rozproszonych w jednostkowy kąt bryłowy w jednostce
czasu wyraża się wzorem:
2
4
0
2
2
1
4
4
sin
dN
e Ze
n
d
j
pe e
�
�
�
= �
�
W
�
�
gdzie:
n – gęstość strumienia cząstek
– energia cząstki
Z – liczba atomowa
Dla określonej substancji ropraszającej, określonej energii cząstki oraz
określonej gęstości strumienia n iloczyn
4
sin
2
dN
d
j
W
powinien być stały.
Wyniki te zostały potwierdzone przez Geigera i Marsdena
(od 10
o
do 150
o
).
o
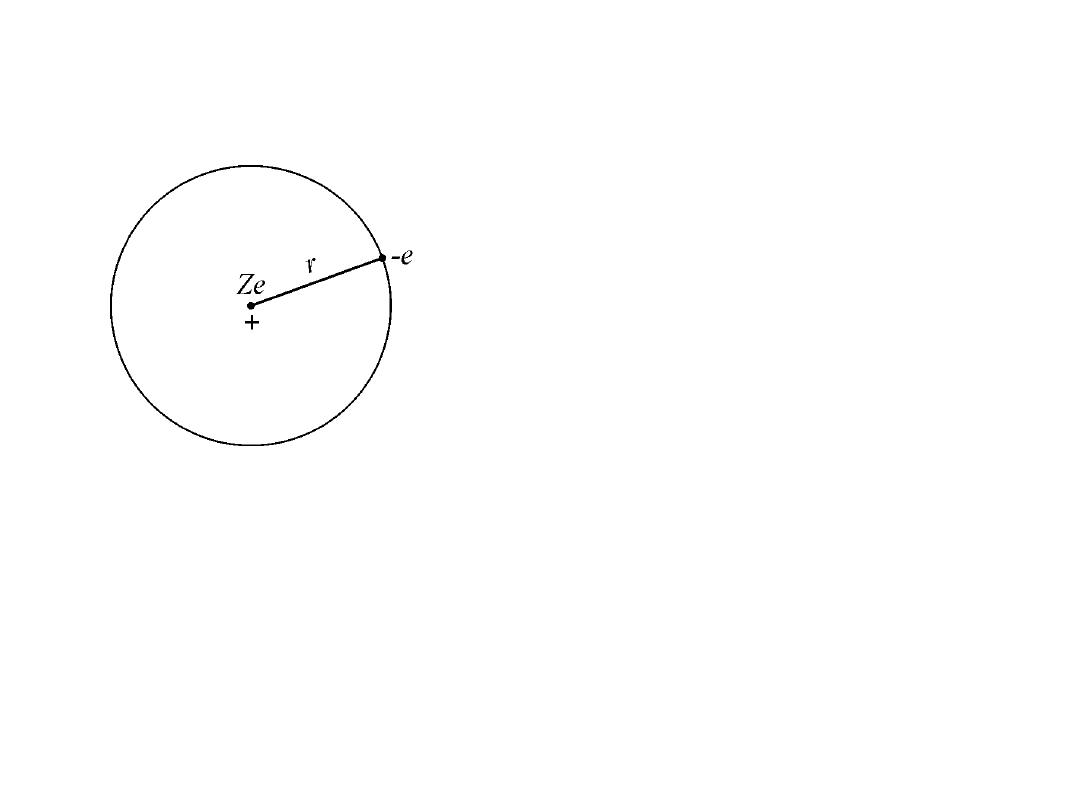
Model jądrowy atomu wg. Rutherforda
Prawie cała masa atomu i cały jego ładunek dodatni skoncentrowane są w
obszarze o rozmiarach 10
-15
m w tzw. jądrze atomu. Wokół jądra krąży
elektron o ładunku ujemnym.
8
10
15
10 cm 10 m (1A)
10 m
1
j
r
R
Z
-
-
-
=
=
o
:
:
~
~
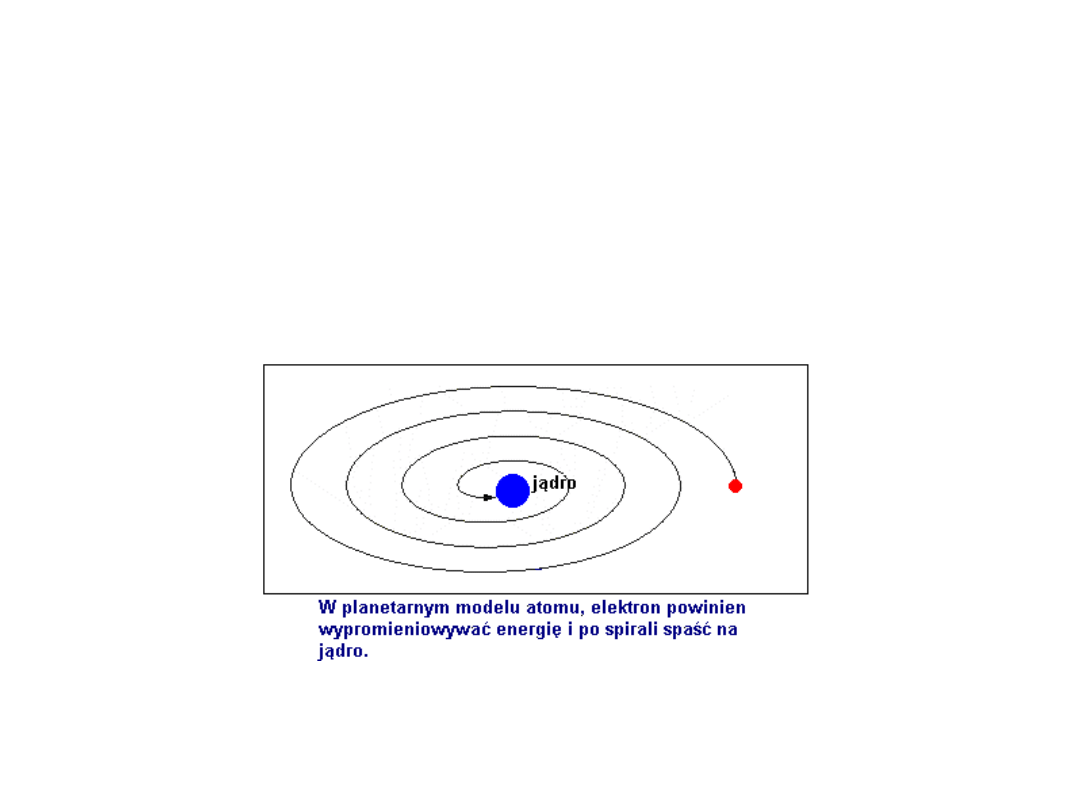
Pojawia się jednak kolejny problem. Krążenie elektronu wokół jądra
powinno być związane z emisją energii, a elektron powinien spadać
na jądro. Stąd wniosek – atom byłby układem nietrwałym.
Tymczasem atomy są układami trwałymi.
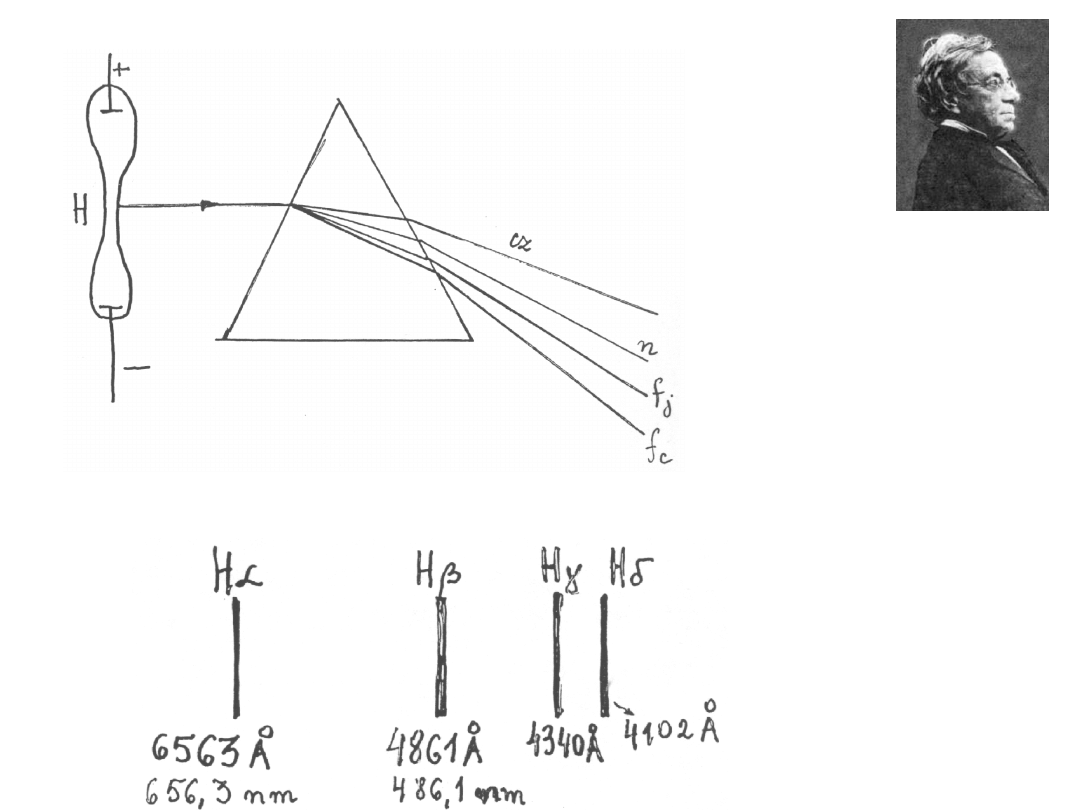
Doświadczenie Balmera
J. Balmer (fizyk szwajcarski) zmierzył długość fali w widmie liniowym wodoru.
Johann Jakob
Balmer
(1825 – 1898)
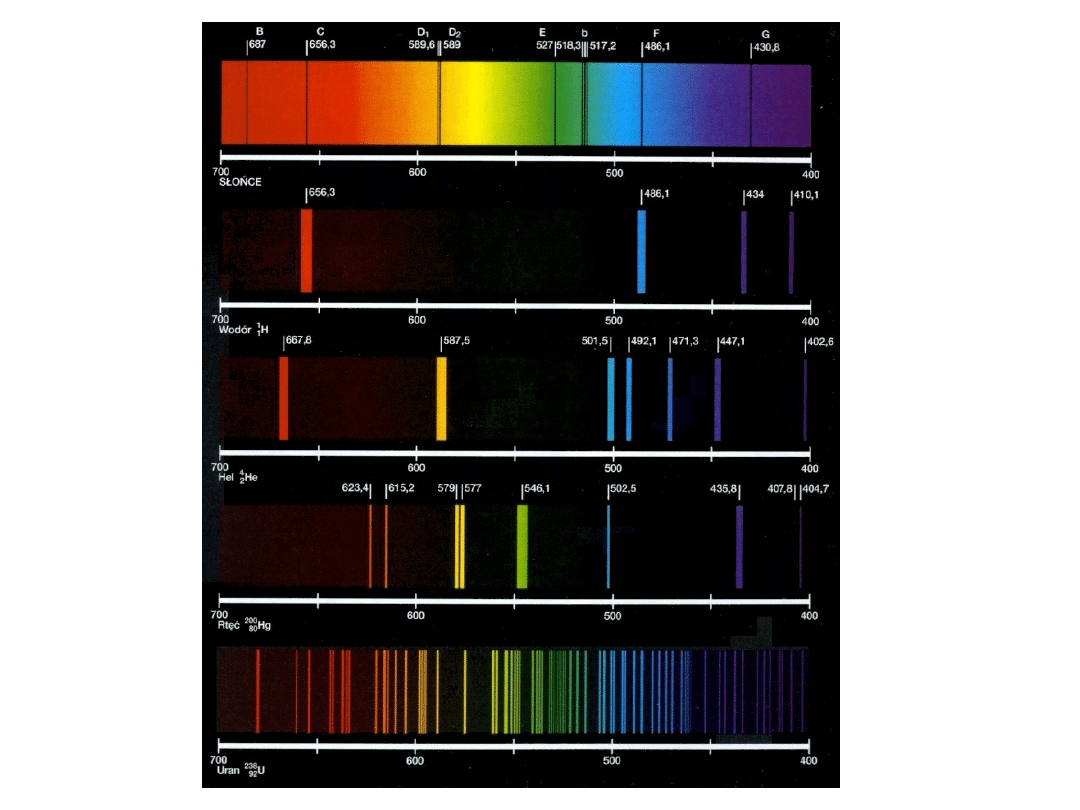

Balmer obliczył, że można te długości fal przedstawić prostym wzorem:
2
2
'
[A]
4
n
R
n
l =
-
o
gdzie:
'
R
wielkość stała = 3645,6
A
o
n – kolejne liczby całkowite
Wnioski ze wzoru:
1.Widać, że musi być spełniony warunek n 3. Zatem seria przedstawiona
tym wzorem nie może zawierać fal o długościach większych od wartości
otrzymanej dla n = 3 ( = 6563 )
A
o
2.Istnieje najmniejsza, graniczna długość fali określona warunkiem
n��
,
'
R
l �
min
3645,6 A
l
=
o
Jest to tak zwana granica serii.
Wzór J. Rydberga:
2
2
1
1
R
m
n
n
�
�
=
-
�
�
�
�
n > m
gdzie:
R – stała Rydberga

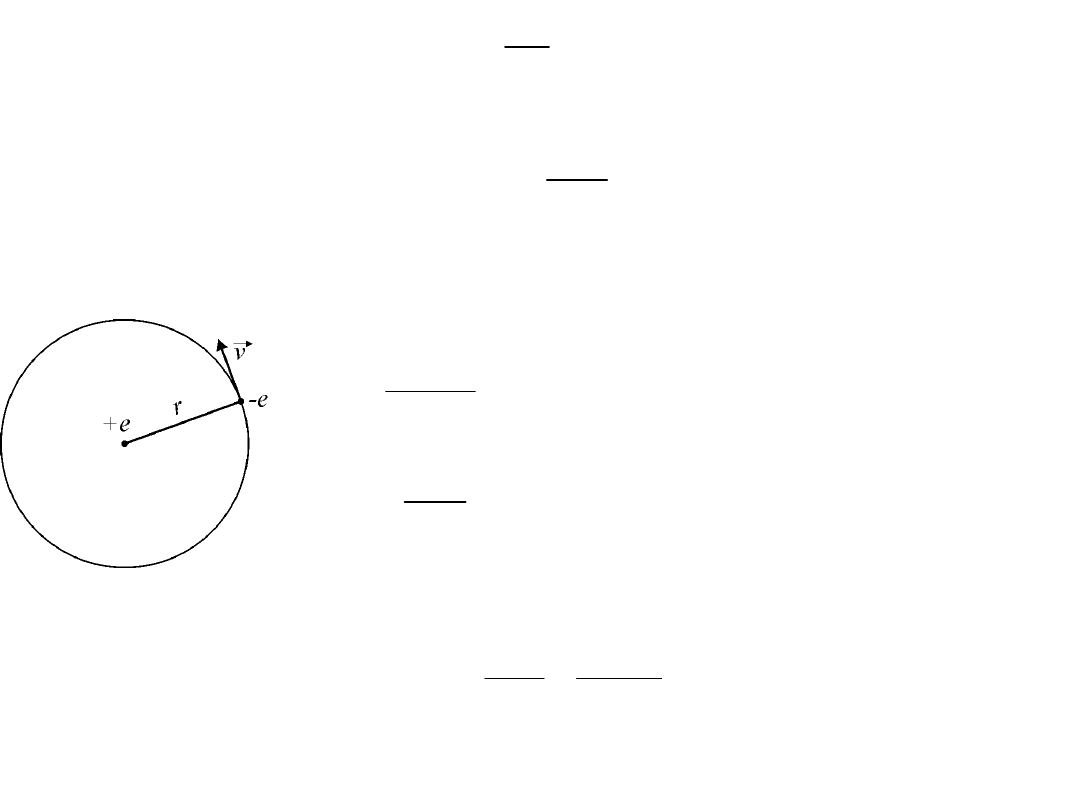
Niels Bohr, fizyk duński, w 1913 r. dokonał kolejnej modyfikacji modelu
planetarnego budowy atomu.
Elektrony krążą wokół jądra po pewnych ściśle określonych (tzw.
dozwolonych) orbitach nie promieniując przy tym energii
elektromagnetycznej. W każdym stanie stacjonarnym układ jądro-
elektron ma określoną energię. Pod wpływem czynników zewnętrznych
elektron może przejść na dalszą od jądra orbitę. Wtedy atom jest w
stanie wzbudzonym (o wyższej energii). Jest to stan nietrwały i po czasie
10
-8
s atom wraca do stanu podstawowego (o niższej energii).
Niels Henrik David Bohr
(1885 – 1962)

n
m
hn e e
= -
gdzie:
n
– energia atomu w wyższym stanie energetycznym
m
– energia atomu w niższym stanie energetycznym
Model atomu ulegał dalszym modyfikacjom. Niektóre zjawiska
tłumaczy on w wystarczającym stopniu i w tych przypadkach jest do
dziś stosowany.
Model Bohra stanowił ważny krok (chociaż nie ostatni !) w rozwoju
poglądów na budowę materii.
W czasie takiego przejścia emitowana jest energia kwantu promieniowania:

Model atomu wodoru wg. Bohra
Postulaty Bohra:
1. W układzie atomowym istnieje pewna liczba stanów, w których nie
dochodzi do emisji promieniowania energii, nawet jeśli cząstki poruszają się
względem siebie, a zgodnie z zasadami elektrodynamiki klasycznej
należałoby się spodziewać takiej emisji.
Tego rodzaju stany nazwano stanami „stacjonarnymi”.
2. Każdej emisji lub absorpcji energii promieniowania odpowiada przejście
elektronu pomiędzy dwoma stanami stacjonarnymi. Promieniowanie
emitowane podczas takiego przejścia jest jednorodne, a jego częstość
określana jest zależnością:
2
1
hn e e
= -
gdzie h jest stałą Plancka, a
1
i
2
odpowiadają energiom układu o obu
stanach stacjonarnych.
3. Równowaga dynamiczna układu w stanach stacjonarnych podlega zwykłym
prawom mechaniki. Prawa te nie stosują się do przejść z jednego stanu do
drugiego.
Warunek kwantowy Bohra
W dowolnym układzie atomowym lub cząsteczkowym, składującym się z
dodatniego jądra i elektronów, w którym jądra znajdują się względem siebie
w spoczynku, natomiast elektrony poruszają się po orbitach kołowych,
moment pędu każdego elektronu względem środka jego orbity jest równy
h/2 w „normalnym” stanie układu, to znaczy w stanie, w którym całkowita
jego energia jest minimalna
1
2
h
mvr
p
=
=h
2
n
nh
mvr
p
=
Model atomu wodoru wg. Bohra
2
e
d
mv
F
r
=
2
2
0
4
c
e
F
r
pe
=
siła dośrodkowa
siła kulombowskiego
oddziaływania między
jądrem i elektronem
Siła F
c
pełni rolę siły dośrodkowej.
2
2
2
0
4
e
mv
e
r
r
pe
=

Obliczamy promień toru elektronu:
2
2
0
4
e
e
r
mv
pe
=
(*)
Z warunku kwantowego:
2
nh
mvr
p
=
obliczamy
v
.
2
nh
v
mr
p
=
(**)
Wstawiamy do równania (*) i otrzymujemy:
2
2
0
2
e
h
r
n
e m
e
p
=
�
(***)
r ~ n
2
dla n = 1, r
1
= 0,53
.
10
-10
m

Obliczamy całkowitą energię układu atomowego w n-tym stanie stacjonarnym.
k
p
e e e
= +
gdzie:
k
– energia kinetyczna elektronu
p
– energia potencjalna układu jądro-elektron
2
2
2
0
2
4
e
mv
e
r
e
pe
-
=
+
(****)
2
2
2
0
4
2
e
mv
e
r
r
r
pe
=
�
2
2
0
2
8
e
k
mv
e
r
e
pe
=
=
Wstawiając do wzoru (****) otrzymujemy:
2
2
2
0
0
0
8
4
4
e
e
e
r
r
r
e
pe
pe
pe
=
-
=-
Ale
2
2
0
2
e
h
r
n
e m
e
p
=
�
4
2 2 2
0
8
e
e m
n h
e
e
=-
4
2 2
2
0
1
8
e
e m
h n
e
e
=-
�
1
2
13,6 eV
3,39 eV
e
e
=-
=-
Dla n r , ale
ε
0
Dla n=1
8

Z drugiego postulatu Bohra:
2
1
hn e e
= -
4
4
2 2 2
2 2 2
0
0
8
2
8
1
e
e
e m
e m
h
h
h
n
e
e
�
�
=-
- -
�
�
�
�
4
2 2
2
2
0
1
1
8
1
2
e
e m
h
h
n
e
�
�
=
-
�
�
�
�
{
4
2 3
2
2
0
1
1
8
1
2
e
R
e m
h
n
e
�
�
=
-
�
�
�
�
- wniosek z modelu
2
2
1
1
R
m
n
n
�
�
=
-
�
�
�
�
- wniosek z eksperymentu
Różnica pomiędzy wartością R obliczoną ze wzoru i wyznaczoną
doświadczalnie jest mniejsza od 0,1%.
Wniosek z modelu Bohra zgodny jest z równaniem Rydberga wynikającym z
eksperymentu.
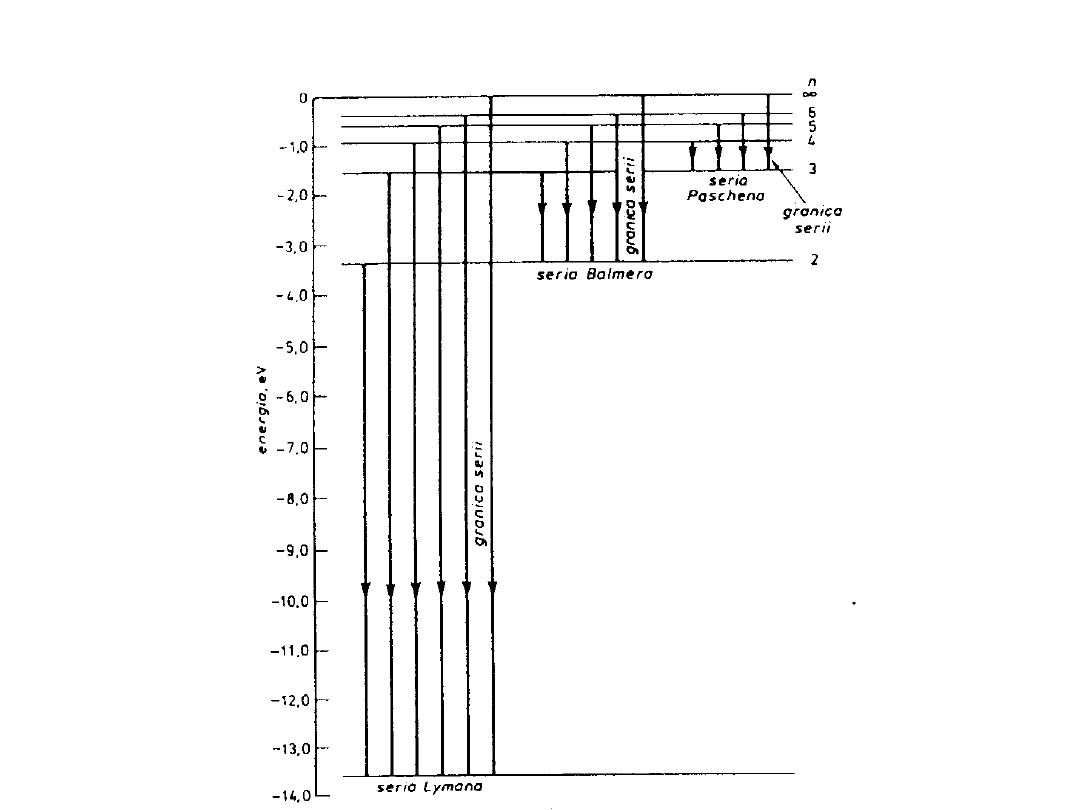
Skwantowane poziomy energetyczne atomu wodoru.

Doświadczenie Francka-Hertza (1914)
1.Doświadczenie Francka-Hertza, wyniki
eksperymentu, wnioski z doświadczenia.
2.Wyjaśnienie wyników doświadczeń na podstawie modelu
skwantowanych poziomów energetycznych.
James Franck (
1882-1964
) i Gustav Hertz (
1887-1975
)
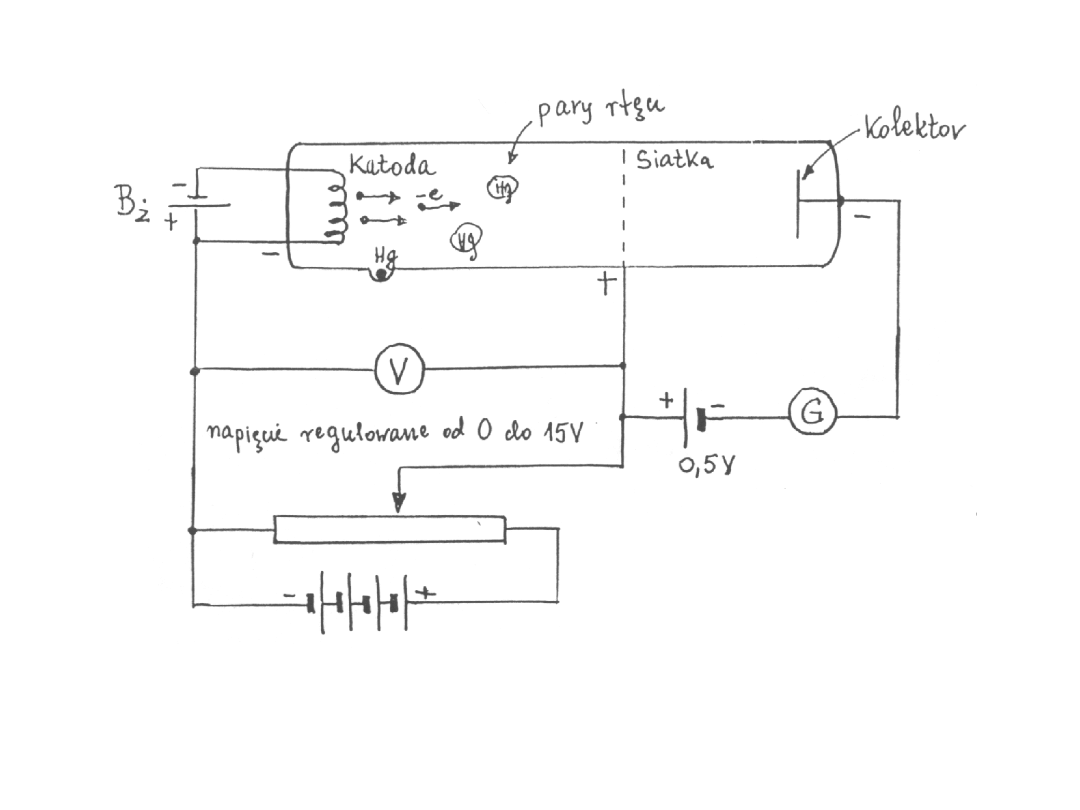
Schemat połączeń
Między katodą i siatką jest pole elektryczne przyśpieszające
elektrony. Między siatką i kolektorem występuje pole elektryczne
hamujące.
Elektrony poruszając się w polu
elektrycznym między katodą i siatką
uzyskują energię kinetyczną:
2
2
mv
eU
=
1914 r. James Franck, Gustav Hertz
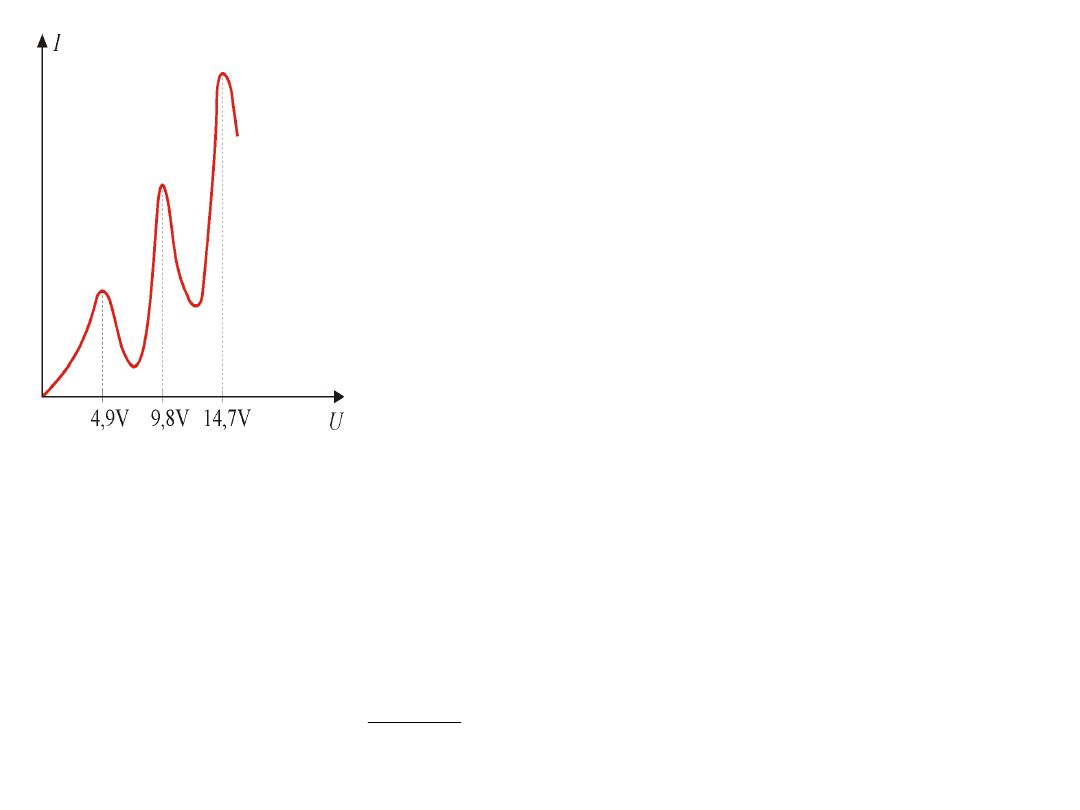
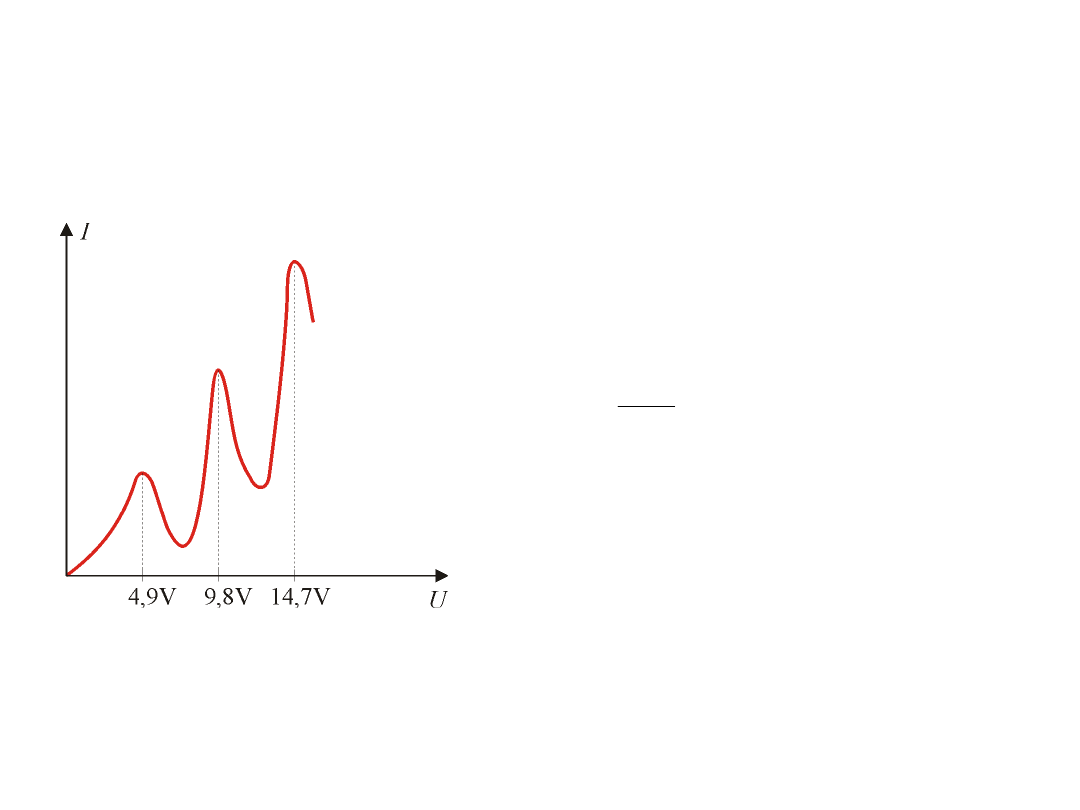
Eksperymenty Francka i Hertza wykonane w rok
po ogłoszeniu postulatów Bohra stanowiły
dowód istnienia skwantowanych poziomów
energetycznych w atomach.
W zakresie napięcia od 0 – 4,9 eV zderzenia
elektronów z atomami rtęci są sprężyste
(zachodzą prawie bez strat energii
elektronów).Przy energii 4,9 eV (napięciu 4,9 V)
pojawiają się zderzenia niesprężyste. Elektron
przekazuje atomom rtęci całą swoją energię.
Przy napięciu 9,8 V elektron na drodze między
K – S doznaje dwukrotnie zderzeń
niesprężystych.
Energia 4,9 eV jest najmniejszą, jaka może być pochłonięta przez atom
rtęci. Zatem pierwszy poziom atomu Hg powinien mieć energię o 4,9 eV
większą niż stan podstawowy. Powrót ze stanu wzbudzonego do
podstawowego wiąże się z emisją kwantu, także o energii 4,9 eV, co
odpowiada długości fali ok. 253,6 nm. Obserwacje potwierdziły
występowanie linii widmowej o tej długości.
= 253,6 nm
4,9 eV
hc
l =

Emisja spontaniczna
Przejście atomów ze stanu wzbudzonego do stanu podstawowego z
emisją fotonu opisuje prawo statystyczne.
Niech w chwili t liczba atomów w stanie wzbudzonym wynosi N.
Oznaczymy:
-dN – ubytek atomów w stanie wzbudzonym
N – aktualna liczba w stanie wzbudzonym
dt – czas, w którym ubyło dN atomów
Możemy zapisać:
dN ANdt
-
=
gdzie:
A – współczynnik proporcjonalności
dN N dt
-
�
:
~
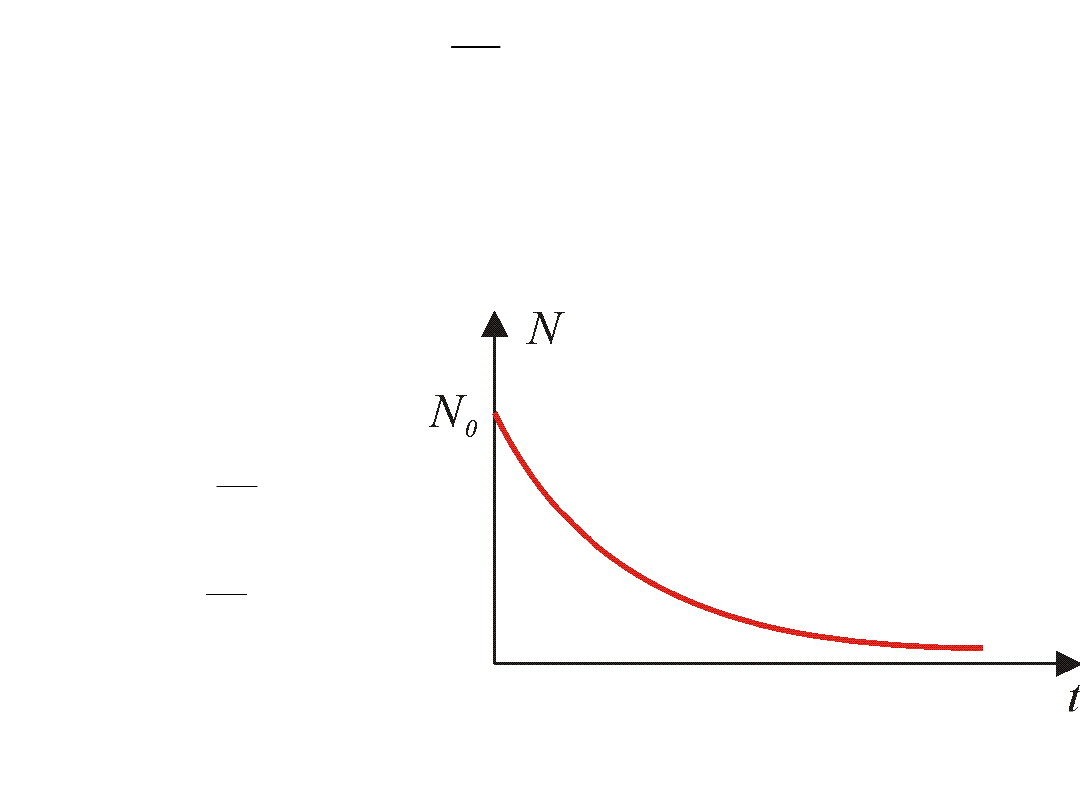
dN
Adt
N
=-
Całkując stronami otrzymujemy:
lnN
At C
=-
+
C wyznaczamy z warunków początkowych – jeśli t = 0, to N = N
0
lnN
0
= C
Zatem
0
0
0
0
ln
ln
ln
ln
ln
At
N
At
N
N
N
At
N
At
N
N
e
N
-
=-
+
-
=-
=-
=
0
At
N N e
-
=
�
Liczba atomów w stanie wzbudzonym maleje wykładniczo.

Wzbudzanie atomów i cząsteczek
Sposoby wzbudzania atomów i cząsteczek:
1.wzbudzanie optyczne
2.wzbudzanie termiczne
3.wzbudzanie elektryczne
4.wzbudzanie chemiczne
*
2
2
*
1
2
2
A
A
A
A
h
mv
mv
e
n e
e
e
+ =
+
= +
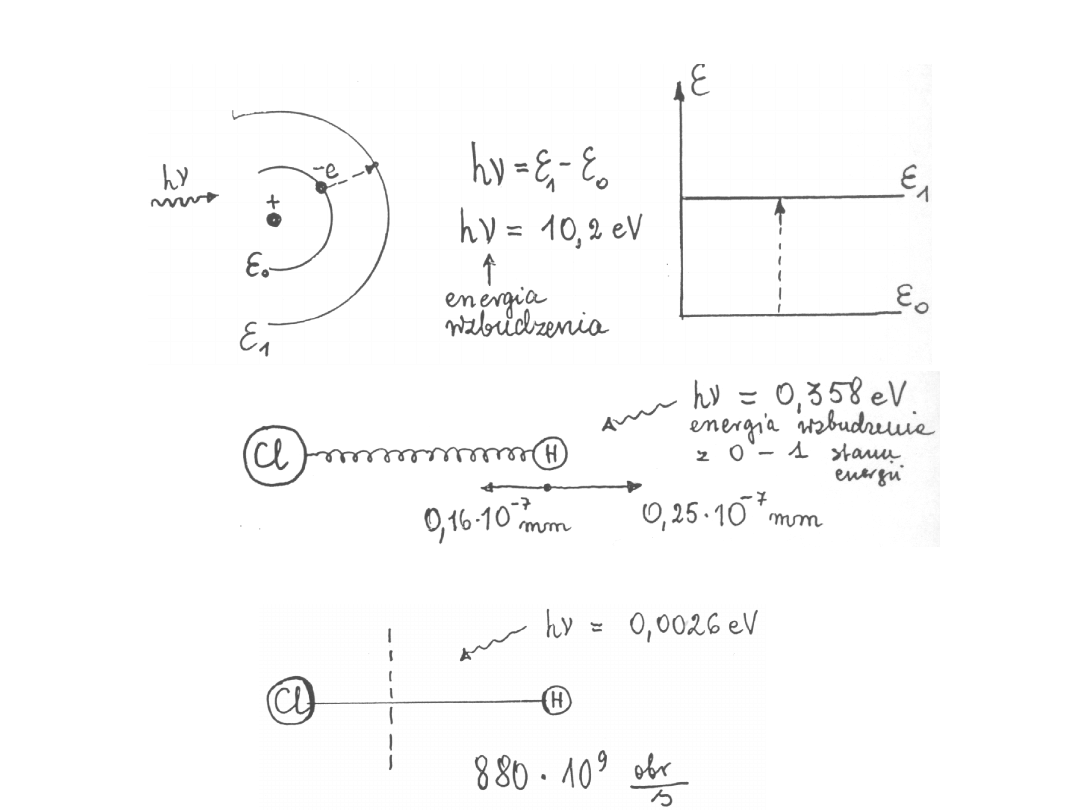
Rodzaje wzbudzeń:
1.
2.Oscylacje
3.Rotacje
Oscylacje
Zmiana
stanu
Niezbędny
kwant
energii
Osiągnięt
y
stan
Amplitudy
w 10
-7
mm
0
0,15
0,10
0 – 1
0,358 eV
1
0,25
0,16
1 – 2
0,345 eV
2
0,33
0,20
2 – 3
0,333 eV
3
0,39
0,23
Rotacje
Zmiana stanu
Niezbędny
kwant energii
Osiągnięt
y
stan
Liczba obrotów
w czasie 10
9
/s
0 – 1
0,0026 eV
1
880
1 – 2
0,0051 eV
2
1520
2 – 3
0,0077 eV
3
2150
3 – 4
0,0103 eV
4
2770

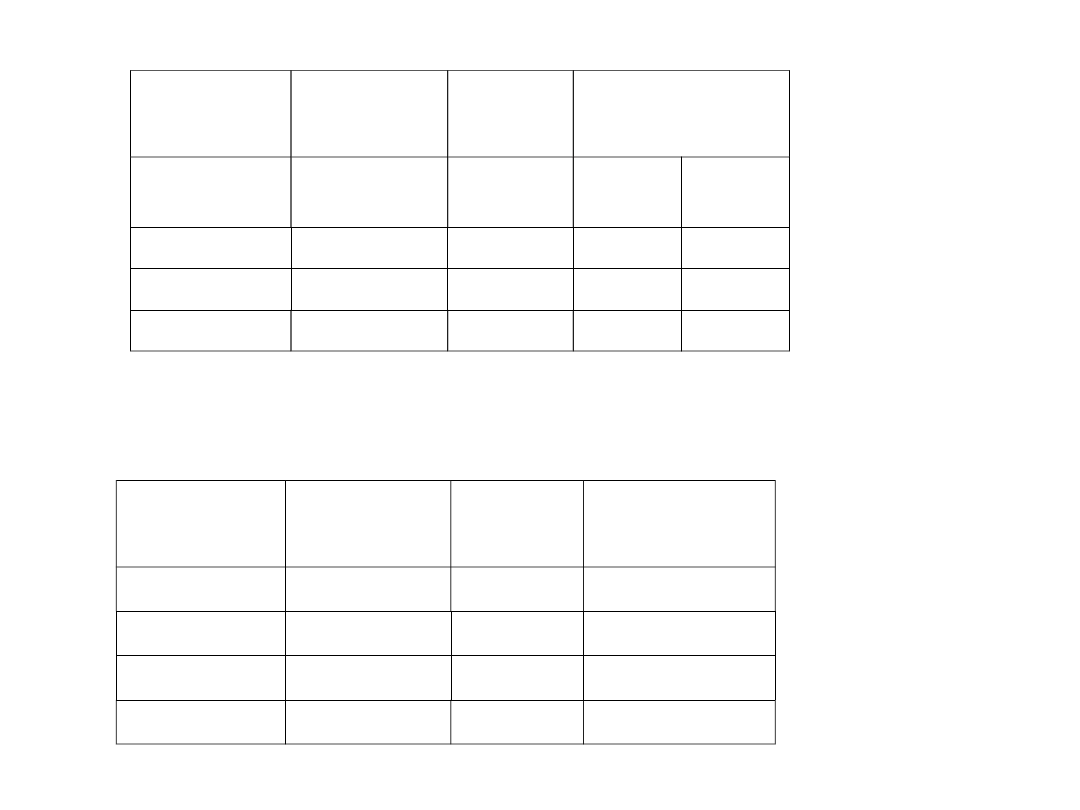
Pierwiastek
Energia wzbudzania
Energia jonizacji
H
10,2 eV
13,6 eV
He
19,8 eV
24,6 eV
Hg
0
4,9 eV
10,4 eV
Na
0
2,1 eV
0
5,1 eV
K
0
1,6 eV
0
4,3 eV
Cs
0
1,5 eV
0
3,9 eV
Pb
0
1,2 eV
0
7,4 eV

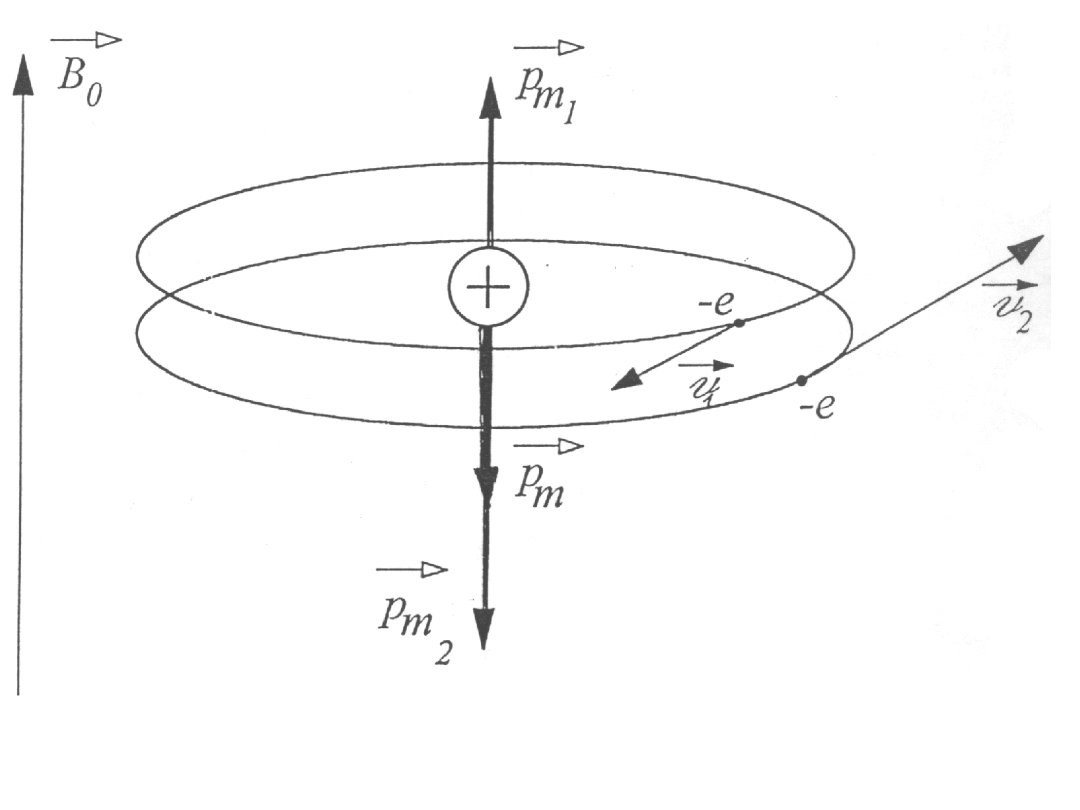
Diamagnetyzm
Zastosowanie modelu Bohra do wyjaśnienia zjawiska diamagnetyzmu.
Moment magnetyczny prądu kołowego związanego z ruchem elektronu
względem jądra przedstawia wzór:
2
[A m ]
m
p
I S
= �
�
gdzie:
I – natężenie prądu
S – powierzchnia objęta orbitą elektronu
Ale
2
e
I
T
S
r
p
=
=
e – ładunek
elektronu
T – okres
obiegu
r – promień
orbity
Stąd:
2
2
2
2
m
m
e
p
r
T
r
T
v
ev
p
r
r
p
p
p
p
=
=
=
2
m
evr
p =
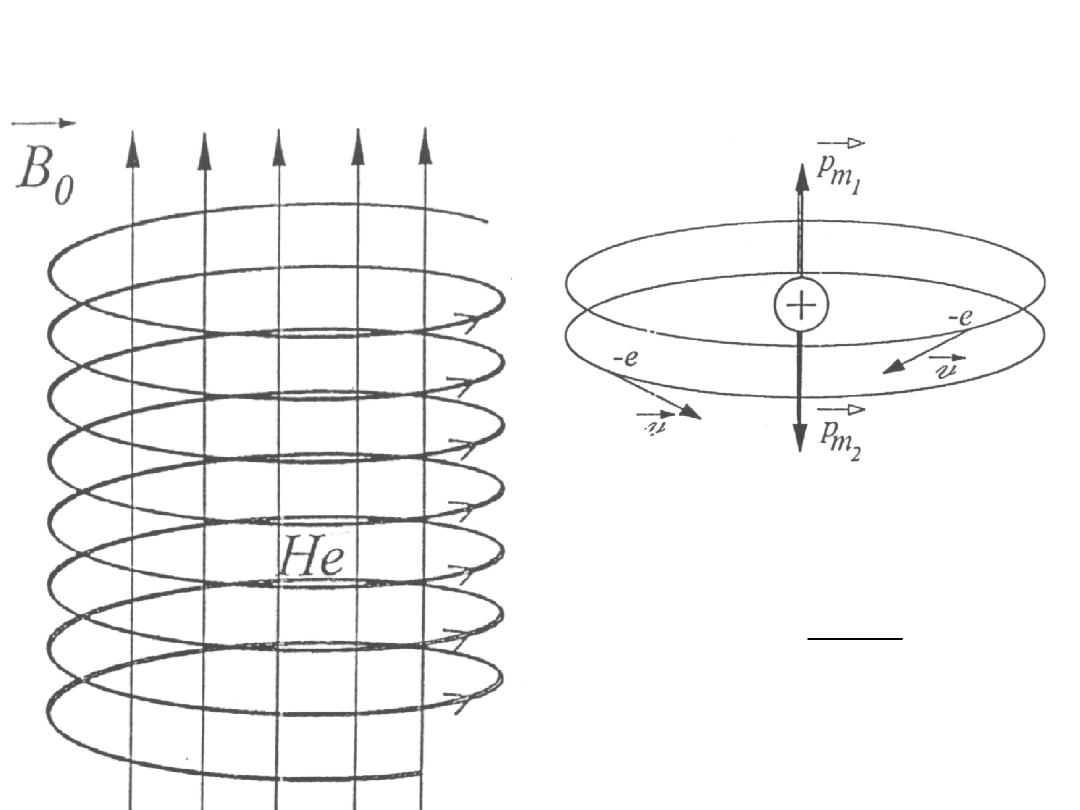
Diamagnetyzm He
2
m
evr
p =
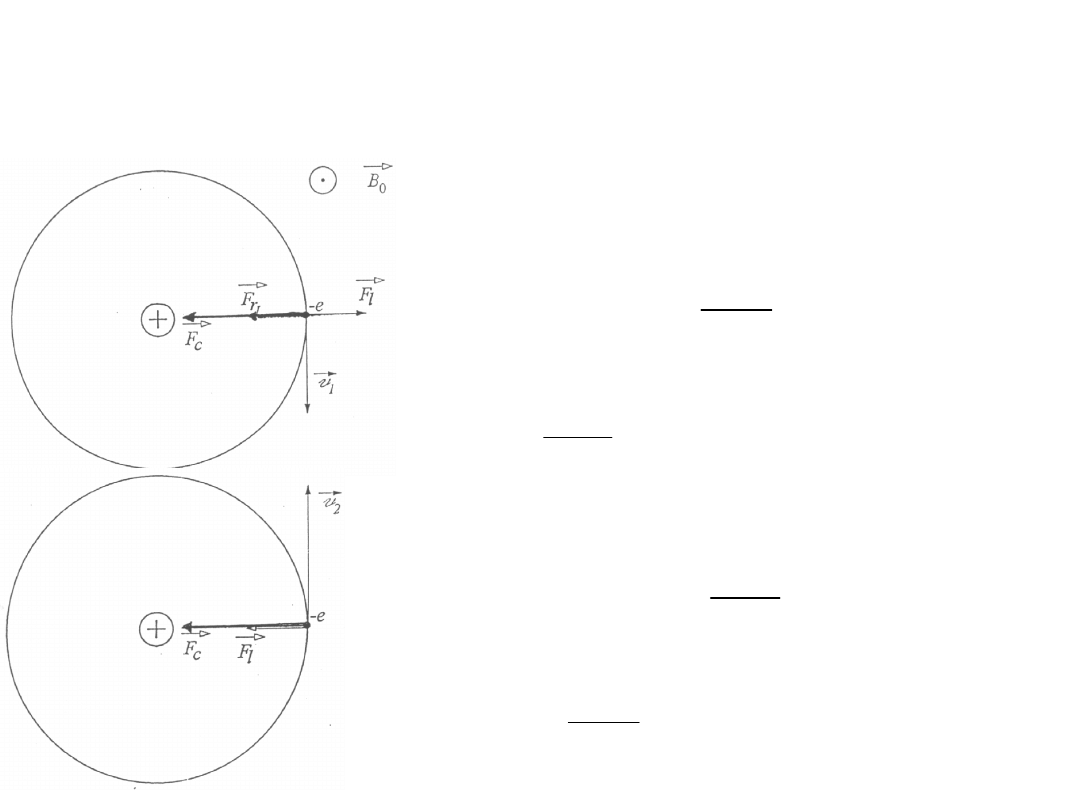
Zgodnie z modelem Bohra w atomie He elektrony krążą wokół jądra po
orbitach o tym samym promieniu i tej samej wartości prędkości, ale w
przeciwne strony.
Zatem
1
2
0
m
m
m
p
p
p
=
-
=
2
1
1
2
I
r
c
l
I
mv
F
F F
r
evr
p
= -
=
=
2
2
2
2
II
r
c
l
I
mv
F
F F
r
ev r
p I
= + =
=

Siły
I
r
F
i
II
r
F
równe są różnicy (I) lub sumie (II) sił: kulombowskiej F
c
i
Lorentza F
l
, które pełnią rolę sił dośrodkowych.
2
1
2
1
m
m
v
v
p
p
>
>
2
1
2
m
m
m
m
p
p
p
M n p
M
H
c
=
-
= �
= �
r
r
r
r
2 2
0
2 2
0
2
2
e r n
M
H
m
e r n
m
m
m
c
=-
=-
r
r
9
1,2 10
He
c
-
=-
�
z modelu teoretycznego
9
2,25 10
He
c
-
=-
�
z eksperymentu
Obliczamy p
m
2
2
1
1 0
2
0
2
2
2
2 0
2
0
2
4
2
4
I
II
r
c
l
r
c
l
e
mv
F
F F
evB
r
r
e
mv
F
F F
ev B
r
r
pe
pe
= -
=
-
=
= + =
+
=
Widać, że
2
1
v
v
>
Stronami otrzymujemy:
2
2
2
2
2
1
2 0
1 0
2
2
0
0
0
2
1
2
2
4
4
(
)
e
e
mv
mv
ev B
evB
r
r
r
r
eB v v
pe
pe
+
-
+
=
-
+
2
1
(
)
m
v v
r
=
+
2
1
0
2
1
(
)
v v
eB r
v v
m
-
-
=

Ale
2
1
2
1
2
2
(
)
2
m
m
ev r evr
p
er
p
v v
=
-
=
-
Podstawiamy
0
0
0
2 2
0
;
2
2
m
m
er eB r
p
B
H
m
e r
H
p
m
m
m
=
=
=
r
r
2 2
0
2
m
e r
H
p
m
m
=-
r
r
„-” bo zwroty
m
p
r
i
H
r
są przeciwne
2 2
0
2
m
e r n
M np
H
m
m
=
=-
r
r
r
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
18 Ewolucja modelu atomu
ewolucja modelu stosowania prawa-teoria demokracji, Teoria prawa i demokracji
2004 03 18 Ewolucja procesow zarzadzania Srodowiskowy kontekst zarzadzania
Łukasik Ewolucja pojecia atomu
18.budowa atomu
18 Babik, Ewolucja genomow i powstawanie nowych genow (2009)
18 Mityczna seria ewolucji konia (2009)
Własności atomu wodoru według modelu Bohra
Prezentacja 18
podrecznik 2 18 03 05
Ewolucja marketingu era produkcyjna, sprzedazowa, marketingowa Rynek definicja
9 1 18 Szkolenie dla KiDów
Planowanie strategiczne i operac Konferencja AWF 18 X 07
więcej podobnych podstron