
PODSTAWY
CHEMII
NIEORGANICZNEJ
Prof. Piotr Drożdżewski
(pok. 204, A-3)
Konsultacje:
Wtorek, godz. 11:15 – 13:00
Środa, godz. 11:15 – 13:00
WPC2002w
POLITECHNIKA WROCŁAWSKA
Wydział Chemiczny

1. P. Mastalerz, Elementarna chemia nieorganiczna, Wyd.
Chemiczne, Wrocław, 1997.
2. I. Barycka, K. Skudlarski, Podstawy chemii, Wyd. Pol.
Wrocławskiej,
Wrocław, 2001.
3. P.A. Cox, Chemia nieorganiczna – krótkie wykłady, Wyd.
Naukowe
PWN, Warszawa, 2003.
4. F.A. Cotton, G. Wilkinson, P.L. Gaus, Chemia nieorganiczna –
podstawy, Wyd. Naukowe PWN, Warszawa, 1995.
5. J.E. Brady, General Chemistry, Principles and Structure,
John Wiley & Sons, New York, 1990.
Literatura PODSTAWOWA
Literatura NAJLEPSZA (!)
Literatura UZUPEŁNIAJĄCA
W.P. Student – WŁASNE, DOBRE, NOTATKI Z WYKŁADU (rękopis)
A. Bielański – PODSTAWY CHEMII NIEORGANICZNEJ – PWN
2004 (2002, 1998, 1994)
Podręczny UKŁAD OKRESOWY PIERWIASTKÓW
Obowiązuje znajomość i rozumienie całego układu okresowego pierwiastków!
Warunki zaliczenia kursu WPC2002w:
PODSTAWY
CHEMII NIEORGANICZNEJ
W czasie sesji egzaminacyjnej odbędą się 2
egzaminy pisemne obejmujące wyłożoną teorię i
od 1 do 2 zadań.
Zadania (problemy obliczeniowe) obejmują:
•stechiometrię połączoną z reakcją utleniająco-redukcyjną,
•elektrochemię,
•równowagi w wodnych roztworach elektrolitów,
•związki kompleksowe.

Wykład 1 – Roztwory i równowagi fazowe
FAZA – jednorodna część układu
oddzielona od reszty powierzchnią
graniczną
RÓWNOWAGI FAZOWE
na przykładzie czystych rozpuszczalników
Układ homogeniczny – wszystkie części mają takie same
właściwości
(układ jednofazowy)
Układ heterogeniczny – poszczególne części mają różne
właściwości
(układ wielofazowy)
Składniki układu (fazy): - substancje chemiczne wchodzące w skład układu
FAZA jednoskładnikowa – substancja czysta
FAZA wieloskładnikowa – roztwór
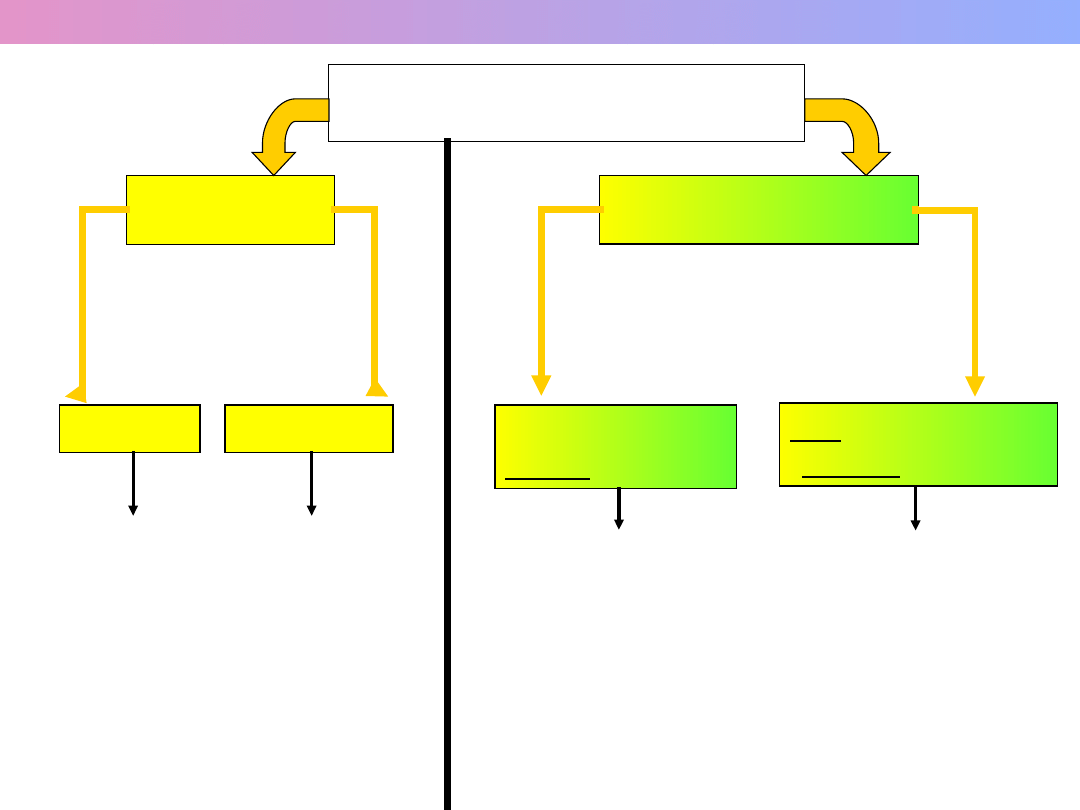
SUBSTANCJE
CZYSTE
MIESZANINY
PROSTE
ZŁOŻONE
JEDNORODNE
homogeniczne
NIEJEDNORODNE
heterogeniczne
PIERWIASTKI
ZWIĄZKI
CHEMICZNE
ROZTWORY
- rozdrobnienie
składników i ich
przemieszanie
sięga aż do
pojedynczych
cząsteczek,
atomów
ODRĘBNE FAZY
- nawet najmniejsze
cząstki
mieszaniny to
skupiska wielu
cząsteczek lub
atomów
- Stały skład,
- Ściśle określone
właściwości
- Zmienny skład,
- Właściwości
zależne od składu
Wykład 1 – Roztwory i równowagi fazowe
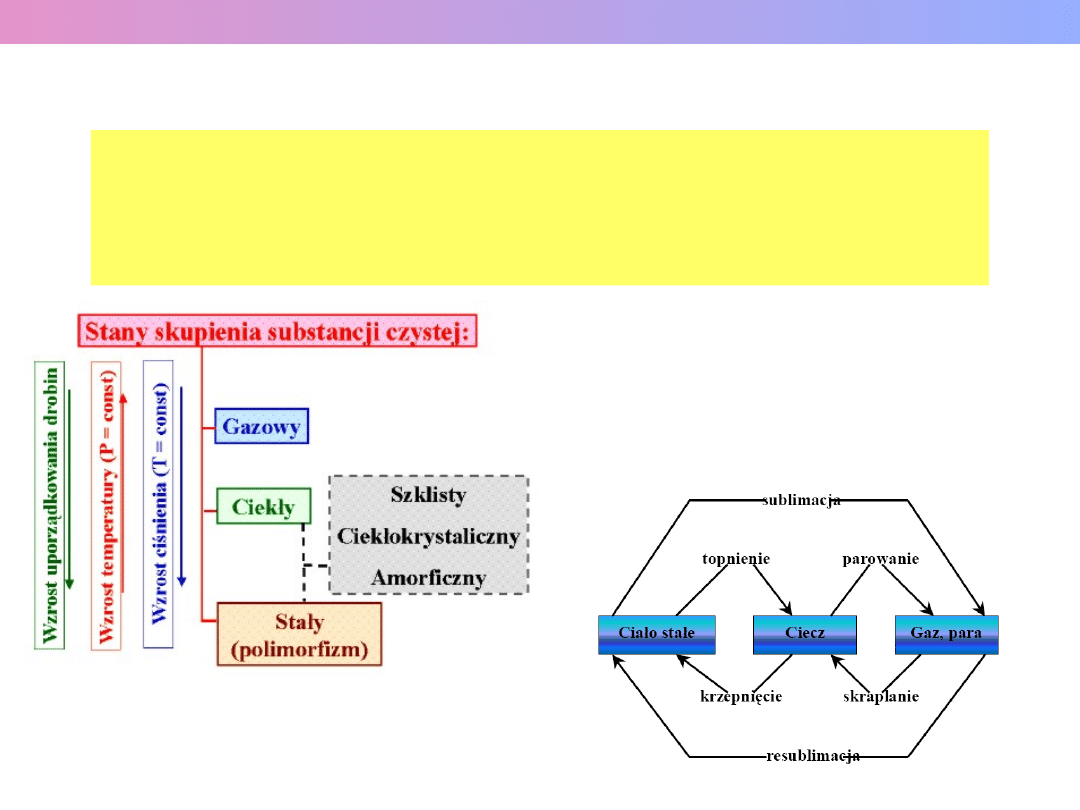
Przemiana fazowa (przejście fazowe) to taka zmiana
układu fizycznego lub chemicznego, której towarzyszy
skokowa zmiana parametrów układu, np. stanu skupienia,
właściwości fizycznych
Wykład 1 – Roztwory i równowagi fazowe
PRZEMIANY FAZOWE
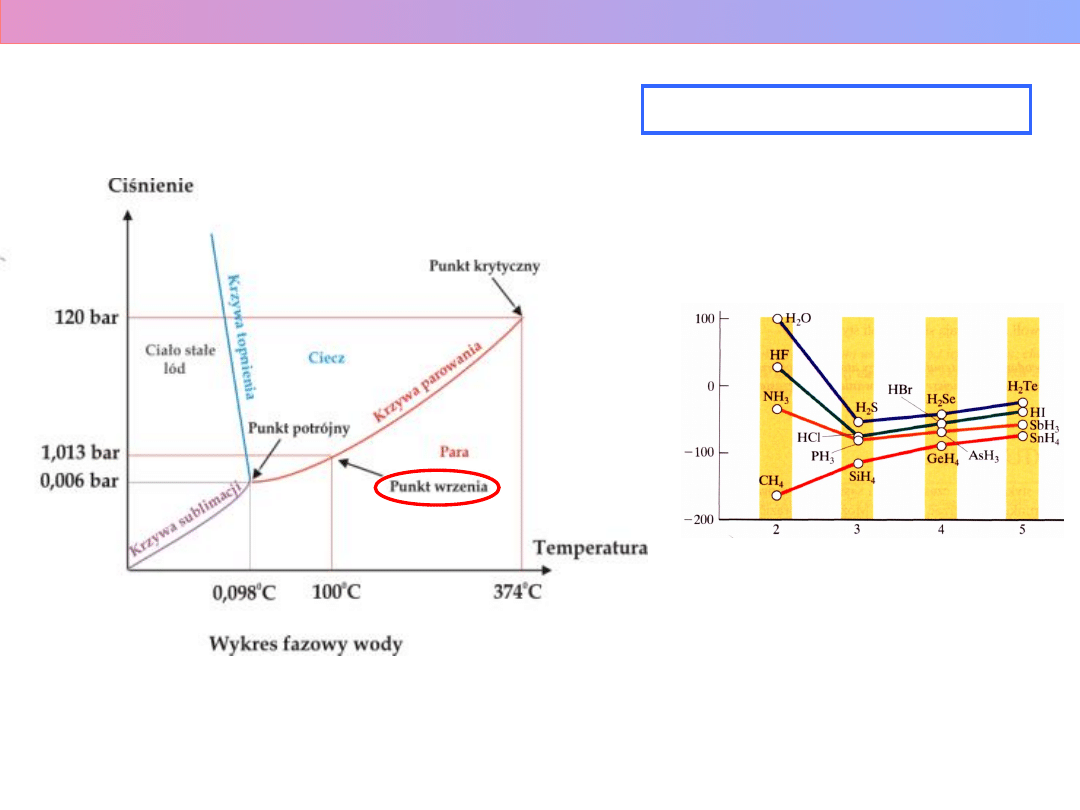
WYKRES FAZOWY WODY
t
w
[C]
okres
1 bar = 10
5
Pa
Wykład 1 – Roztwory i równowagi fazowe
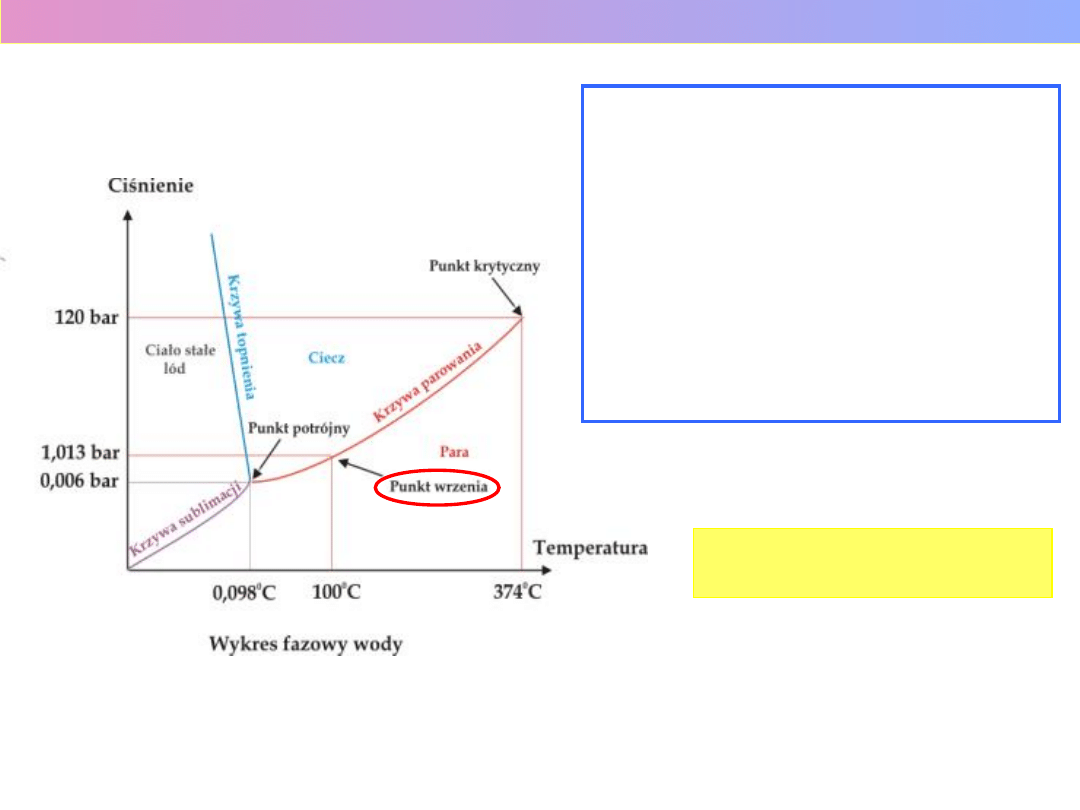
1 bar = 10
5
Pa
STOPNIE SWOBODY (s) –
parametry układu
t – temperatura
p – ciśnienie
c – stężenie
które można zmieniać w
niewielkim zakresie, nie
wywołując zmiany liczby faz
(f)
REGUŁA FAZ GIBBSA
f + s = n + 2
n – liczba
niezależnych
składników
Wykład 1 – Roztwory i równowagi fazowe
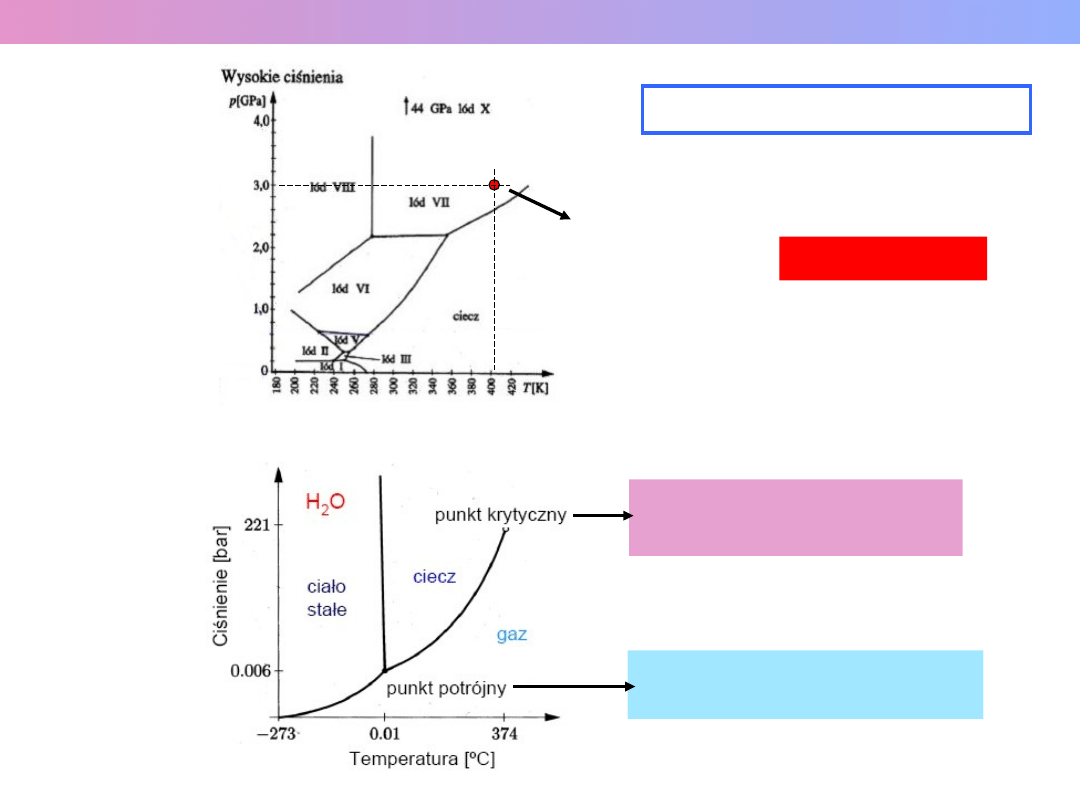
WYKRES FAZOWY WODY
T
K
= 647,2 K (374 C)
P
K
= 22,14 MPa (218 Atm)
T = 273,1575 K (0,0075 C)
P = 0,6105 kPa (0,006 Atm)
P = 3·10
9
Pa (~30000 Atm)
T = 403 K (
130 C
) –
"gorący lód" !
?
Wykład 1 – Roztwory i równowagi fazowe
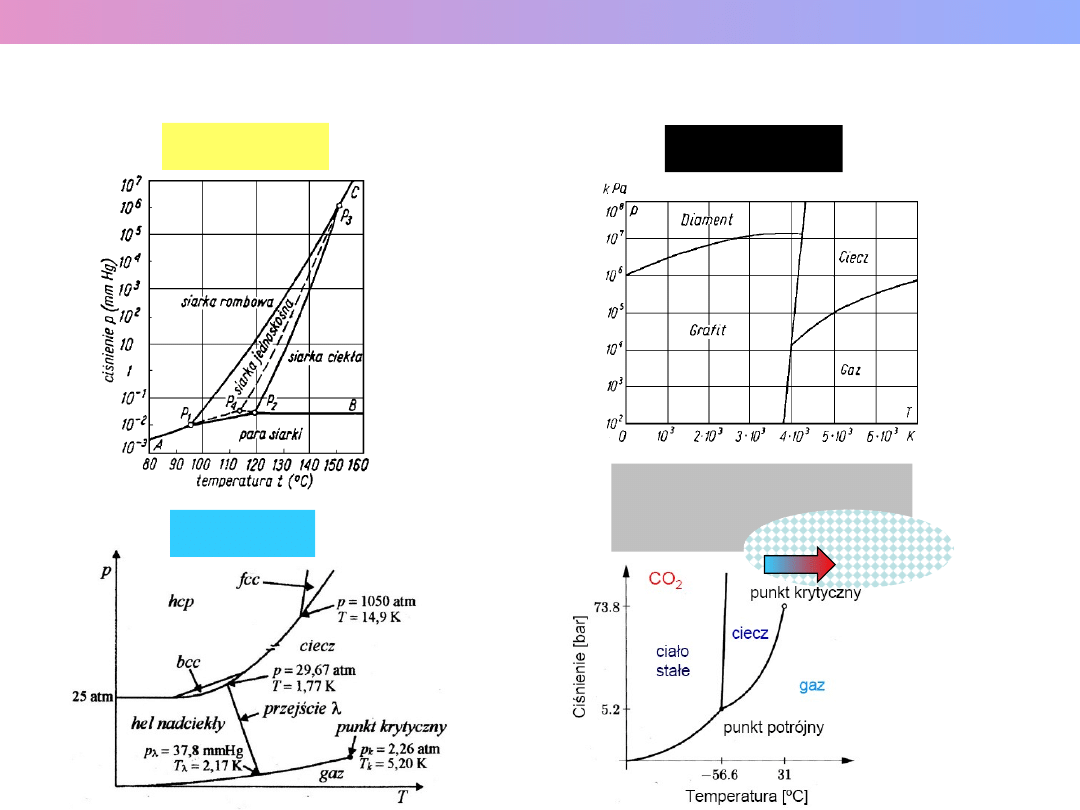
WYKRESY FAZOWE INNYCH SUBSTANCJI
Siarka (S)
Węgiel (C)
Hel (He)
Ditlenek węgla
(CO
2
)
ciecz nadkrytyczna
(superkrytyczna)
Wykład 1 – Roztwory i równowagi fazowe
?
A
B
Temp.
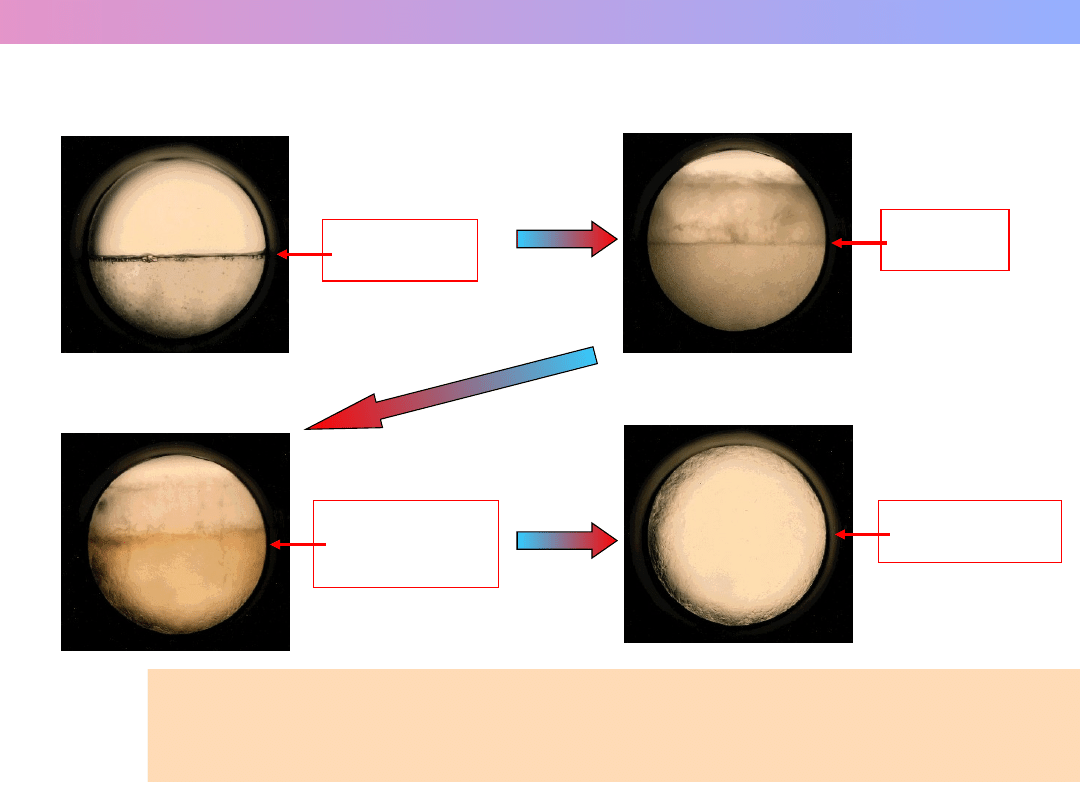
Przemiana ciekłego CO
2
w ciecz superkrytyczną
CIECZ
GAZ
menisk
(granica faz)
Temp.
zanikanie
menisku
wyrównywanie
gęstości
cieczy i gazu
ciecz
superkrytyczna
Superkrytyczny CO
2
– połączenie właściwości cieczy i gazu,
bardzo dobry rozpuszczalnik, łatwo wnika w inne substancje
(ekstrakcja kofeiny z ziaren kawy, pranie chemiczne, polimery i inne).
Wykład 1 – Roztwory i równowagi fazowe
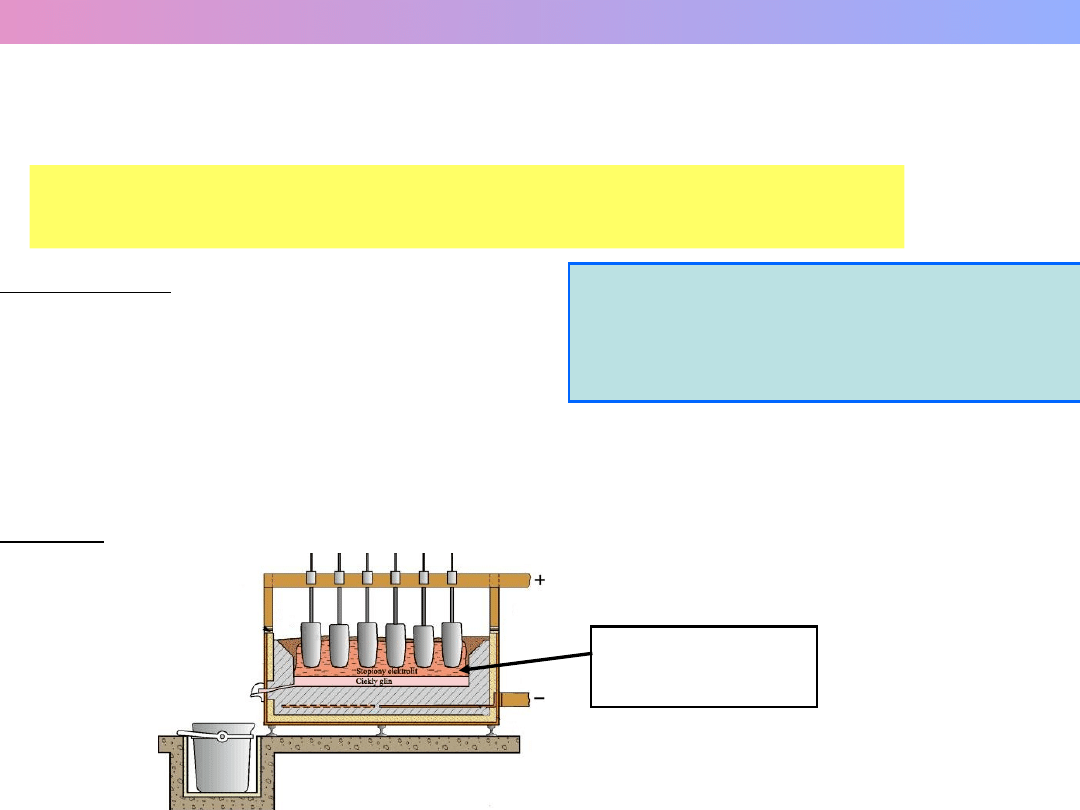
SOLE STOPIONE – CIECZE JONOWE
JAKO ROZPUSZCZALNIKI
Sole lub mieszaniny soli o budowie jonowej i
stosunkowo niskiej temperaturze topnienia.
Wykład 1 – Roztwory i równowagi fazowe
Właściwości:
•
zdolność rozpuszczania różnych substancji
• bardzo mała prężność par
• niepalność,
• stabilność termiczna (nawet do 600 K),
• szeroki zakres występowania w stanie ciekłym
Przykład: elektrolityczne otrzymywanie glinu w stopionym kriolicie (Na
3
AlF
6
)
Al
2
O
3
w Na
3
AlF
6
T ≈ 1200 K
LiNO
3
(44) + KNO
3
(56) – 125 C
ZnCl
2
(60) + NaCl (20) + KCl (20) – 203 C
CuCl (54) + AgCl (46) – 260 C
NaCl (52) + CaCl
2
(48) – 500 C
T
top..
Al
2
O
3
– 2318 K
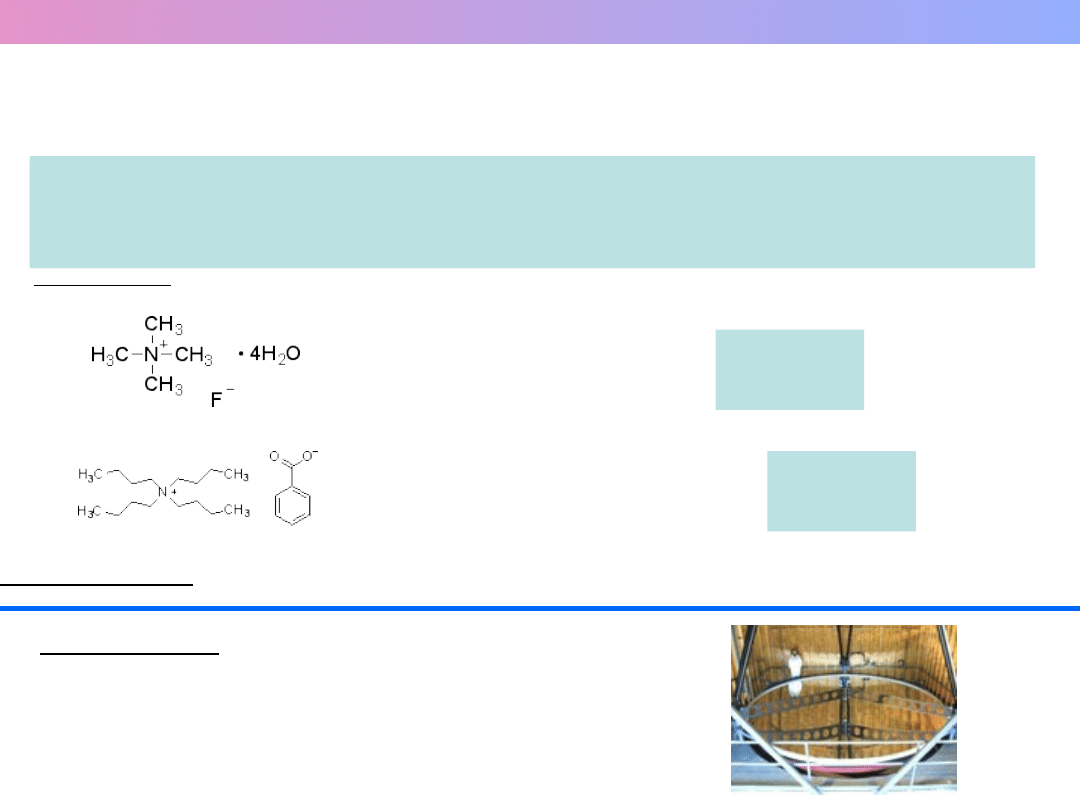
SOLE STOPIONE – CIECZE JONOWE
JAKO ROZPUSZCZALNIKI
Ciecze jonowe –
sole związków organicznych
– rozpuszczalniki
projektowane
(często ciekłe w temperaturze poniżej 100 C)
Wykład 1 – Roztwory i równowagi fazowe
Przykłady:
fluorek tetrametyloamonowy t
top.
= 45
C
benzoesan tetrabutyloamonowy t
top.
= 54
C
Zastosowania: głównie w syntezie organicznej –
"green solvents"
Ciekawostka: obracający się zbiornik z cieczą
jonową jako lustro teleskopu

ROZTWORY
Roztwór – układ jednofazowy, wieloskładnikowy.
Rozpuszczalnik – substancja która w roztworze zachowuje swój
pierwotny stan skupienia, lub występuje w
największej ilości.
Rodzaje roztworów: (wg. stanu skupienia)
R
O
Z
P
U
S
Z
C
Z
A
LN
IK
SUBSTANCJA ROZPUSZCZONA
GAZ
CIECZ
C. STAŁE
GAZ
CIECZ
C. STAŁE
PRZYKŁADY
Powietrze
O
2
w wodzie
H
2
w palladzie
C
2
H
5
OH
w wodzie
NaCl
w wodzie
woda
w maśle
węgiel w żelazie,
szkło
(mgła, areozol)
(dym,kurz)
Wykład 1 – Roztwory i równowagi fazowe
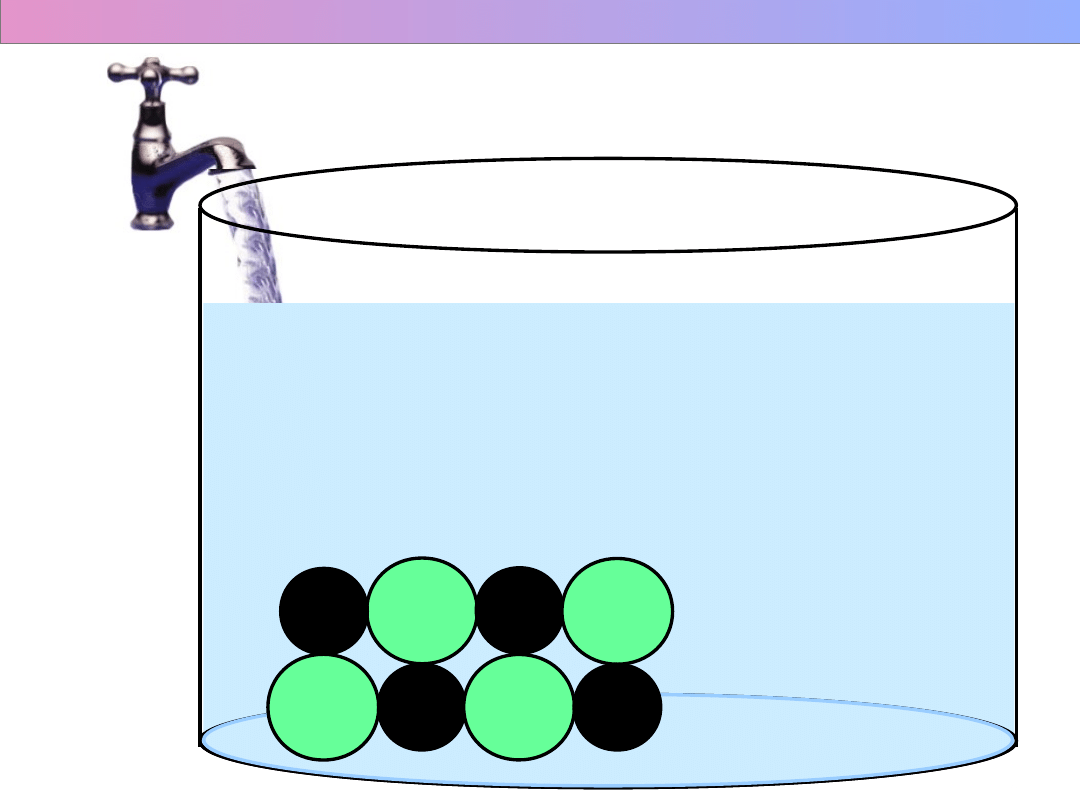
Na
+
Cl
-
Cl
-
Na
+
Na
+
Na
+
Cl
-
Cl
-
Procesy towarzyszące rozpuszczaniu
Wykład 1 – Roztwory i równowagi fazowe
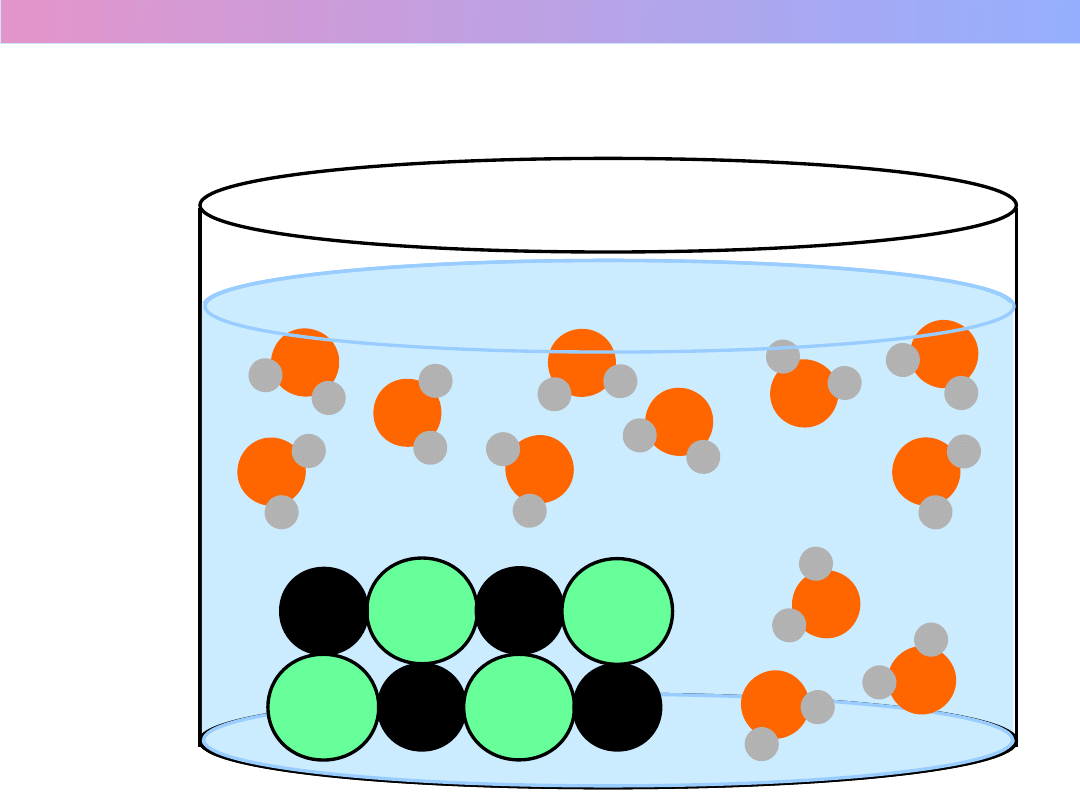
Na
+
Cl
-
Cl
-
Na
+
Na
+
Na
+
Cl
-
Cl
-
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
+
+
−
1.
Odrywani
e
jonów od
kryształu
2.
Hydratacj
a
jonu
(solwatacja
)
Procesy towarzyszące rozpuszczaniu
3. Dyfuzja
jonów
w głąb
roztwor
u
Wykład 1 – Roztwory i równowagi fazowe
ENTALPIA (ciepło) ROZPUSZCZANIA
ΔH
rozp.
= ΔH
zr.w.
+ ΔH
hydr.
ΔH
zr.w.
– zrywanie wiązań –
proces
ENDOTERMICZNY
ΔH
hydr.
– hydratacja –
tworzenie wiązań
proces
EGZOTERMICZNY
ΔH
hydr.
> ΔH
zr.w.
ΔH
hydr.
< ΔH
zr.w.
rozpuszczanie egzotermiczne
rozpuszczanie endotermiczne
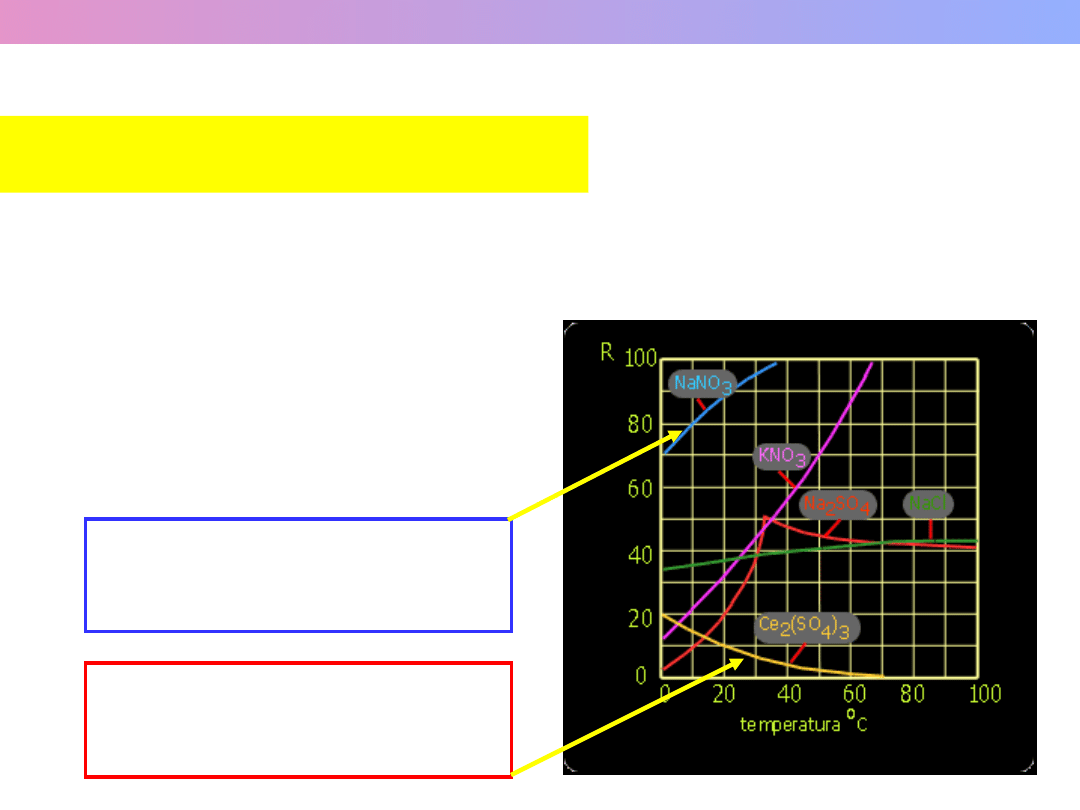
Zależność rozpuszczalności
(R) od temperatury
(Reguła Przekory)
Wykład 1 – Roztwory i równowagi fazowe
WYBRANE WŁAŚCIWOŚCI FIZYCZNE ROZTWORÓW
1. Prężność par rozpuszczalnika nad roztworem
Prawo Roaulta
Francois Marie Raoult (1830-1901)
P
rozp.
= x
rozp.
P
rozp.
0
2. Obniżenie temperatury krzepnięcia roztworu
Efekt krioskopowy
Δt
k.
= k
k.·
m
i.
k
k
– stała kriosopowa
H
2
O - 1,86
K·kg/mol
Efekt ebulioskopowy Δt
e.
= k
e.·
m
i.
k
e
– stała ebulioskopowa
m
i
–
stężenie molalne
.
H
2
O - 0,513
K·kg/mol
Efekty krio- i ebulioskopowy można wykorzystać do
wyznaczenia masy molowej substancji rozpuszczonej.
Wykład 1 – Roztwory i równowagi fazowe

3. Osmoza - gr. osmós "ciśnienie" - dyfuzja cząsteczek
rozpuszczalnika,
(np. wody) przez membranę półprzepuszczalną, (np. błonę
komórkową) oddzielającą dwa roztwory
Wykład 1 – Roztwory i równowagi fazowe
WYBRANE WŁAŚCIWOŚCI FIZYCZNE ROZTWORÓW
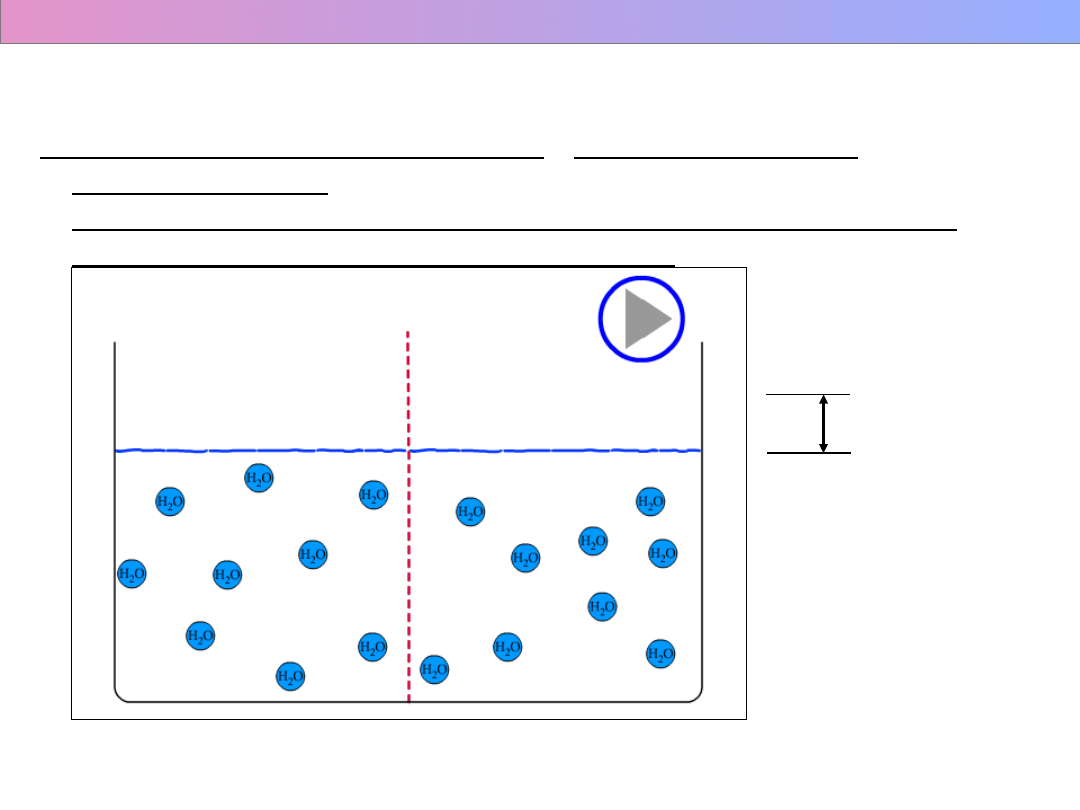
3. Osmoza - gr. osmós "ciśnienie" - dyfuzja cząsteczek
rozpuszczalnika,
(np. wody) przez membranę półprzepuszczalną, (np. błonę
komórkową) oddzielającą dwa roztwory
P
0
> P
roztw.
Wykład 1 – Roztwory i równowagi fazowe
h
Ciśnienie hydrostatyczne
P
h
= g h d = π
π
– ciśnienie osmotyczne
WYBRANE WŁAŚCIWOŚCI FIZYCZNE ROZTWORÓW

Wykład 1 – Roztwory i równowagi fazowe
Ciśnienie osmotyczne -
π
n
π = c R T = V R T
π V = n R T
Równanie Van’t Hoffa
Jacobus Henricus van 't Hof
(1852 – 1911)
Nobel 1901
Wielkość ciśnienia osmotycznego:
0,01 M roztwór cukru daje
π
= 250 kPa
(2,5 m słupa H
2
O)
Pomiar ciśnienia osmotycznego
wykorzystuje się do wyznaczania mas
molowych
Ważna rola osmozy w biologii.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Stany skupienia przemiany fazowe roztwory dyfuzja
3 Przemiany fazowe w stopach żelazaPrzemiana martenzytycznaSem2010
01 roztwory buforoweid 2924 Nieznany
MEW8 przemiany fazowe 24 03 2011
Ćwiczenie 7 Przemiany fazowe ze stanu ciekłego w stan stały
4 Przemiany fazowePrzemiana binitycznaSem2010
Wyklad 6 Przemiany Fazowe
Przemiany fazowe, Studia - materiały, Chemia fizyczna
01 roztwory buforowe
01 Roztwory
01 roztwory buforowe 2id 2925 Nieznany (2)
07 Przemiany fazowe i uklady zl Nieznany
01 Pomiar przesuniecia fazowegoid (2)
Transformator jednofazowy, Szkoła, Politechnika 1- 5 sem, SEM IV, Maszyny Elektryczne. Laboratorium,
3 Przemiany fazowe w stopach żelazaPrzemiana martenzytycznaSem2010
01 roztwory buforoweid 2924 Nieznany
więcej podobnych podstron