
Zespół ostrych zaburzeń
oddechowych
(ARDS - Acute Respiratory Distress
Syndrome)
Klinika Chirurgii Ogólnej i
Torakochirurgii
Szpitala Klinicznego nr.2 im.WAM
Uniwersytetu Medycznego w Łodzi
Kierownik: prof..dr hab.med. Marian
Brocki
Opracował: dr n.med. Jacek Kordiak

ARDS - definicja
Ostra niewydolność oddechowa
spowodowana zwiększoną
przepuszczalnością bariery
pęcherzykowo-włośniczkowej
(niekardiogenny obrzęk płuc)

Kliniczne przyczyny ARDS
Bezpośrednie Pośrednie
1. Aspiracja treści 1. Wstrząs
żołądkowej 2. Posocznica
2. Inhalacja toksycznych 3. Uraz
wielonarządowy
par i gazów 4. Masywne
przetoczenia
3. Zator płuc krwi
4. Stłuczenie płuc 5. Ostre zapalenie
trzustki
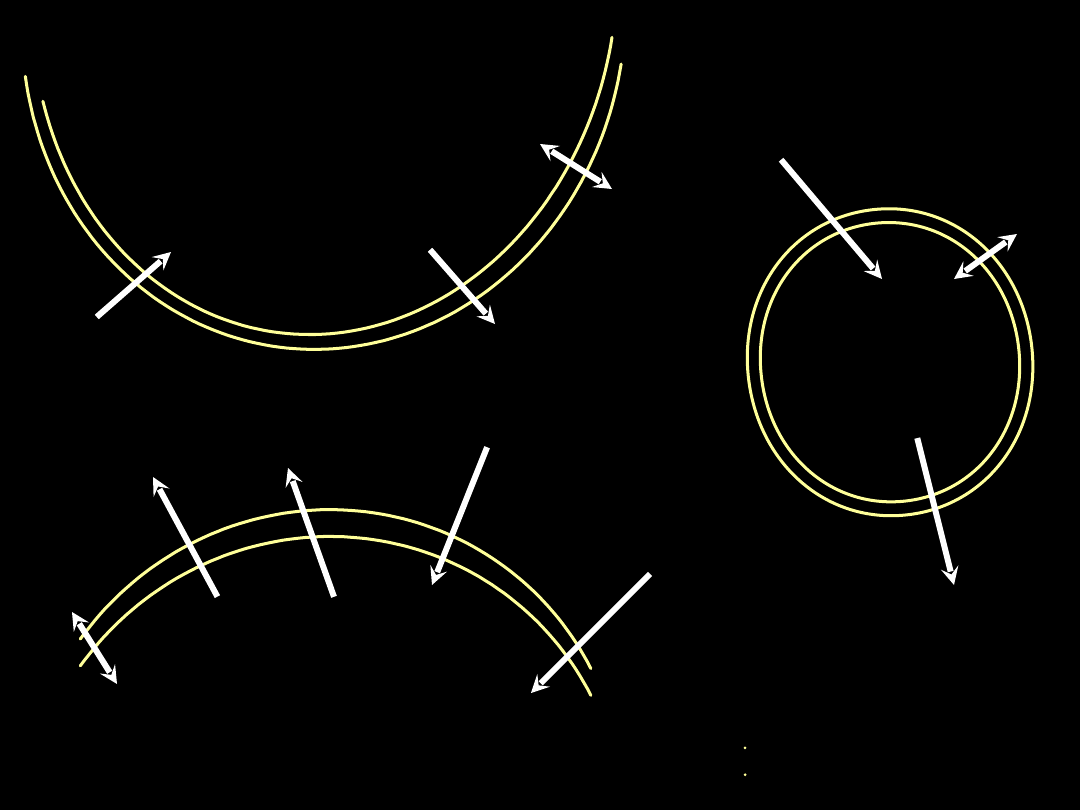
Naczynie
limfatyczne
Limfatycz
ne
ciśnienie
onkotyczn
e
Limfatyczne
ciśnienie
hydrostatycz
ne
Przestrzeń
śródmiąższowa
Pęcherzyk
płucny
Włośniczka
płucna
Napięcie
powierzch-
niowe
Ciśnienie
śródpęche-
rzykowe
Ciśnienie
hydrosta-
tyczne
Ciśnienie
onkotyczne
Śródmiąższowe
ciśnienie
onkotyczne
Śródmiąższowe
ciśnienie
hydrostatyczne
P
P
P
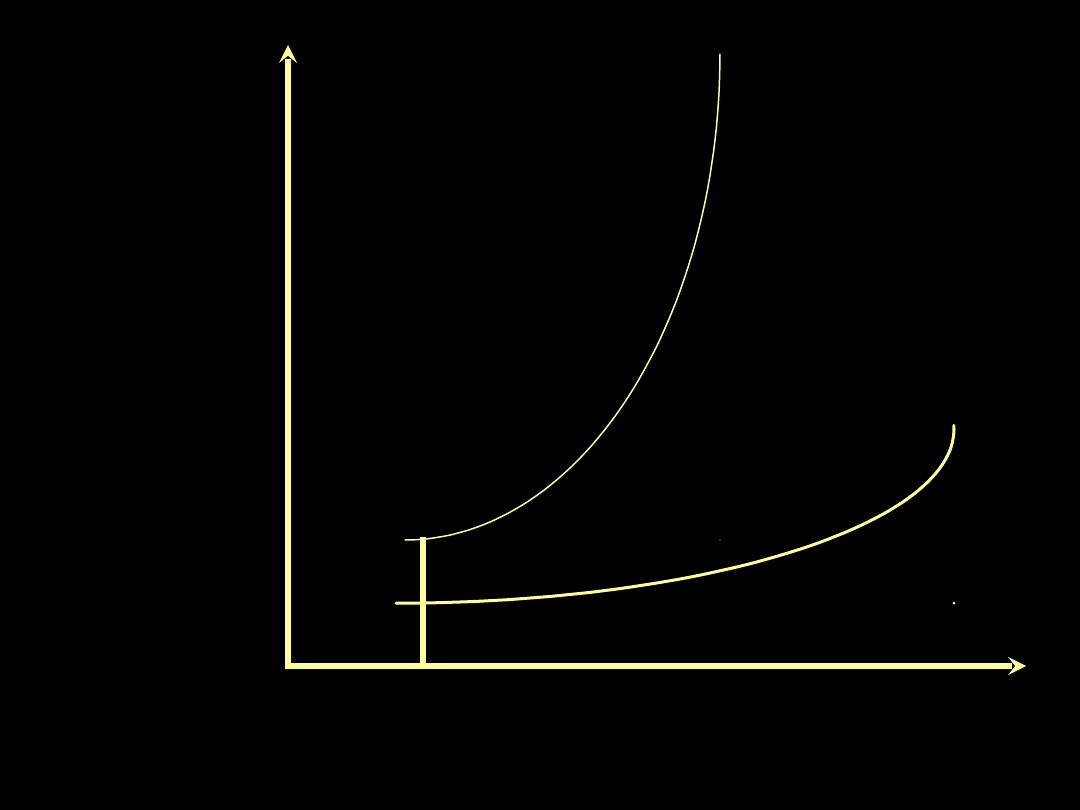
Ciśnienie hydrostatyczne
włośniczki płucnej
Ilość
przesączu
do przestrzeni
śródmiąższowej
Płuco
uszkodzone
(ALI)
Płuco
zdrowe
10
mmHg
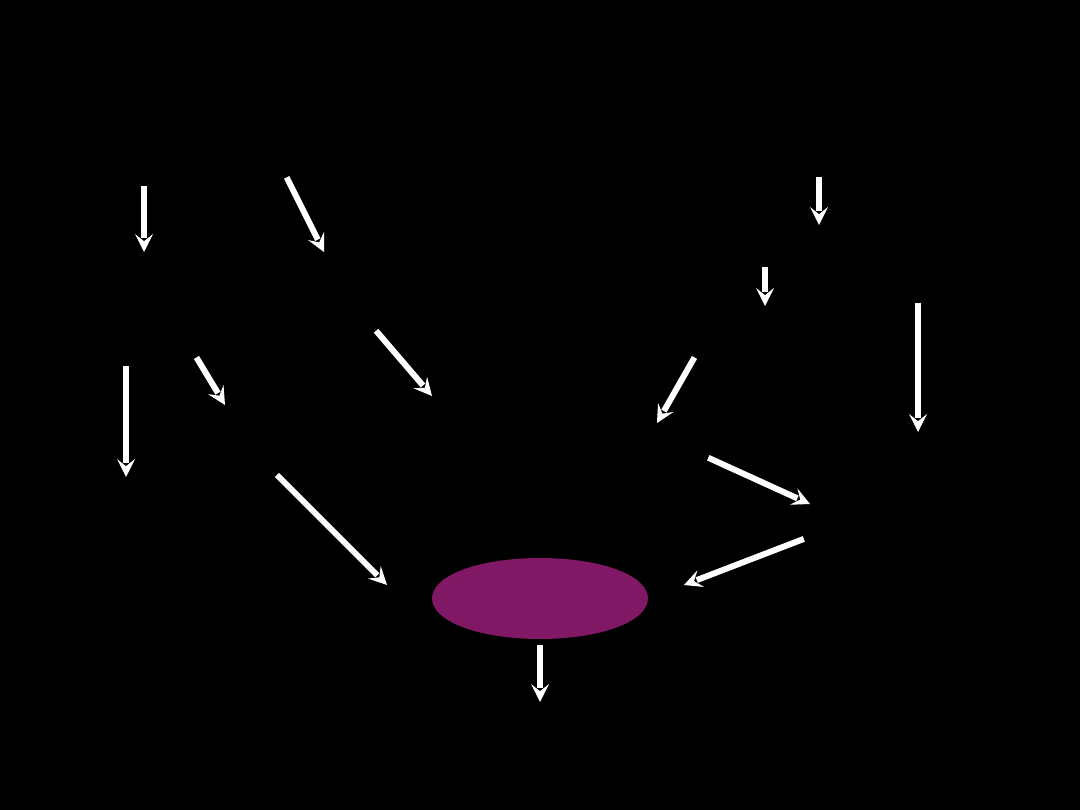
ARDS - patofizjologia
Czynnik pośredni
Czynnik bezpośredni
SIRS
ARDS MODS
Aktywacja
kaskady
krzepnięcia
Aktywacja
dopełniacza
Aktywacja makrofagów
Uwolnienie
cytokin
Eikosanoidy
Wolne rodniki
Proteazy
Aktywacja
i degranulacja
neutrofili
Kininy
Produkty
fibrynolizy

Mediatory egzogenne
ARDS
1. Endotoksyna (LPS)
2. Egzotoksyny
3. Mykotoksyny
Ponad połowa przypadków ARDS
wywołana jest mediatorami
uwalnianymi w procesie zakażenia

Mediatory endogenne ARDS
Uwalniane przez neutrofile, limfocyty,
makrofagi, fibroblasty, pneumocyty
1. TNF-α
2. Interleukiny (IL-1,IL-6,IL-8 w
uszkodzeniu
bezpośrednim - płuco respiratorowe!! )
3. Eikosanoidy (tromboksan, leukotrieny)
4. Wolne rodniki
- obniżony poziom antyoksydantów
- wzrost poziomu enzymów pro-
oksygenacyjnych:
peroksydazy lipidowej, oksydazy
ksantynowej
i indukowalnej syntetazy NO
Stres oksydacyjny głównym inicjatorem
wewnątrzkomórkowej reakcji zapalnej!!
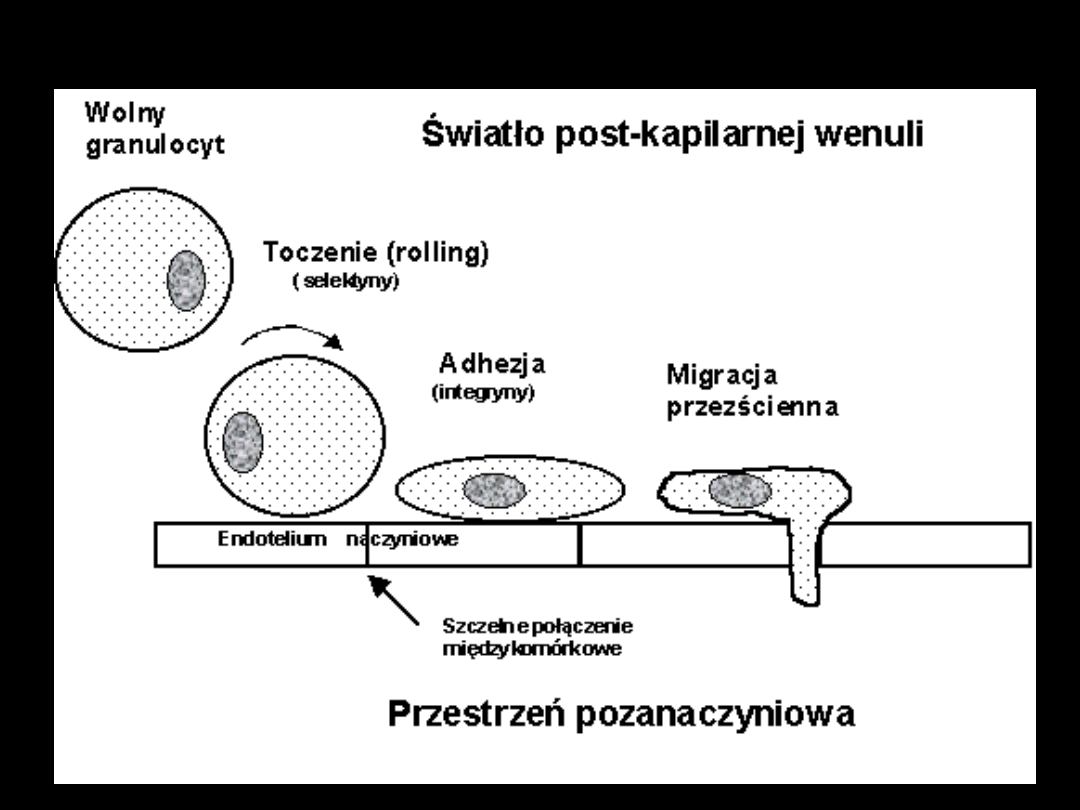
Rola granulocytów w ARDS

Molekuły adhezyjne w
ARDS
Obecne na granulocytach oraz komórkach
endotelium
Warunkują proces migracji leukocytów poza
naczynie
1. Toczenie granulocytów („rolling”)
- selektyny E,P i L (na powierzchni
granulocytów)
- ICAM-1, VCAM-2 (na powierzchni endotelium)
2. Przytwierdzanie granulocytów (silna
adhezja)
- integryny (CD11b, CD18)
W ARDS wzrost ekspresji molekuł adhezyjnych na
powierzchni komórek oraz wzrost stężenia
frakcji rozpuszczalnych w osoczu

Endotelium a mediatory w
ARDS
Śródbłonek płucny jest szczególnie
narażony:
1. Słabsze połączenia międzykomórkowe
2. Cały rzut serca perfunduje płuca
(ekspozycja na wszystkie krążące mediatory)
3. Płuca dla swej funkcji muszą być
„suche”
Atak mediatorów skierowany jest
przeciwko endotelium włośniczkowemu
w całym ustroju (MODS)!
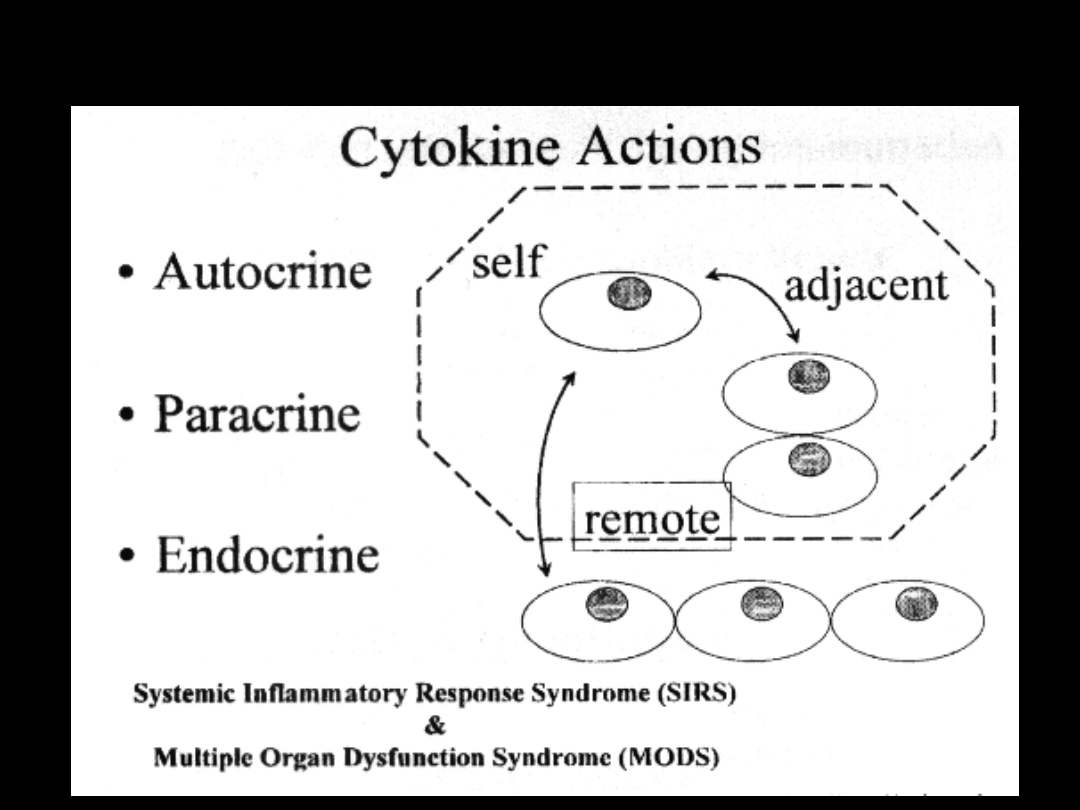
Patofizjologia SIRS

SIRS - nieadekwatna
odpowiedź immunologiczna
Ogólnoustrojowe pobudzenie leukocytów,
fibroblastów, komórek mezo- i
endotelium (wskutek sygnalizacji
endokrynowej!)
Markery SIRS
1. Wzrost ekspresji CD11b i CD18
(integryny)
2. Wzrost osoczowego stężenia IL-6
3. Osłabiona reakcja granulocyów na
stymulację in vitro przez TNF-α

SIRS - etiologia
1. Zakażenie
2. Rozległy uraz
3. Oparzenie
4. Zapalenie trzustki
5. Wstrząs
6. Krążenie
pozaustrojowe

SIRS - kryteria kliniczne
Bone RC et al.Consensus Conference.
Chest 1992,101:1656
1. Temperatura ciała > 38
o
C, albo < 36
o
C
2. Częstość tętna > 90/min
3. Częstość oddechu > 20/min,
albo PaCO
2
< 32 mmHg,
4. Liczba leukocytów > 12 000/mm
3
,
albo < 4000/mm
3
,
albo > 10% form niedojrzałych.

SIRS - problem kliniczny
Brun-Buisson C. Intens.Care Med.2000,26:S64
1. 50% wszystkich chorych w ogólnych
OIOM
2. 80% chorych w chirurgicznych OIOM
3. 60% chorych z rozległym urazem
Konsekwencje SIRS
1. 30% rozwija się sepsis
2. 10-15% wstrząs septyczny
3. 10-15% ARDS
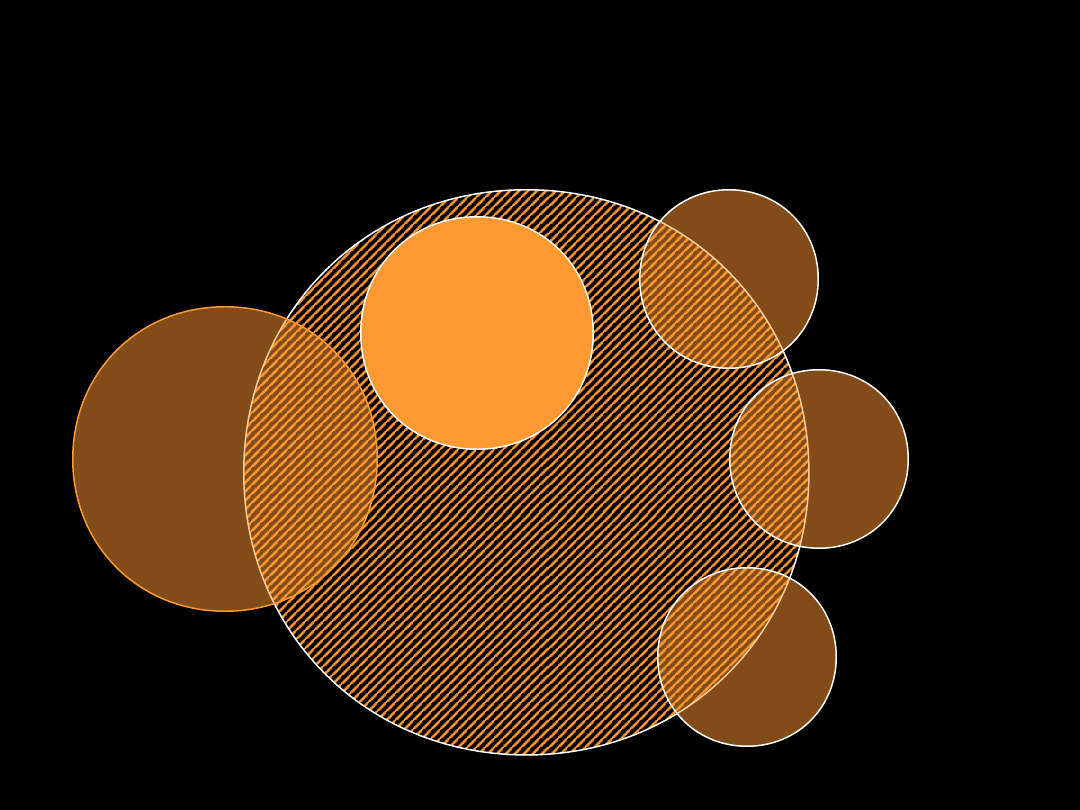
Uogólniony odczyn zapalny
Systemic inflamatory response syndrome
(SIRS)
SEPSIS
ARDS
MODS
INFEKCJA
SIRS
Wstrząs
Oparzenie
Pancreatitis

ALI i ARDS - kryteria
(The North Am.-European Consensus
Conference on ARDS - 1993)
ALI
1. Hipoksemia - PaO
2
/FiO
2
< 300, niezależnie od
PEEP
2. Obustronne zagęszczenia w radiogramie płuc
3. PCWP < 18 mmHg, albo brak dowodów
(klinicznych,
echokardiograficznych i radiologicznych) na
wzrost
ciśnienia w lewym przedsionku.
ARDS
1. Hipoksemia - PaO
2
/FiO
2
< 200, niezależnie od
PEEP
2 i 3 kryterium jak wyżej

ARDS - kryteria L I S (lung injury
score)
Murray JF. 1988r
1.Radiogram klatki :
Brak ognisk niedodmy rozsianej
0
Ogniska obejmują: 1 kwadrant
1
2
kwadranty 2
3
kwadranty 3
4
kwadranty 4
2. Hipoksemia
(PaO
2
/FiO
2
):
ponad 300
0
225 - 299
1
175 - 224
2
100 -174
3
poniżej 100
4
Oceniane kryteria i punktacja
3. Wielkość PEEP-u (w cmH
2
O):
poniżej 5
0
6 - 8
1
9 - 11
2
12 - 14
3
powyżej 15
4
4. Podatność w ml/cm H
2
O:
powyżej 80
0
60 - 79
1
40 - 59
2
20 - 19
3
poniżej 19
4
Sumę punktów podzielić przez liczbę kryteriów. Wyniki:
0 pkt - płuca nieuszkodzone
0,1-2,5 pkt - uszkodzenie średniego
stopnia
powyżej 2,5 pkt - ciężkie uszkodzenie płuc
(ARDS)
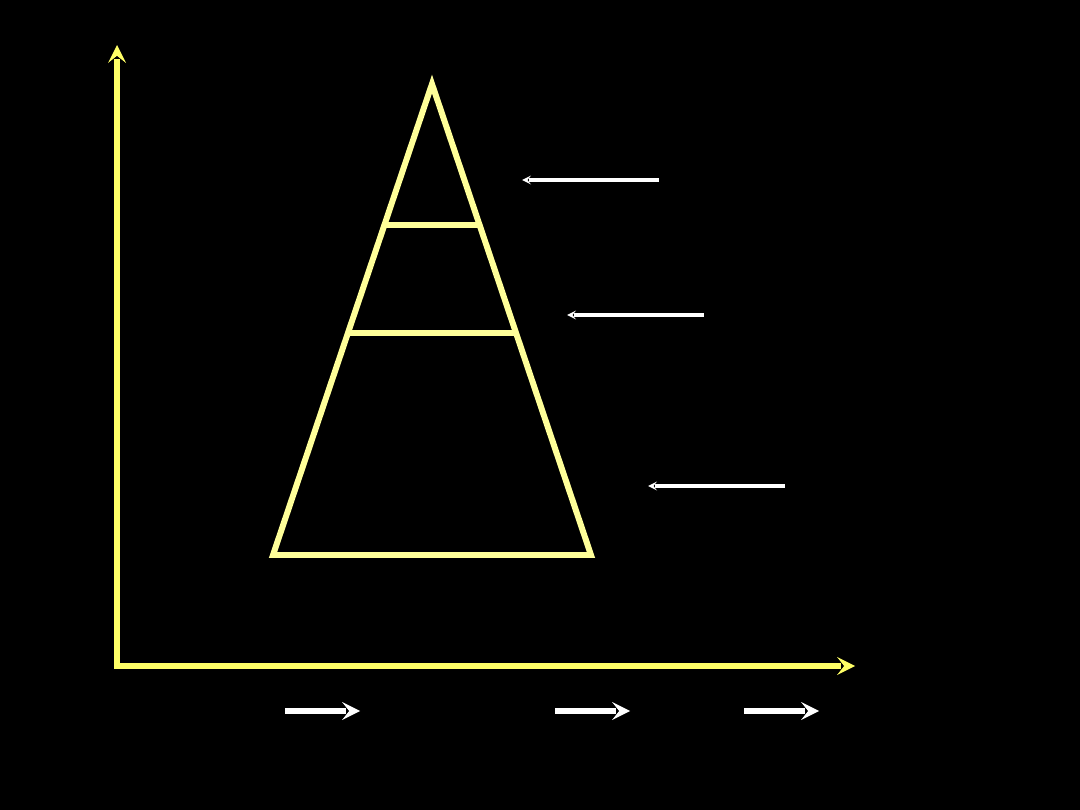
W pełni
rozwinięty
ARDS
ONO nie spełniająca
kryteriów ARDS
Subkliniczne
uszkodzenie
płuc
80%
16%
4%
Mediator
Aktywacja
leukocytów
SIRS
ALI
ALI - acute lung injury

ARDS - epidemiologia
ALI
od 15 do 70 przypadków rocznie
na 100 tys. mieszkańców
ARDS
od 1,5 do 13,5 przypadków rocznie
na 100 tys. mieszkańców

ARDS - etiologia I
(Villar i wsp. Intens.Care Med. 1999,25:930)
Wyjściowe Po 24 godz.
Po 24 godz.
ARDS
ALI
ARDS
Uraz
17
13
4
Aspiracja 13 8
5 Sepsis
11 3
8
Pneumonia
9 5
4
Pancreatitis
4 1
3
Eclampsia 1 1
-
Zatrucie
1 -
1
Liczba całk. 56 31 25

ARDS - etiologia II
(Roupie i wsp. Intens.Care Med.
1999,25:920)
ARDS ALI
Pozostali
Niewydolność lewokomorowa 0 0
41
Zaostrzenie COPD 2 3
31
Bezpośrednie uszkodzenie płuc
- infekcja płucna 16 10
16
- aspiracja 13 0
15
- inne 4 0
3
Sepsis pochodzenia brzusznego 21 4
1
Sepsis pozabrzuszna 3 0
2
Inna etiologia
8 0
20
Razem chorych: 67
17
129

Rozpoznanie ARDS - I
1. Radiogram klatki piersiowej
- rozsiane zagęszczenia po 4-24 godz. od
zadziałania
czynnika uszkadzającego (podobne do
zastoinowej
niewydolności krążenia)
- w pełni rozwinięty ARDS - „obraz burzy
śnieżnej”
- silnie zależny od terapii (płyny, wentylacja
mech.)
2. Tomografia komputerowa
- lepsze poznanie patofizjologii ARDS
(L.Gattinoni)
- dobra korelacja obrazu tomograficznego i
klinicznego
- wczesne rozpoznanie powikłań (wolutrauma,
ropień)
3. Gazometria tętnicza
- proste i łatwo dostępne badanie
- w pierwszej fazie hipokapnia obok hipoksemii

Rozpoznanie ARDS - II
4. Integralność bariery pęcherzykowo-
włośniczkowej
- poziom białka w płynie pęcherzykowym
- szbkość przesiękania do pęcherzyków
znakowanych
J
131
albumin
- pomiar pozanaczyniowej wody płucnej:
norma - 500 ml ARDS - 1500 do 3000 ml
5. Popłuczyny oskrzelowe
- łatwe do pobrania u chorych zaintubowanych
- przewaga granulocytów (norma 5%, ARDS do
80%)
- obecność mediatorów (TNF, IL, elastaza,
tromboksan)
- profil cytokinowy (IL-6, IL-8)
6. Monitorowanie hemodynamiczne (c. Swan-
Ganza)
- różnicowanie ARDS z kardiogennym obrzękiem
płuc
- możliwość monitorowania dostawy O
2
i
płynoterapii

Rozpoznanie ARDS - III
mechanika oddychania
1. Podatność płuc (statyczna i dynamiczna)
- spadek podatności z powodu niedodmy rozsianej
(nawet do 20-30 ml/cmH
2
O)
- wzrost elastycznej pracy oddychania
- przeciwdziała PEEP i PEEPi
2. Opór płuc
- spadek ciśnienia przezpłucnego zmniejsza
średnicę
końcowych dróg oddechowych
- wzrost R zwiększa pracę oddychania i zaburza
dystrybucję gazów (pogorszenie oksygenacji)
3. Wewnętrzny PEEP (PEEPi)
- spowodowany zaburzeniami dystrybucji gazów
- możliwy do pomiaru po zatrzymaniu cyklu
oddechowego i zamknięciu obu zastawek na 6-
8sek.
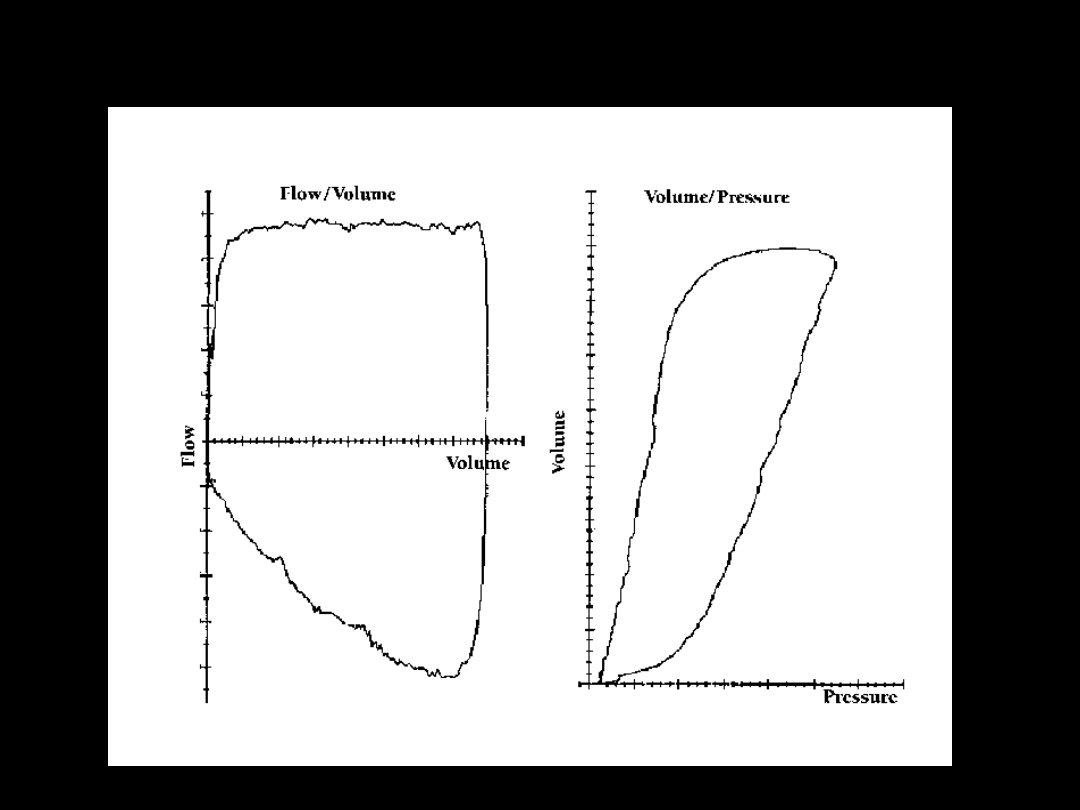
Krzywe F/V i V/P

Leczenie ARDS
1. Wentylacja mechaniczna
- optymalizacja ciśnień w drogach
oddechowych
- wentylacja w ułożeniu na brzuchu
- wentylacja nieinwazyjna
- wentylacja płynowa
2. Zapewnienia strumienia tlenu
(DO
2
)
- wypełnienie łożyska naczyniowego
- utrzymanie rzutu serca (ważne przy
CPAP)
3. Inhalacja tlenku azotu
4. Pozaustrojowa wymiana gazów
5. Próby przyczynowego leczenia
ARDS

Wentylacja mechaniczna
podejście tradycyjne
1. Respirator sterowany objętościowo
2. Dążenie do przywrócenia
„fizjologicznych”
parametrów gazometrycznych
3. Objętość oddechowa 10 - 15 ml/kg
4. Stosunek wdechu do wydechu (I:E) 1:2
- 1:5
5. Adekwatna wartość PEEP (PaO
2
>80
mmHg
przy FiO
2
< 0,5

Respiratorowe uszkodzenie
płuc
(VILI - ventilator-induced lung injury)
1. Nadmierne rozdęcie płuc
(volutrauma)
- szkodliwa objętość, nie ciśnienie (Dreyfuss 1992)
- zmiany mikroskopowe i makroskopowe przy
ciśnieniu > 35 cmH
2
O
- mechaniczne uszkodzenie makrofagów płucnych
uwalnia prozapalne cytokiny IL-1, IL-6 i IL-8
2. Toksyczność tlenu
- efekt cytotoksyczny
- niedodma resorpcyjna
3. Siły ścinające
- powtarzane otwieranie i zapadanie się
pęcherzyków
Obraz morfologiczny respiratorowego
uszkodzenia płuca przypomina dysplazję
oskrzelowo-płucną.

Respiratorowe uszkodzenie
płuc - strategie ochrony
1. Ograniczanie objętości i ciśnienia
- koncepcja
„małych” płuc
, a nie „sztywnych”
( w ARDS obszar powietrzny 30% objętości płuc)
- ograniczanie powoduje wzrost CO
2
oraz
niedodmę
-
planowana hiperkapnia
(wzrost PaCO
2
do 80
mmHg pozwala obniżyć MV do 50%)
- konsekwencje ostrej hiperkapnii: wzrost
przepływu
mózgowego, kwasica, hipertensja płucna i
systemowa
2. Rekrutacja pęcherzyków
- PEEP (ważne mPaw)
podstawowy sposób
rekrutacji
- plateau ciśnieniowe na szczycie wdechu (np. 40
cmH
2
O przez okres 20-40 sek., powtarzać co 4
godz.)
- podobny efekt „westchnienie” TV 15ml/kg 2-
3x/min.
3. Minimalizacja FiO
2

Wentylacja mechaniczna
podejście zmodyfikowane
1. Ograniczanie ciśnienia w drogach
oddechowych (PCV)
2. Permisywna hiperkapnia
3. Objętość oddechowa 5 - 8 ml/kg c.c.
4. Manewr rekrutacji pęcherzyków co 4
godz.
5. PEEP 7 - 10 cm H
2
O
6. Zwiększenie mPaw zmianą stosunku
I:E
7. Techniki specjalne: HFV, APRV, tlenek
azotu

Wyniki kliniczne nowej
strategii
1. Efekty korzystne:
- Amato- (N.Engl.J.Med.1998,338:347): 53 chorych z ARDS w
technice PCV z rekrutacją i „optimal PEEP” - znamiennie
niższa
śmiertelność .
- Foti-(Intens.Care.Med..2000,26:501):15 chorych z ARDS
PCV z
niskim PEEP i rekrutacją oraz wysokim PEEP bez rekrutacji.
Pierwszy sposób efektywniejszy dla mechaniki i wymiany
gazowej
- ARDS Network (N.Engl.J.Med. 2000,342:1301)
Wieloośrodkowe
badania NHLI. V
T
6 ml/kg oraz rekrutacja zmniejszyły
smiertelność
o 22% w
porównaniu
do V
T
12ml/kg.
2. Brak korzyści w porównaniu z wentylacją
tradycyjną:
- Brochard (Am.J.Respir.Crit.Care Med. 1998,158:1831): 108
chorych z ARDS (LIS > 2,5). (PIP< 25 cmH
2
O , VT 8 ml/kg).
Brak różnic w śmiertelności.
- Brower (Crit.Care Med. 1999,27:1492): 52 chorych z ARDS
(pełne kryteria) (PIP< 30 cmH
2
O, V
T
7 ml/kg ).
Brak różnic
w śmier-telności.
- Eisner (Am.J.Respir.Crit.Care Med.. 2001,194:231) Badania
wielo-
ośrodkowe u 433 chorych z ALI i ARDS. Nie wykazano
różnicy
w śmiertelności pomiędzy V
T
6ml/kg i 12 ml/kg.

Techniki wentylacji mechanicznej I
(podział ze względu na ciśnienie w drogach
oddech.)
1. CPAP
- PEEP nosowy i na maskę
2. Wentylacja z ograniczeniem
cisnienia
(PCV - pressure controled
ventilation)
3. Wentylacja z odwróceniem stosunku
I:E
(IRV - inversed ratio ventilation)
4. APRV i BIPAP

Wentylacja CPAP
continuous positive airway
pressure
1. Zwiększa powietrzność płuc, a tym
samym
skuteczność wymiany gazowej w
płucach
2. Może uzupełniać oddech samoistny
oraz
wentylację mechaniczną
3. Nie stosować wartości < 5 i >15 cmH
2
O
4. „Optimal PEEP” = maksymalny
strumień O
2
- pomiar rzutu minutowego serca
- ocena krzywej ciśnieniowo-
objętościowej
5. Nasal PEEP - w mniej nasilonych ALI
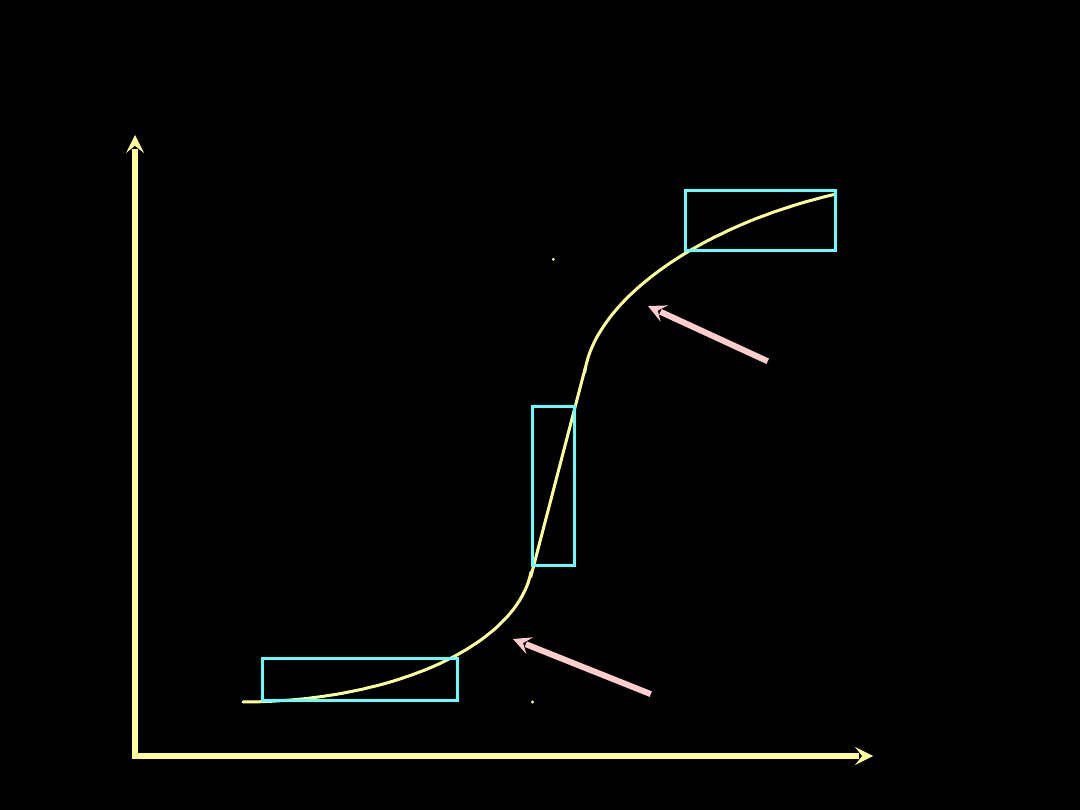
Krzywa ciśnieniowo - objętościowa
V
P
TV
1
TV
2
TV
3
Paw
3
Paw
2
Paw
1
Dolne
ugięcie
Górne
ugięcie
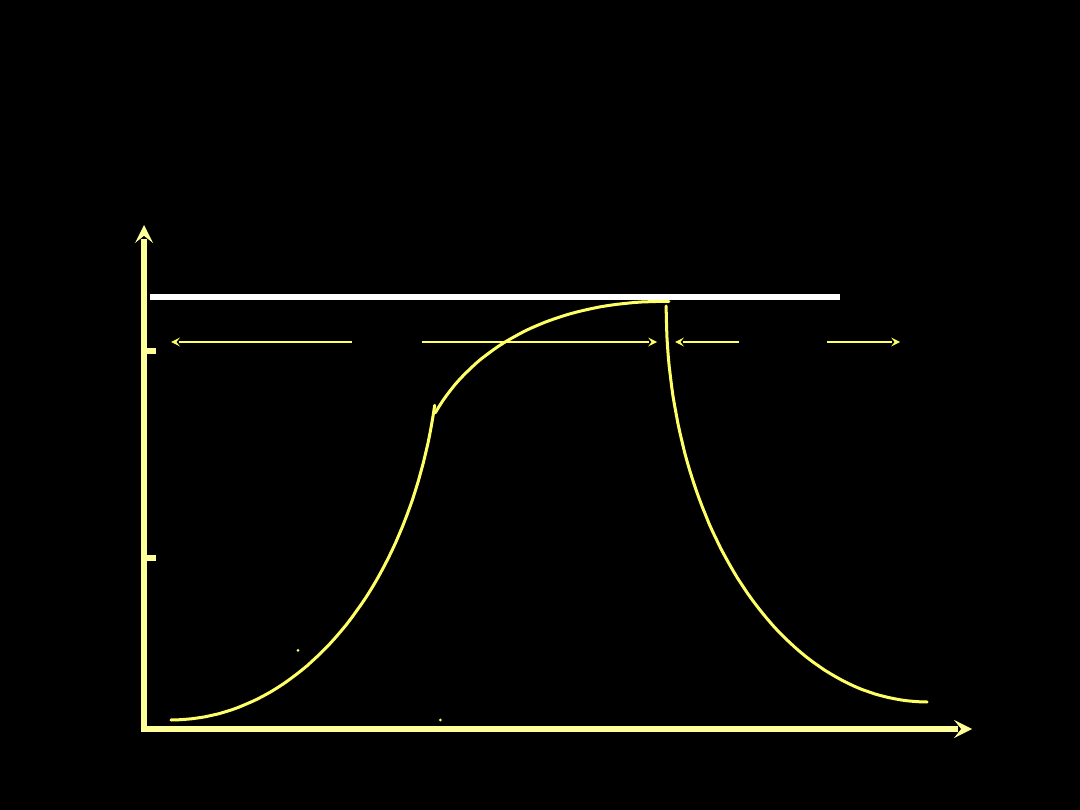
Wentylacja z ograniczeniem
ciśnienia
PCV - pressure controlled ventilation
P
20
10
T
T
I
Pmax
T
E

Wentylacja z ograniczeniem
ciśnienia
PCV - pressure controlled
ventilation
Zalety:
1. Niższe ciśnienie szczytowe
2. Mniejsze zaburzenia V/Q
(wydłużenie fazy wdechu PCV-IRV)
Wady:
1. Wzrost średniego ciśnienia z efektem
kardiodepresyjnym
2. Możliwy wzrost PEEP
I
3. Przy b.długim T
I
spadek wentylacji minutowej

Wentylacja z odwróceniem I:E
IRV - Inversed ratio ventilation
1. Jest sposobem obniżenia ciśnień
szczyto-
wych przy braku opcji PCV
2. Korzystny wpływ na wymianę gazową
może
ujawnić się po dłuższym czasie (30-60
min.)
3. Dobre efekty u dzieci
4. Wskazaniem jest hipoksemia tętnicza
przy
PEEP 15 cm H
2
O
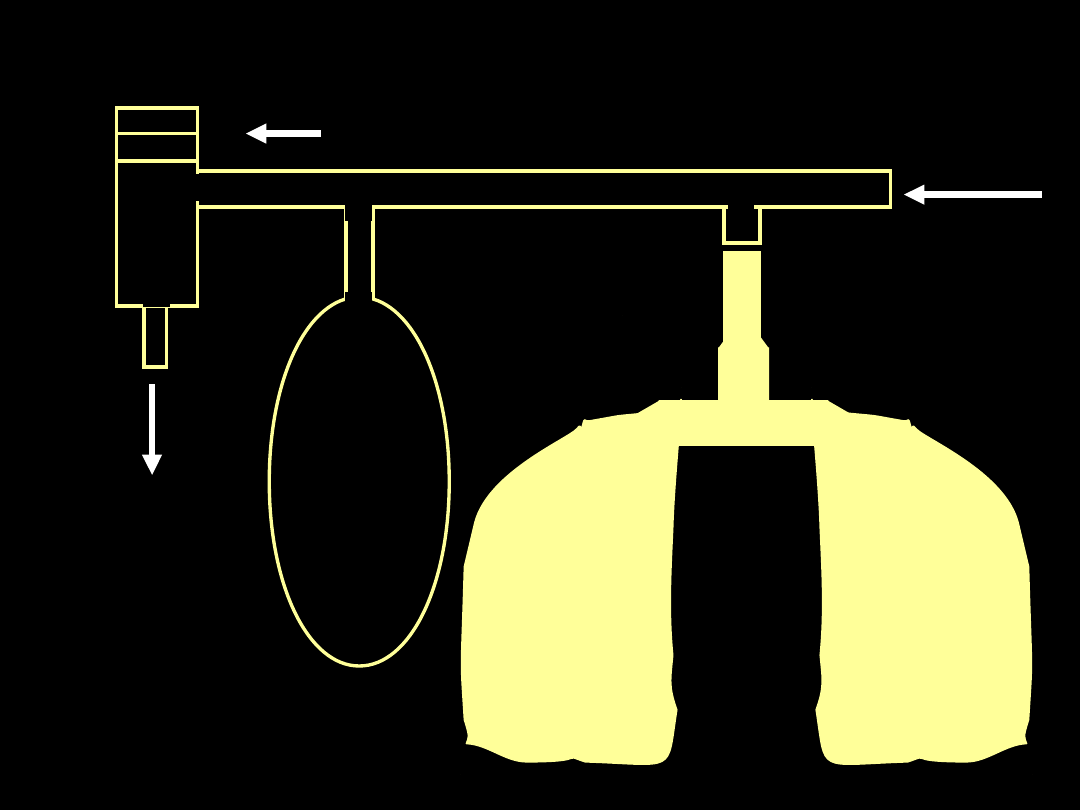
APRV - układ Oddechowy
Mieszanina
oddechowa
Zastawka CPAP
sterowana
elektronicznie
Worek
wyrównawczy
Wydech
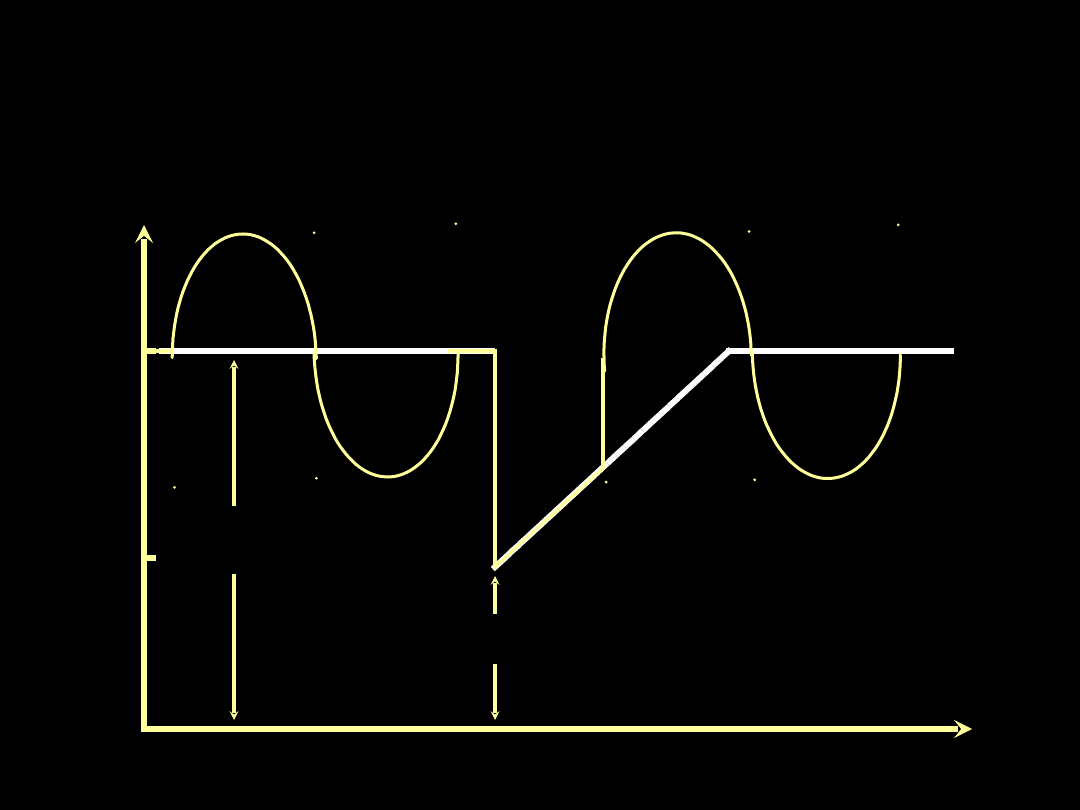
Wentylacja ze spadkiem ciśnienia
w drogach oddechowych
(APRV-airway pressure release ventilation)
Paw cmH
2
O
15
8
PEEP
1
(FRC
1
)
PEEP
2
(FRC
2
)
Przy C
L
70
ml/cmH
2
O
ΔFRC = 500 ml

Techniki wentylacji mechanicznej
II
(podział ze względu na inicjację fazy wdechu)
1. Wentylacja kontrolowana
- CMV-continous mechanical ventilation
- CV- controlled ventilation
2. Wentylacja A/C (assisted-controlled)
3. Wentylacja okresowo wymuszana
- SIMV- synchronized intermittent ventilation
2. Wentylacja wspomagana
- ciśnieniem (PSV - pressure support
ventilation)
- przepływem (FSV - flow support ventilation)
- proporcjonalnie wspomagana (PAV -
proprtional
assist ventilation)

Pressure Support Ventilation
(Inspiratory Assist Ventilation)
1. Inicjacja wdechu przez chorego
2. Mechaniczna komponenta wdechu do
uzyskania
zaprogramowanego ciśnienia wspomagania
(chory kontroluje częstość i obętość
oddechową)
3. Zakończenie wdechu:
- przekroczenie ciśnienia wspomagania o 1,5
cmH
2
O
- spadek przepływu poniżej 0,1 l/sek.
4. Przy niskim ciśnieniu wspomagania (< 10
cmH
2
O)
wyłącznie kompensacja oporów oddechowych
5. Przy wyższym ciśnieniu wspomagania
właściwa
assist ventilation

Proportional assist
ventilation
1. Najnowsza technika wentylacji wspomaganej
2. Wspomagany każdy oddech chorego, przy czym
-
wspomaganie nie jest sztywno zaprogramowane (jak w
PSV)
-
proporcjonalne do aktualnego wysiłku oddechowego
3. Wymaga wysokiej klasy respiratora oraz
złożonego
oprogramowania (feed-back potrzebuje
rzetelnych
parametrów wyjściowych.
4.
Po pomiarze mechaniki oddychania (R i C)
respirator
dobiera wielkość “partycypacji” w pracy
elastycznej
(PSV) oraz pracy nieelastycznej (FSV).
5. Sprawdza się w ARDS ze skrajnymi
zaburzeniami
mechaniki oddychania.

Flow - by
1. Technika dostarczania gazu do układu
odde-
chowego podczas wentylacji
spontanicznej
2. W systemie „na żądanie” inicjacja
przepływu
w fazie wdechu podciśnieniem (zwłoka
0,1-
0,4 sek.)
3. W systemie Flow-by stały przepływ
gazu w
układzie oddechowym 5-20 l/min, a
inicjacja
wdechu przyśpiesza przepływ w 0,02
sek.

Wentylacja na brzuchu
1. Skuteczność u około 50% chorych z
ARDS
- zastosowana po raz pierwszy w 1977
- utwalona poprawa oksygenacji
- utrudnienie pielęgnacji u dorosłych
2. Nie jest formą fizykoterapii !
- przy zmianie pozycji migracja zagęszczeń
do dolnych segmentów już po 15 min.
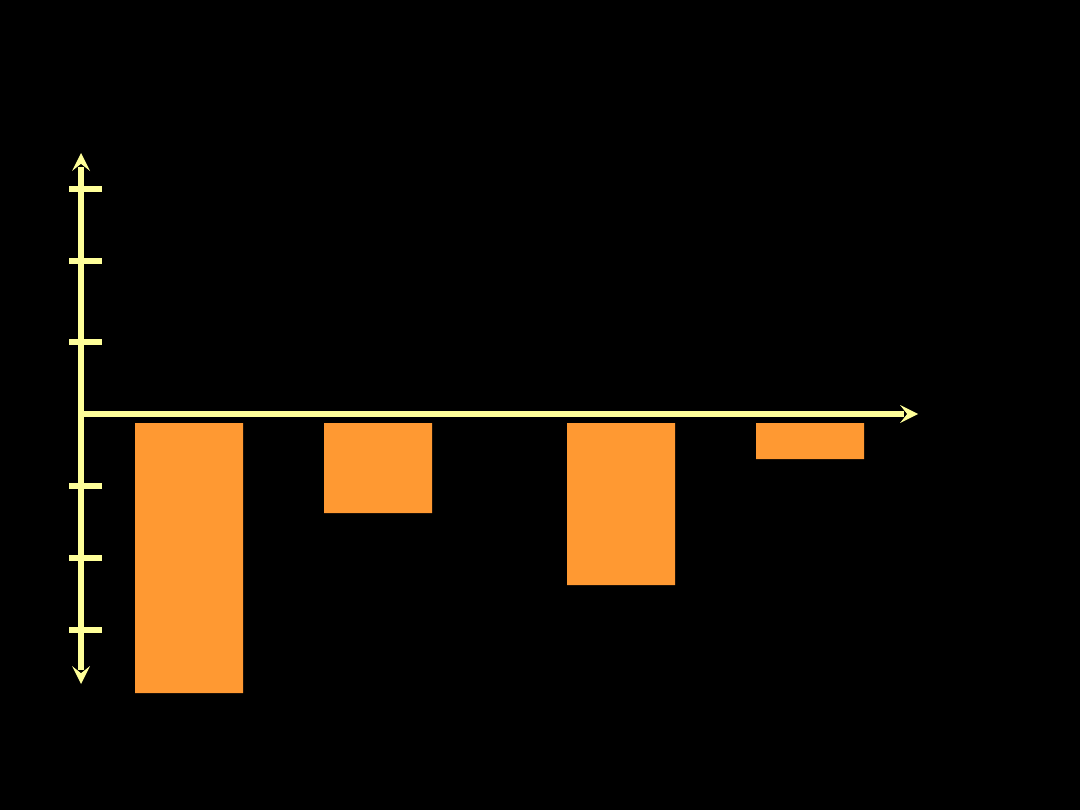
Ciśnienie śródopłucnowe przy
zmianie pozycji ciała (płuco
zdrowe)
Ppl cmH
2
O
3
2
1
-1
-2
-3
Góra Dół
Góra Dół
Na plecach
Na brzuchu
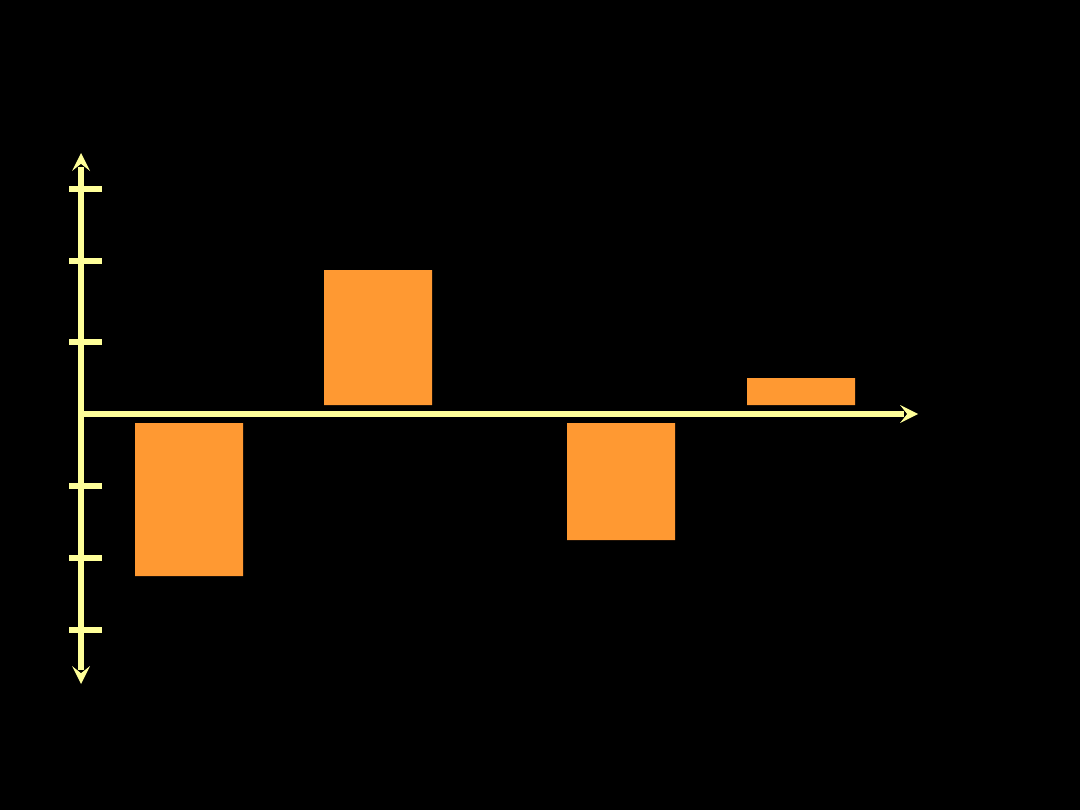
Ciśnienie śródopłucnowe przy
zmianie pozycji ciała (ARDS)
Ppl cmH
2
O
3
2
1
-1
-2
-3
Góra Dół
Góra Dół
Na plecach
Na brzuchu
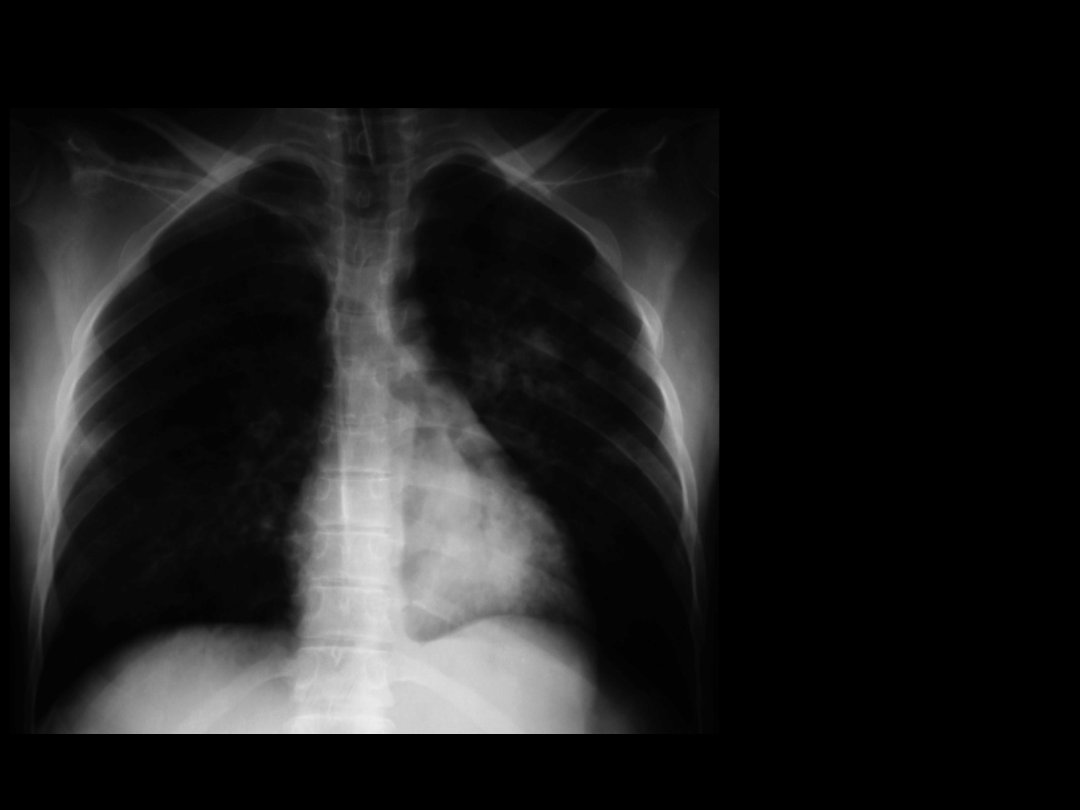
Zespół Mendelsona I
Chora l.24
1 doba pobytu
(6 g. po aspiracji)
CMV PEEP 10
cmH
2
O
FiO
2
0,5
PaO
2
86 mmHg
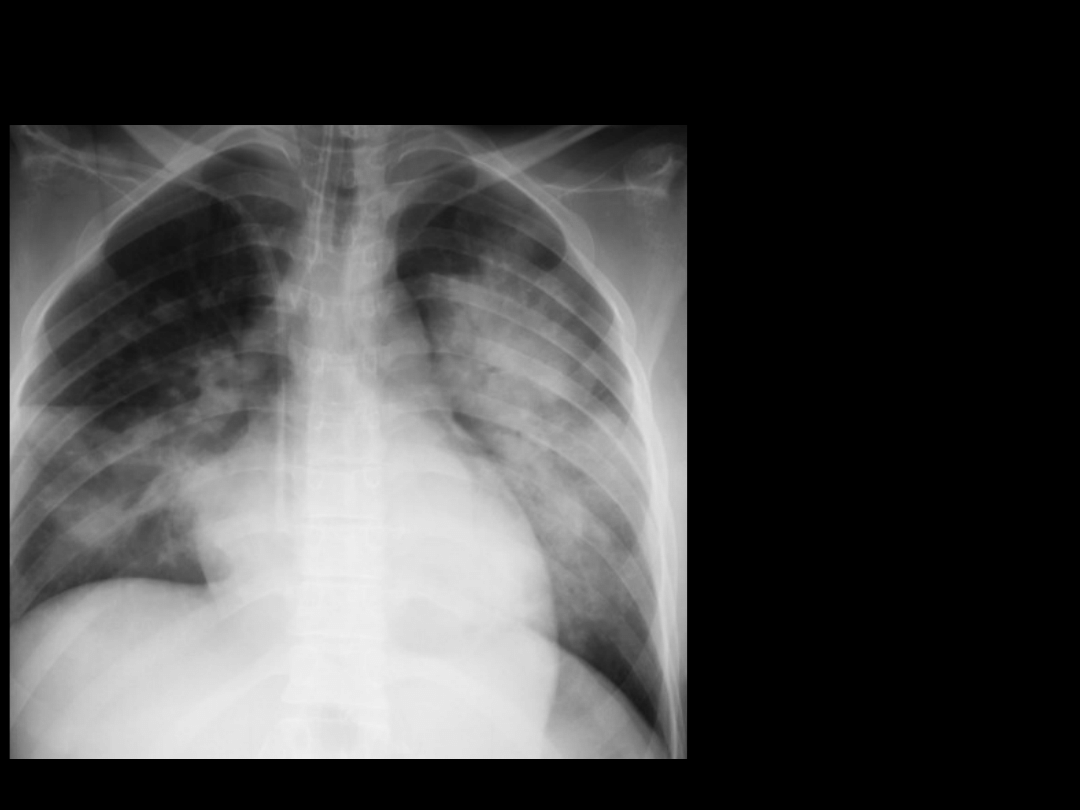
Zespół Mendelsona II
2 doba pobytu
CMV+PCV
PEEP 16 cmH
2
O
FiO
2
0,8
PaO
2
63 mmHg
PaCO
2
69 mmHg
Po 1 g. Od
przełożenia
na brzuch:
FiO
2
0,8
PaO
2
133 mmHg
PaCO
2
51 mmHg
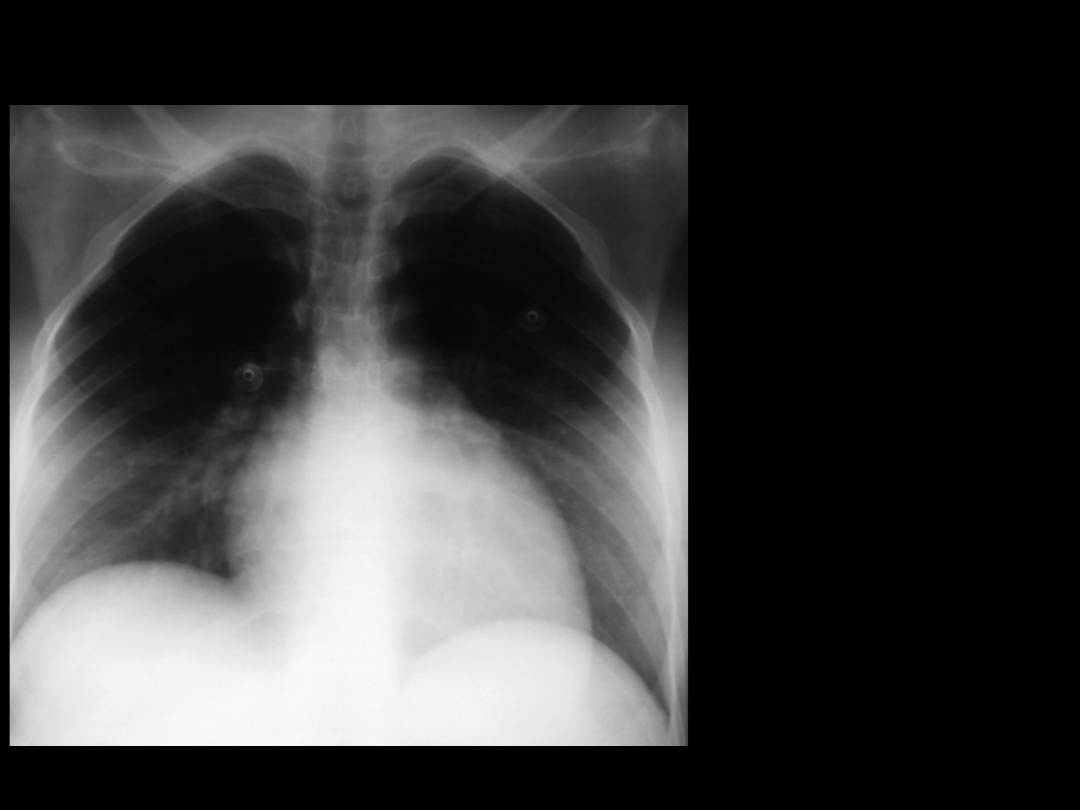
Zespół Mendelsona III
4 doba pobytu
(po 48 g. na
brzuchu)
CMV+PCV
PEEP 10 cmH
2
O
FiO
2
0,4
PaO
2
97 mmHg
PaCO
2
34 mmHg
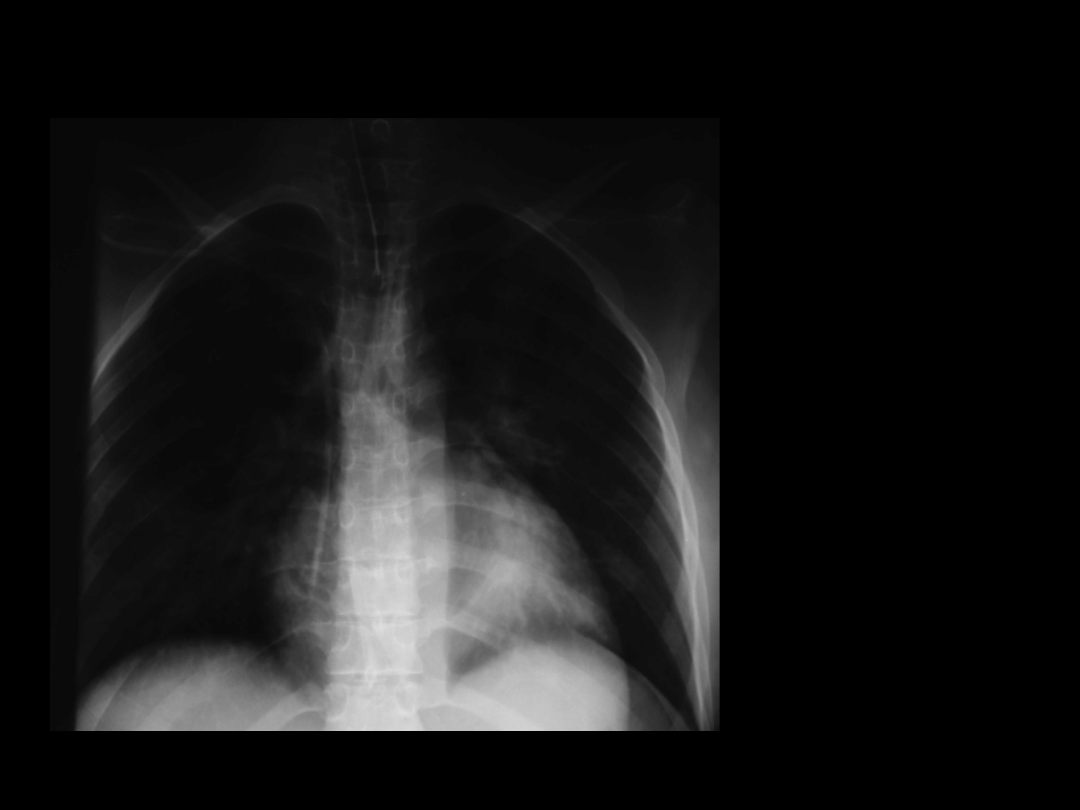
Zespół Mendelsona IV
7 doba pobytu
PSV 10 cmH
2
O
PEEP 5 cmH
2
O
FiO
2
0,3
PaO
2
92 mmHg
PaCO
2
37 mmHg
Rozintubowana
z powodzeniem
w następnej
dobie

Wentylacja szybka
HFV - High frequency ventilation
Częstotliwość
oddychania
Objętość
oddechowa
HFFPV
60 - 120 ( 2 Hz) TV > V
D
HFJV
120 - 600 (2-10 Hz) TV = V
D
HFO
600 - 3000 ( 10-50 Hz) TV < V
D

Wentylacja szybka - zalety i
wady
1. Zalety:
- niskie wartości średniego i szczytowego
Paw
- mały wpływ na układ krążenia
- dobra tolerancja (mniej środków
sedacyjnych
i zwiotczających)
- wentylacja z wyboru w przetoce
oskrzelowo-
opłucnowej i oderwaniu oskrzela
2. Wady:
- wymaga specjalnego respiratora
- trudne nawilżanie gazów
- brak monitorowania parametrów
wentylacji
- odruchowo wyłącza oddech spontaniczny

Wentylacja z użyciem
fluorokarbonu
1.Podanie fluorokarbonu (PFC) do płuc
powoduje:
- spadek napięcia powierzchniowego na granicy
faz
- poprawę rekrutacji pęcherzyków płucnych
(wzrost FRC i podatności
2. Cechy fizyczne PFC
- niskie napięcie powierzchniowe (15-19 dyn/cm)
- dobra rozpuszczalność dla O
2
i CO
2
- słabe wchłanianie z pęcherzyków
3. Przydatność kliniczna
TLV - total liquid ventilation
- wymaga specjalnego respiratora
- wysoka praca nieelastyczna (duży opór przepływu)
PLV - partial liquid ventilation
- jako jedyna znajduje zastosowanie kliniczne
Aerozol fluorokarbonowy
- technika najnowsza

Częściowa wentylacja
płynowa
1. Zalety:
- standardowy respirator
- niski opór przepływu
- natychmiastowa poprawa mechaniki
oddychania i oksygenacji
Nie wykazano wpływu na przeżywalność
chorych z ARDS!
2: Wykonanie:
- płuca wypełniane PFC do objętości FRC (30
ml/kg)
- dystrybucja grawitacyjna- gromadzi się w
segmen-
tach niedodmowych
- codzienne uzupełnianie ubytku PFC (parowanie
oraz
odsysanie)

Aerozol fluorokarbonowy
1. Wzorem użycie aerozolu surfaktantu
2. Technika najbardziej zbliżona do
konwencjonalnej wentylacji mechanicznej
3. Niskie zużycie PFC
- 10 ml/kg/godz. z nawilżacza dyszowego
- 2 godziny podawania aerozolu PFC powoduje 6-
8
godzin znaczącej poprawy wymiany gazowej
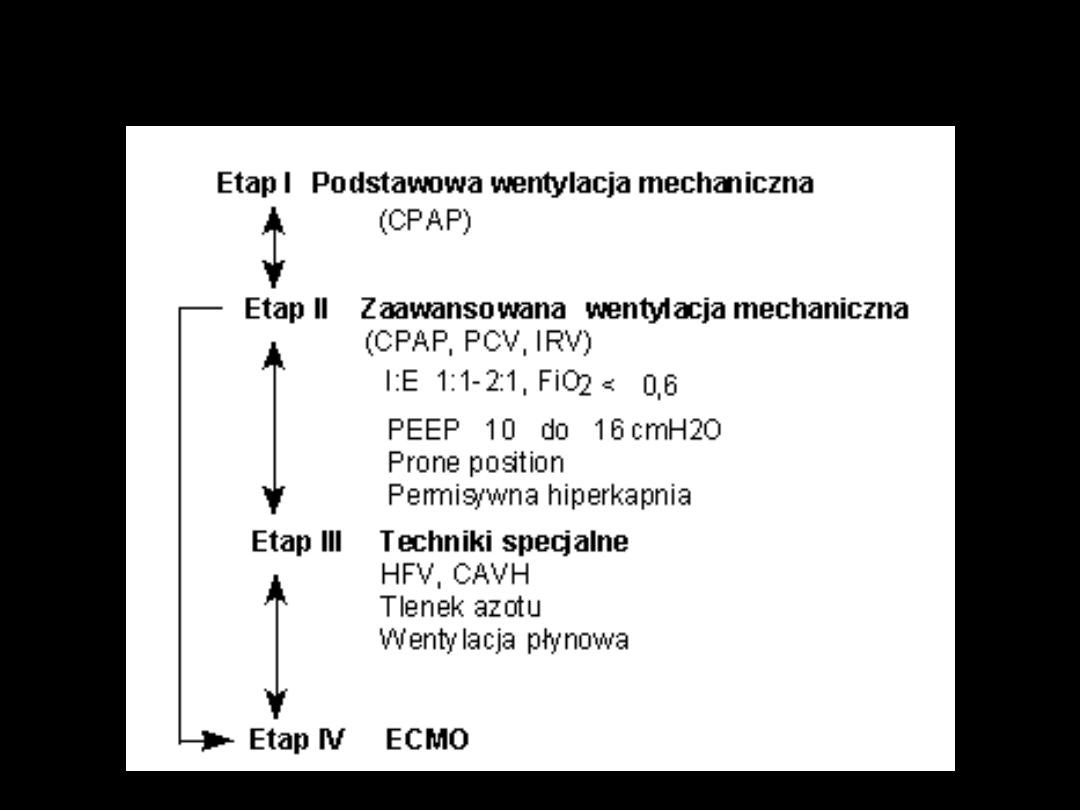
Algorytm wentylacji mechanicznej

Zaawansowana wentylacja
mechaniczna
wybór techniki i parametrów respiratora
1. Tryb pracy:
- w I fazie oddech kontrolowany (AC, CMV)
- po opanowaniu najgłębszych zaburzeń IMV, PSV
2. Parametry wyjściowe:
FiO
2
1,0, TV 5-8 ml/kg, f 25-30/min., PEEP 5-15
cmH
2
O
Należy dążyć , aby PIP < 40 cmH
2
O
3. Zmiany parametrów
- po każdej zmianie ocena możliwa dopiero po15
min.
- kontrolować mPaw przy każdej zmianie
czegokolwiek
- przy słabej oksygenacji zwiększać PEEP o 5
cmH
2
O,
później IRV, prone position
- przy zwiększaniu częstości pamiętać o iPEEP
4. Brak poprawy - techniki specjalne:
HFJV,
NO

Zaprzestanie wentylacji
mechanicznej I
Warunki:
1. Stabiny układ krążenia
(bez katecholamin)
2. Zadowolająca wymiana gazowa
(PEEP 5 cmH
2
O, FIO
2
0,3)
3. sprawna płytka nerwowo-mięśniowa
(uwaga na steroidy i środki zwiotczające)
Nieudane, powtarzane próby
zakończenia wentylacji mechanicznej i
ekstubacji niweczą wyniki leczenia ARDS
!!

Zaprzestanie wentylacji
mechanicznej II
(kryteria po 120 min.
oddechu z użyciem rurki T)
1. PaO
2
(w mmHg, FiO
2
0,5) >
65
2. PaCO
2
(w mmHg) <
50
3. pH >
7,25
4. Częstość oddychania (na min.) <
40
5. Maks. siła wdechu (w cmH
2
O) >
20
6. Stosunek f / V
T
<
80
7. Częstość pracy serca (na min.) <
120

Respiratorowe uszkodzenie
płuc
(VILI - ventilator-induced lung injury)
1. Nadmierne rozdęcie płuc
(volutrauma)
- szkodliwa objętość, nie ciśnienie (Dreyfuss 1992)
- zmiany mikroskopowe i makroskopowe przy
ciśnieniu > 35 cmH
2
O
- mechaniczne uszkodzenie makrofagów płucnych
uwalnia prozapalne cytokiny IL-1, IL-6 i IL-8
2. Toksyczność tlenu
- efekt cytotoksyczny
- niedodma resorpcyjna
3. Siły ścinające
- powtarzane otwieranie i zapadanie się
pęcherzyków
Obraz morfologiczny respiratorowego
uszkodzenia płuca przypomina dysplazję
oskrzelowo-płucną.

Wentylacja nieinwazyjna -
niPPV
Zalety
- Pozwala uniknąć intubacji
- Niepotrzebna sedacja i środki
zwiotczające
- Brak zagrożenia miopatią
- Małe ryzyko zakażenia płuc
Wady
- Trudno uzyskać szczelność maski
- Wymagana współpraca chorego
- Częste nietolerowanie maski
- Niezbędna stała asysta personelu
- Trudna do prowadzenia bez fabrycznej
opcji
niPPV w respiratorze

niPPV - maska twarzowa
niPPV - maska nosowa

Pozaustrojowa wymiana
gazów
1. Oksygenacja pozaustrojowa (ECMO)
- częste powikłania krwotoczne
- b.wysokie koszty
- problemy deontologiczne
- nie wykazano wzrostu przeżywalności w ARDS
2. Pozaustrojowe usuwanie CO
2
- mniej złożone i tańsze od pełnego ECMO
- korzystne wyniki kliniczne w
specjalistycznych
ośrodkach
3. Oksygenacja wewnątrznaczyniowa -
IVOX
- pierwszym konstruktorem Morsten w 1982r
- zapewnia 5 - 10% dostawy tlenu
- obecnie na etapie eksperymentu
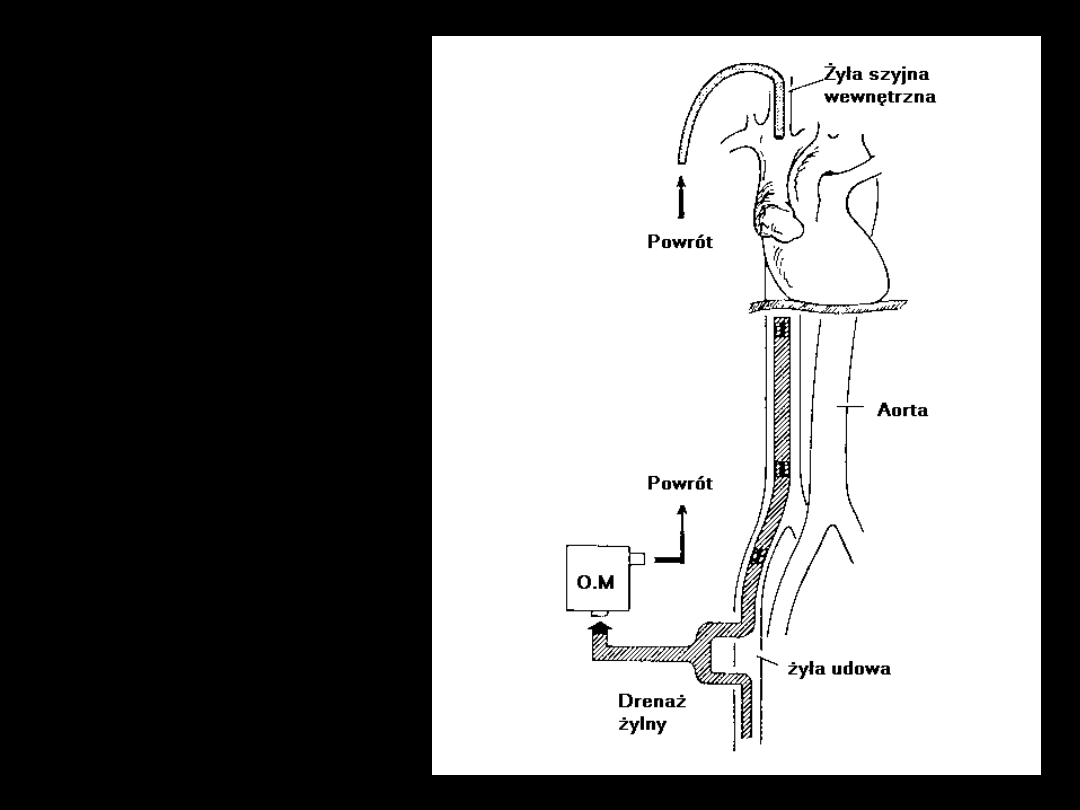
ECMO
żyła - żyła
1. Wersja prostsza
i bezpieczniejsza
2. Oksygenacja
20-30% rzutu
serca
3. Nie wspomaga
krążenia
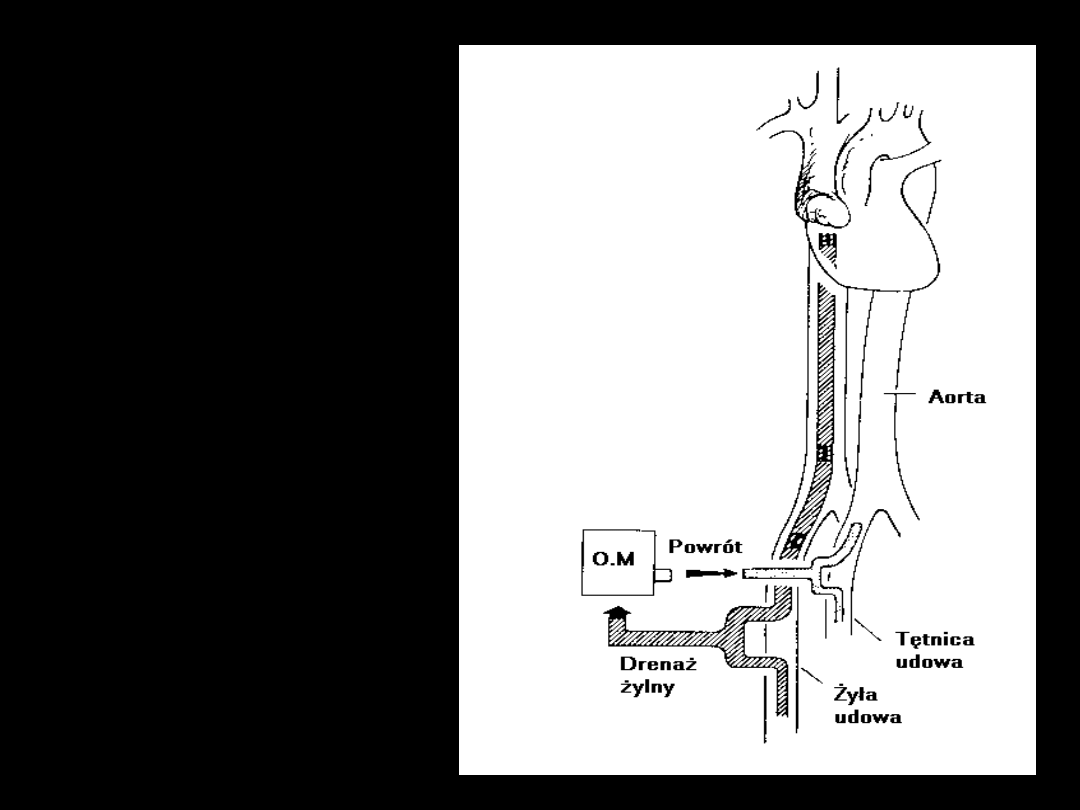
ECMO
żyła - tętnica
1. Wersja
trudniejsza
2. Oksygenacja
80% rzutu serca
3. Wspomaga
krążenie!

Pozaustrojowe usuwanie CO
2
LPPV- ECCO
2
R - low frequency positive
pressure ventilation-extracorporeal CO
2
removal)
1.
Membranowe usuwanie CO
2
( żyła-żyła) z wolną
(1 do 5 oddechów na min.) wentylacją
mechaniczną.
2. Pierwszy zastosował z dobrym wynikiem
Gattinoni (JAMA 1986,256:881).
3. Ostatnio Lewandowski u 49 chorych z ARDS
(55% przeżycia).
Bezwzględne kryterium: PaO
2
/FiO
2
< 50, po 2
g. wentylacji z PEEP 10 cm
2
O.
Względne kryterium: PaO
2
/FiO
2
< 150, Q
S
/Q
T
>
30%, C < 30 ml/cmH
2
O oraz EVLW > 15 ml/kg.
(Intensive Care Med. 1997,23:819).

Farmakologiczne leczenie
ARDS
1. Eikosanoidy i ich inhibitory
2. Tlenek azotu
3. Antyoksydanty
- acetylocysteina
- płukane erytrocyty własne
4. Pentoksyfilina (Trental)
- nieswoisty bloker fosfodwuesterazy (PDE)
- zmniejsza pobudzenie granulocytów I
makrofagów
5. Almitryna (Vectarion
5-8 mcg/kg/min przez 30
min
)
- nasila wazokonstrikcję hipoksemiczną
- niekiedy łączona z NO
- wykluczona przy nadciśnieniu płucnym, a więc
przy
mniej nasilonym ALI
6. Eliminacja mediatorów
- przeciwciała monoklonalne (anty LPS, TNF, IL)
- hemofiltracja

Eikosanoidy i inhibitory w
ARDS
1. PGE
1
i PGI
2
(prostacyklina)
- hamują pobudzenie granulocytów, makrofagów
- blokują proces krzepnięcia (poprawa
przepływu)
- obniżają ciśnienie w t.płucnej (wzrastać może
Qs/Qt)
- jako zamiennik NO (brak efektów toksycznych)
Poprzez plazmid wprowadzono gen kodujący
cox-1 do płucnego endotelium królika,
uzyskując 6x wzrost produkcji PGI
2
po 48 godz.
Zmodyfikowany genetycz-nie królik ten był
mniej wrażliwy na endotoksynę !!
2. Inhibitory
- szlaku cykloksygenazy (prostanoidów):
ibuprofen
- syntetazy tromboksanowej: ketokonazol
- lipoksygenazy: zileuton
3. Steroidy
- we wczesnej fazie blokowanie mediatorów
- w fazie późnej hamowanie rozplemu
fibroblastów

Tlenek azotu - historia
1980 -
Furchgott I Zawadzki odkrywają EDRF
(Endothelial derived relaxing factor)
1987 -
Palmer identyfikuje EDRF jako NO
1988 -
Higgenbottam po raz pierwszy stosuje NO
w nadciśnieniu płucnym u dorosłych
1992 -
Roberts w nadciśnieniu płucnym u
noworodków
1993 -
Rossaint wprowadza NO do terapii ARDS
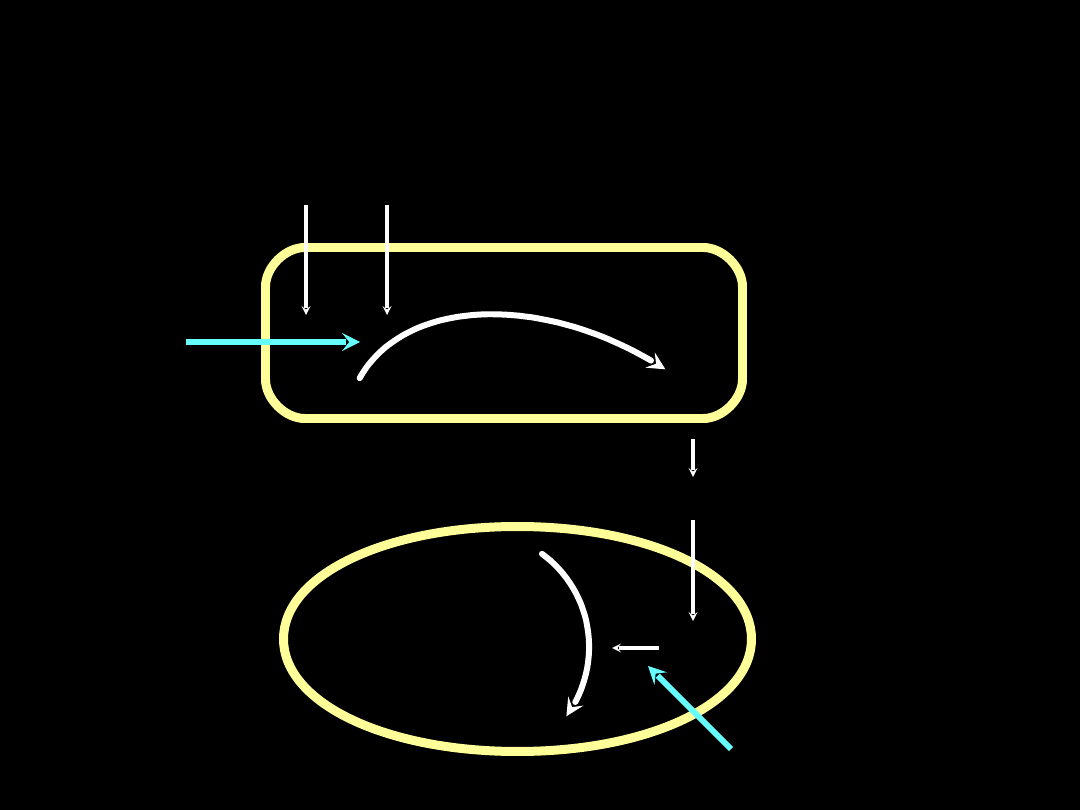
Tlenek azotu - synteza i inhibicja
L-arginina
O
2
Śródbłonek
Mięśniówka
gładka
(rozkurcz)
Syntetaza NO
NO
NO
NO
GTP
cGMP
Błękit metylenowy
Analogi
L-argininy
2 syntetazy
:
-konstytutywna
(śródbłonki,OUN)
-indukowalna
(makrofagi,neutro-
file,kom.Kupfera)
Cyklaza
guanylowa

Tlenek azotu - efekty
toksyczne
1. Silnie toksyczny przy wyższym stężeniu
- w atmosferze: spaliny,błyskawice,pożary (do 10
ppm)
- wysoka zawrtość w dymie papierosowym
- norma dla zawartości w powietrzu na 8-
godzinnym
stanowisku pracy 25 ppm
2. Powinowactwo NO do hemoglobiny
(1500 razy silniejsze od CO)
- w pierwszym etapie powstaje
nitrosylohemoglobina
- w drugim etapie methemoglobina (bez znaczenia
przy stężeniach < 20 ppm)
3. Łatwa oksydacja do NO
2
, silnej
cytotoksyny
(okres półtrwania w obecności O
2
kilka sekund)
- peroksydacja lipidów (obrzęk płuc)
- inaktywacja antyoksydantów

Tlenek azotu - zastosowanie
kliniczne
1. Nadciśnienie płucne
- nie działa na prawidłowe krążenie płucne
- w hipertensji płucnej liniowa zależność pomiędzy
stężeniem NO i spadkiem ciśnienia (10-80 ppm)
- przedostaje się tylko od pęcherzyków
wentylowa-
nych i nie wpływa na krążenie systemowe
Bardzo użyteczny w kardiochirurgii i
neonatologii
2. ARDS
- nie likwiduje wazokonstrikcji hipoksemicznej
- natychmiastowa poprawa V
A
/Q
C
i oksygenacji
(1- 40 ppm, optimum 10 ppm) (bez tachyfilaksji)
Bez wpływu na przeżywalność w ARDS
3. Astma oskrzelowa
- udane próby doświadczalne (5-100 ppm)
- sprzeczne wyniki badań klinicznych

Tlenek azotu - Servo Ventilator
300
1. Dostawa NO do układu
oddechowego
- możliwość użycia podczas wszystkich
technik wentylacji
- dostawa NO tylko w fazie wdechu
- stężenie NO od 0,4 do 30-90 ppm
(zależnie od wielkości przepływu w fazie
wdechu,
przy stężeniu NO w butli 1000 ppm i
ciśnieniu
600 kPa)
2. Monitorowanie NO/NO
2
- NO w zakresie do 100 ppm
- NO
2
w zakresie do 10 ppm

ARDS i kortykosteroidy - I
1. W przebiegu SIRS aktywacja osi HPA
(podwzgórze-przysadka-nadnercza)
via TNF-α, IL-1, IL-6
2. Glikokortykoidy hamują SIRS na
wszystkich
poziomach
Mechanizm receptora steroidowego:
- związanie się z receptorem cytoplazmatycznym
- przejście kompleksu ligand-receptor do jądra
- związanie się ze specyficznym miejscem
genomu
i kontrola ekspresji wielu genów (wpływ na
proces
zapalny w licznych punktach: synteza cytokin,
prostanoidów, peroksydaz, NO)

ARDS i kortykosteroidy - II
Glikokortykoidy wspomagają
katecholaminy
przez przeciwdziałanie:
1. Desensytyzacji receptora alfa i beta
adrenergicznego
2. Down-regulation receptora alfa i beta
Przy braku glikokortykoidów:
1. Hiperreakcja obronna z wysokim
poziomem
cytokin prozapalnych
2. Pogorszenie hemodynamiki
3. Załamanie homeostazy

Spadek wrażliwości tkanek na
glikokortykoidy w SIRS
1. Zmiana funkcjonalnej charakterystyki
receptora
(gęstości, powinowactwa, wiązania DNA- procesu
transkrypcji)
2. Utrudnienie dostępu hormonu do receptora
(pogorszenie perfuzji tkanek)
Koncepcja względnej niewydolności kory
nadnerczy w SIRS
Pomimo nadmiaru hormonu
komórki pozostają w stanie
„głodu steroidowego” !!

Kortykosteroidy w ARDS
(koncepcja wcześniejsza)
Terapia krótkotrwała (24 - 96
gopdz.)
1. W fazie wysiękowej
- niewydolność kory nadnerczy
- nadkażenie pneumocystis carinii (AIDS!)
2. W fazie proliferacji
- nadmierny rozplem fibroblastów
Terapia długotrwała prowadzi do
wzrostu śmiertelności W ARDS i
sepsis !!

Kortykosteroidy w ARDS
(koncepcja obecna)
Terapia długotrwała (powyżej 5 dni)
100 mg co 8 godz., albo 100 mg i.v. i infuzja 10
mg/godz.
1. Konsekwencje zbyt krótkiej terapii
- ponowny wzrost poziomu cytokin
- pogorszenie hemodynamiki
2. Terapia przedłużona
- spadek krążących cytokin (IL-1, IL-6, TNF, PLA
2
)
- wzrost cytokin przeciwzapalnych (Il-4, IL-10)
- przywrócenie wrażliwości na kortyzol i
katecholaminy
Terapia długotrwała prowadzi do poprawy
hemodynamicznej i spadku
śmiertelności !!

Kortykosteroidy w ARDS
wyniki kliniczne
1. Meduri u 16 chorych z ARDS stosował
methylprednisolon
2 mg/kg.(do 32 dni). W grupie leczonej wzrost
PO2/FiO2
i C oraz spadek PAP ( placebo bez poprawy). Czas
wentylacji 11,5 doby u leczonych i 23 doby
placebo. W
grupie leczonej zmarło 2 z 16 chorych (12,5%), a w
grupie placebo 5 z 8 (62,5%).
(JAMA 1998,280:159).
2. Bollaert podawał hydrocortizon 100 mg co 8 godz.
(300 mg na dobę) przez 5 dni u 41 chorych we
wstrząsie septycznym otrzymujących
katecholaminy od 5-6 dni i z laktemią 2 mmol/l.
Stwierdził poprawę hemodynamiczną i spadek
śmiertelności.
(Crit.Care Med. 1998,26:645).
3. Oppert stosował hydrokortyzon 100 mg bolus i
infuzja
10 mg/g przez 7 dni u 20 chorych we wstrząsie
septycz.
U 18 chorych poprawa hemodynamiki z redukcją
noradre-
naliny o 20-80%. Bez wpływu na przeżycie.
(Intens. Care Med. 2000,26:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
Wyszukiwarka
Podobne podstrony:
Zespół zaburzeń oddechowych bydła
ARDS ZESPO╠ü┼ü ZABURZEN╠ü ODDECHOWYCH DOROS┼üYCH , ARDS ZESPÓŁ ZABURZEŃ ODDECHOWYCH DOROSŁYCH
Zespół zaburzeń oddechowych świń (1)
ZESPOL ZMECZENIA A ZABURZENIA WEGETATYWNE U CHORYCH NA STWARDNIENIE ROZSIANE, Działy, Neurologia, ma
5 Zaburzenia osobowosci i zachowania, zespoly behawioralne, zaburzenia seksualne
Nerwice, Terminem "nerwice" obejmuje się zespół psychogennych zaburzeń emocjonalnych, któr
Nerwice, Terminem "nerwice" obejmuje się zespół psychogennych zaburzeń emocjonalnych, któr
W4 Patofizjologia zaburzeń oddechowych., Wykłady
PATOFIZJOLOGIA ZABURZEŃ ODDECHOWYCH, Wykłady
Uwarunkowania genetyczne zespołu metabolicznego i zaburzeń przemiany lipidów
Przyczyny ostrych zaburzeń hiperpigmentacyjnych
ZESPOL ZMECZENIA A ZABURZENIA WEGETATYWNE U CHORYCH NA STWARDNIENIE ROZSIANE, Działy, Neurologia, ma
Ostry Zespół Wieńcowy i Zaburzenia Rytmu Pielegniarstwo
Zaburzenia rytmu w ostrych zespołach wieńcowych
Zaburzenia nerwicowe, zespoły lękowe 3
więcej podobnych podstron