
INTERAKCJE LEKÓW
Interakcje leków występują
wtedy, gdy działanie jednego
leku jest zmieniane przez
działanie innego leku,
jedzenie, napoje lub
ekspozycję na środowiskowe
czynniki chemiczne.

Czym są interakcje
leków?
• Interakcje leków występują wtedy, gdy
dwa lub więcej leków oddziałuje ze
sobą w taki sposób, że skuteczność lub
toksyczność jednego lub większej
liczby leków jest zmodyfikowana.
Interakcje mogą być szkodliwe dla
organizmu ludzkiego ze względu na
zwiększenie toksyczności leku lub
zmniejszenie jego skuteczności.

Rozróżniamy 3 rodzaje
interakcji.
• Farmaceutyczną
• Farmakodynamiczną
• Farmakokinetyczną

Interakcja farmaceutyczna
• Zwana inaczej chemiczną polega na
wystąpieniu reakcji między
substancjami leczniczymi. Leki
reagują ze sobą chemicznie i mówimy
wtedy o niezgodności chemicznej, lub
dochodzi do zmiany stanu fizycznego
jednego leku pod wpływem drugiego-
niezgodność fizyczna.

Interakcje
farmakodynamiczne
• Jest to wzajemne modyfikowanie
działania farmakologicznego przez
równoczesne zastosowane leki na
poziomie receptora i efektora.
Zwana inaczej koergizmem dzieli
się na:
• Synergizm
• Antagonizm

•
Synergizm jest to zgodne, jednokierunkowe
działanie leków, prowadzące do wzmożenia
działania. Jeśli efekt jest równy sumie
działania obu składników nazywamy to
synergizmem addycyjnym (tak działa np.
noradrenalina i epinefryna podane razem),
jeśli jest większy - nazywamy to synergizmem
hiperaddycyjnym, czyli potencjalizacją (tak
działa przeciwbakteryjnie: trimetoprim i
sulfonamidy podane łącznie np. w preparacie
kortimoksazol (Biseptol).

• Antagonizm - jest to przeciwne,
różnokierunkowe działanie leków,
prowadzące do osłabienia lub całkowitego
zahamowania działania. Odróżniamy
antagonizm kompetycyjny oraz
niekompetycyjny. W ramach tego ostatniego
wyróżniamy antagonizm allosferyczny
(zmiana konfiguracji przestrzennej
receptora i wtórnie zmiana jego zdolności
reagowania z agonistą), czynnościowy -
przeciwne działanie leków na funkcję
danego efektora (np. antagonistyczne
działanie acetylocholiny i adrenaliny) oraz
fizjologiczny (antagonistyczne działanie
wazopresyny i propranololu na ciśnienie
krwi - działają one na różne receptory w
różnych narządach).

Interakcje
farmakokinetyczne
• Interakcje farmakokinetyczne są to
takie interakcje, które wpływają na
procesy wchłaniania leku, dystrybucji,
metabolizmu lub wydalania.
Wyróżniamy kilka rodzajów interakcji
farmakodynamicznych. Zostały one
przedstawione poniżej na rysunku nr
1.
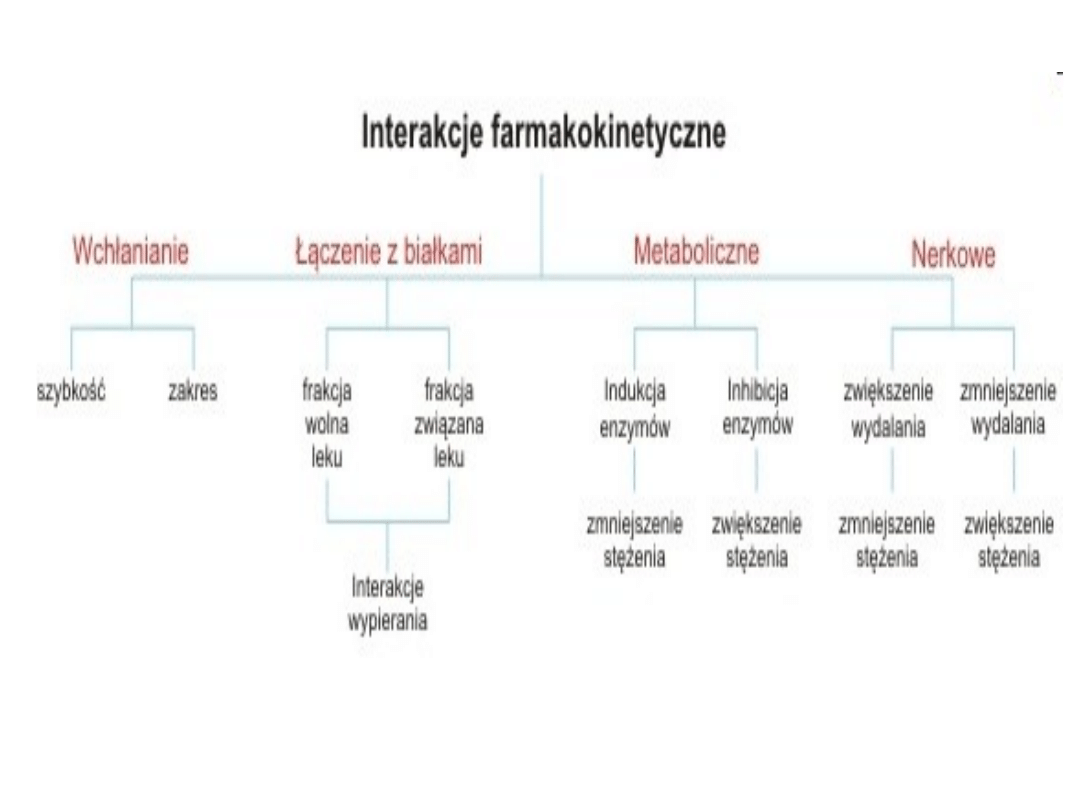

Interakcje na etapie
wchłaniania
• Istnieje kilka mechanizmów powodujących
interakcje na etapie wchłaniania leków z
przewodu pokarmowego tj. zmiana pH treści
żołądkowo-jelitowej, adsorpcja,
chelatowanie, zmiana motoryki przewodu
pokarmowego, indukcja lub inhibicja białek
transportujących leki oraz zespół złego
wchłaniania wywołany przez stosowane leki.
Poniżej mechanizmy te zostaną omówione z
podaniem przykładów spotykanych w
codziennej praktyce klinicznej.

Zmiana pH treści żółądkowo-
jelitowej
• Przejście leków przez błony śluzowe następuje na zasadzie dyfuzji
biernej i zależy od stopnia w jakim występują leki w postaci
niezjonizowanej, rozpuszczalnej w tłuszczach. Wchłanianie jest
regulowane przez jego rozpuszczalność w tłuszczach, pH treści
jelit i różne inne parametry związane z farmaceutyczną postacią
leku. Z tego powodu wchłanianie kwasu salicylowego jest
znacznie większe w niższym pH, niż w wyższym. Teoretycznie
można byłoby się spodziewać, że zmiana pH w żołądku wywołana
przez takie leki jak antagoniści receptora H2 będzie miała
znaczący wpływ na wchłanianie leku. W praktyce jednak wynik
takich interakcji jest często trudny do przewidzenia, ponieważ
wpływ na wchłanianie mają też liczne inne mechanizmy takie jak
chelatowanie, adsorpcja i zmiany motoryki jelit, które mogą
znacząco wpływać na to co się dzieje w danym momencie. Chociaż
w niektórych przypadkach zmiana taka może mieć istotne
znaczenie. Podwyższenie pH w wyniku działania inhibitorów
pompy protonowej czy też antagonistów receptora H2 może
zauważalnie zmniejszać wchłanianie ketokonazolu.

Adsorpcja, chelatowanie i inne
• Węgiel aktywowany jest używany jak środek
adsorbujący działający w obrębie jelit i
stosowany w leczeniu przedawkowania leków
lub usunięcia innych toksycznych substancji.
Węgiel może wpływać na wchłanianie leków
podawanych w dawkach terapeutycznych.
Środki zobojętniające kwas solny mogą także
adsorbować dużą liczbę leków, ale często są w
to włączone także inne mechanizmy interakcji.
Na przykład, antybiotyki tetracyklinowe mogą
chelatować z licznymi dwu i trójwartościowymi
jonami metali, takimi jak wapno, aluminium,
bizmut i żelazo. Tworzą się wówczas
kompleksy, które są słabo wchłaniane i
wykazują zmniejszone działanie
przeciwbakteryjne.

Zmiany motoryki
przewodu pokarmowego
• Ponieważ większość leków jest w dużej mierze
wchłaniana w wyższych partiach jelita
cienkiego, to leki, które zmieniają szybkość
opróżniania żołądka mogą wpływać na
wchłanianie innych leków. Na przykład
propantelina opóźniając opróżnianie żołądka
zmniejsza szybkość wchłaniania
paracetamolu, natomiast metoklopramid
wywiera działanie odwrotne. Przy czym należy
zauważyć, że całkowita ilość wchłoniętej
substancji czynnej pozostaje niezmieniona.

Indukcja lub inhibicja
białek transportujących
leki
•
Biodostępność niektórych leków stosowanych per os
jest
ograniczona
poprzez
działanie
białek
transportujących leki. Białka te usuwają m.in. z
komórek nabłonka jelit cząsteczki leku z powrotem do
światła
jelita.
Obecnie
najbardziej
znanym
transporterem leków jest P-glikoproteina.
•
P-glikoproteina jest wielkocząsteczkowym białkiem
wykrytym w błonach komórkowych różnych narządów.
Na zasadzie transportu aktywnego ("pompy")
"wyrzuca" ona leki z komórek, zapobiegając ich
kumulacji. Dlatego też P-glikoproteina ma istotne
znaczenie w procesie wchłaniana leków z jelita, z krwi
do mózgu lub ich eliminacji z moczem i żółcią.

• Digoksyna jest substratem P-glikoproteiny
i leki, które indukują to białko mogą
zmniejszać biodostępność digoksyny.
Działanie P-glikoproteiny może być
indukowane lub hamowane przez niektóre
leki. Indukcja aktywności P-glikoproteiny
przez ryfampicyne w komórkach nabłonka
jelit może być powodem usuwania
digoksyny do światła jelita i tym samym
zmniejszenie jej biodostępności.

Zespół złego
wchłaniania
• Neomycyna wywołuje zespół złego
wchłaniania, podobny do tego jaki
obserwuje się przy pierwotnym
zespole złego wchłaniania.
Efektem tego jest pogorszenie
wchłaniania kilku leków w tym
digoksyny i metotreksatu.

lek wchodzący w
interakcje
lek powodujący
interakcje
wynik interakcji
digoksyna
metoklopramid
zmniejszenie wchłaniania
digoksyny
propantelina
zwiększenie wchłaniania
digoksyny
digoksyna
cholestyramina
zmniejszenie wchłaniania z
powodu wiązania/ tworzenia
kompleksów z cholestyraminą
lewotyroksyna
warfaryna
ketokonazol
środki zobojętniające kwas
solny
zmniejszenie wchłaniania
ketokonazolu z powodu
zredukowania rozpuszczania
antagoniści receptora H
2
inhibitory pompy
protonowej
penicylamina
środki zobojętniające kwas
solny (zawierające Al
3+
i/lub Mg
2+
), związki żelaza,
jedzenie
tworzenie słabiej
rozpuszczanych chelatów
penicylaminy czego
rezultatem jest zmniejszona
absorbcja penicylaminy
metotreksat
neomycyna
neomycyna indukuje stan
złego wchłaniania
chinolony
środki zobojętniające kwas
solny (zawierające Al
3+
i/lub Mg
2+
), Fe
2+
, Zn
2+
,
mleko
tworzenie słabo
absorbowanych związków
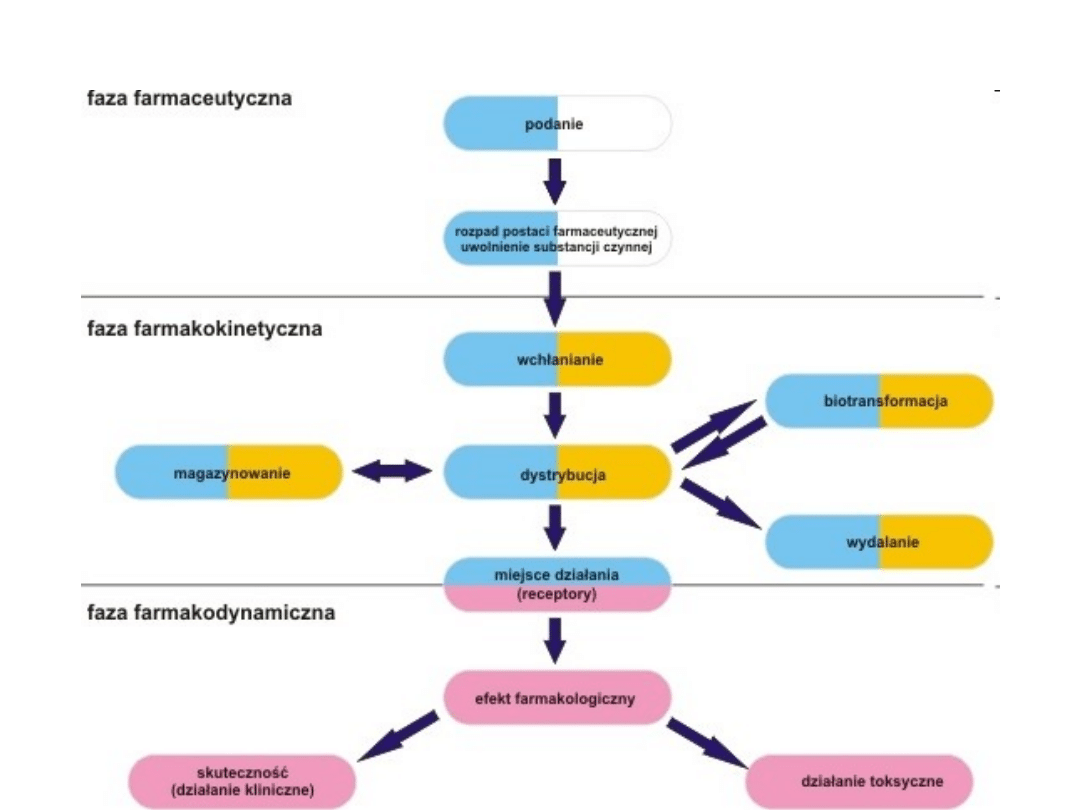
Interakcje na etapie dystrybucji
leków

• a) Interakcje na etapie wiązania leków z białkami.
• Po wchłonięciu do krwi następuje proces rozmieszczania się
cząsteczek leku w krwiobiegu i w tkankach. Niektóre leki
rozpuszczają się całkowicie w wodzie osoczowej, ale wiele innych jest
transportowanych poprzez częściowe rozpuszczanie się ich
cząsteczek w roztworze, a częściowo poprzez wiązanie z białkami
osoczowymi, głownie albuminami. Miarą wiązania leku z białkami jest
tzw. stopień związania leku i zależy on od: 1) stężenia leku
2)powinowactwa leku do miejsc wiążących 3) stężenia białek w
organizmie. Stopień tego połączenia różni się znacznie u różnych
leków, przy czym niektóre leki są bardzo silnie , wiązane z białkami.
Na przykład dikumarol ma tylko cztery cząsteczki, które pozostają nie
związane (o stężeniu 0,5 mg% w osoczu krwi z 1000 wszystkich
cząsteczek). Leki mogą być również związane z białkami w płynie
śródmiąższowym, a niektóre z nich tj. digoksyna mogą łączyć się z
tkanką mięśnia sercowego.
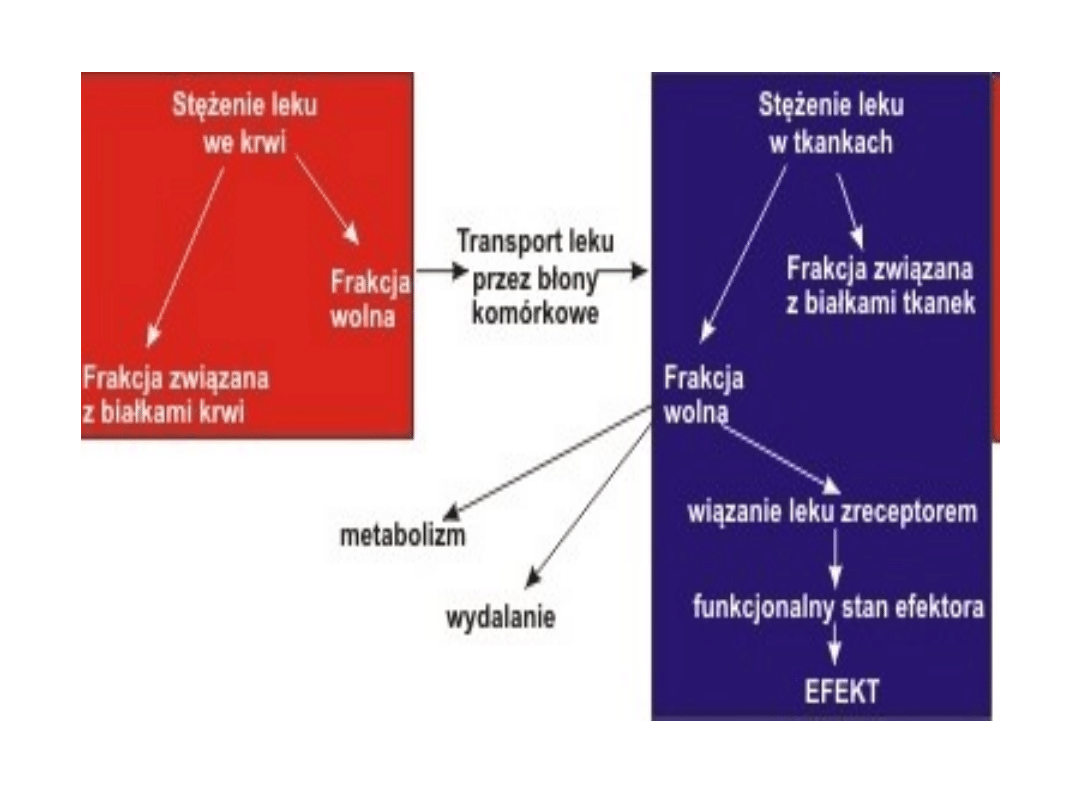

• Łączenie się leków z białkami osoczowymi jest
odwracalne. W procesie tym dochodzi do ustalenia
się równowagi pomiędzy cząsteczkami leku, które
są związane z białkami a tymi, które pozostają nie
związane. Tylko cząsteczki wolne, nie związane z
białkami mogą przenikać z krążenia do receptora.
Są one farmakologicznie aktywne i ulegają
metabolizmowi. Natomiast związana z białkami
część leku znajduje się w krwiobiegu, ale nie
ulega dystrybucji, nie przenika do tkanek, nie jest
farmakologicznie aktywna. Związana z białkami
część stanowi zmagazynowaną postać leku, która
jest tymczasowo chroniona przed metabolizmem i
wydalaniem. Gdy dochodzi do obniżenia stężenia
postaci wolnych cząsteczek leku np. wskutek
metabolizmu i wydalania, z postaci
zmagazynowanej zostają uwolnione cząsteczki
leku celem przywrócenia stanu równowagi.

• Istotne znaczenie odgrywa interakcja w zakresie
biotransformacji. Odróżniamy tzw. inhibitory
enzymatyczne - hamujące metabolizm innych leków
(fenylbutazon, chloramfenikol, sulfonamidy) - np.
hydantoiny (fenytoiny) oraz induktory enzymatyczne -
wzmagające przemianę innych leków. Do induktorów
enzymatycznych należą barbiturany, ryfampicyna,
insektycydy, węglowodory policykliczne zawarte m.in. w
dymie tytoniowym. Następstwem podania ich jest
zmniejszenie stężenia i działania takich leków jak
hormony płciowe żeńskie, gryzeofulwiny, barbituranów,
fenylobutazonu i in.
W zakresie wydalania przez nerki - leki zakwaszające
powodują zahamowanie wydalania leków kwaśnych, a
zwiększenie wydalania leków zasadowych. Leki
alkalizujące odwrotnie. Zakwaszenie moczu może w
znacznym stopniu zwiększyć wydalanie np. amfetaminy
(stosowanie przy przedawkowaniu) i innych.

Interakcje na etapie metabolizmu leków
• Większość leków ulega w organizmie chemicznej
zmianie do związków, które są lepiej rozpuszczalne
w wodzie i mogą być dzięki temu znacznie łatwiej
wydalane z organizmu przez nerki.
• W następstwie procesu biotransformacji z
aktywnego farmakologicznie związku:
• może powstać również aktywny metabolit,
• może powstać związek toksyczny dla organizmu,
• może dojść do przekształcenia związku
farmakologicznie nieczynnego lub słabo
działającego w substancje o właściwościach
leczniczych.

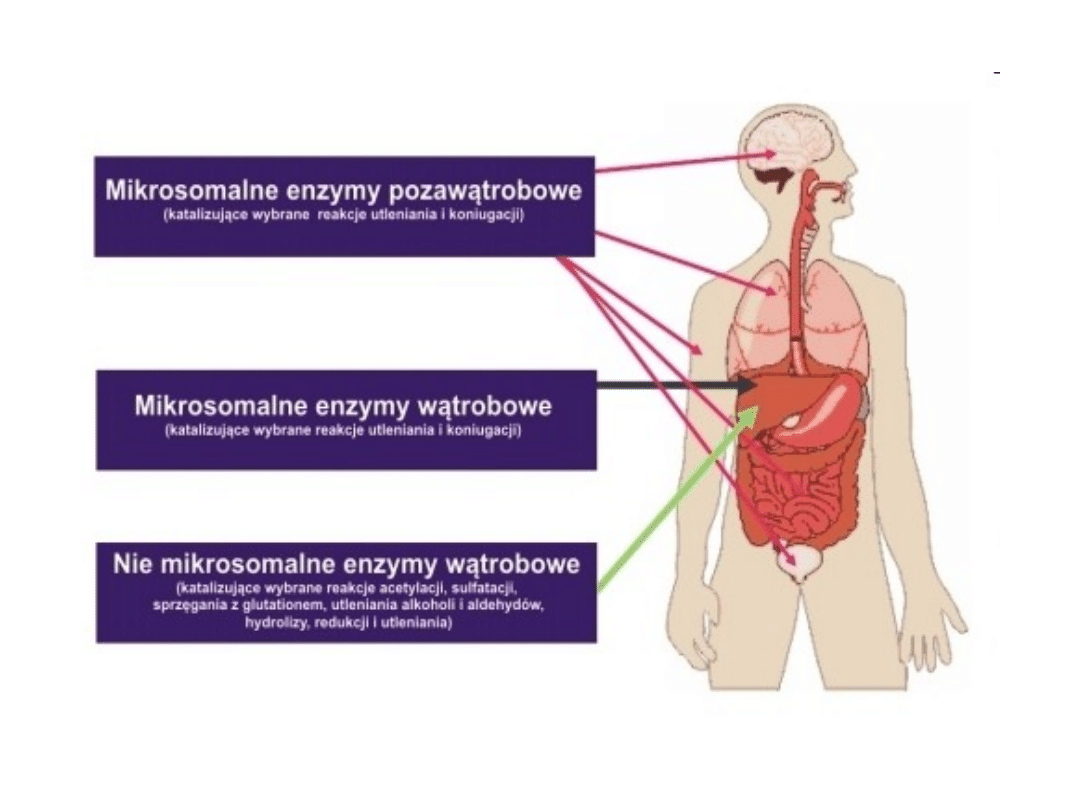
Metabolizm leków
• Metabolizm leków przebiega przy pomocy enzymów
zlokalizowanych w osoczu krwi, płucach, łożysku,
jądrach , jajnikach, nerkach, skórze, siatkówce oka i w
jelitach, ale przede wszystkim przeprowadzany jest przez
enzymy, które znajdują się w membranach retikulum
endoplazmatycznego komórek wątroby – hepatocytach.
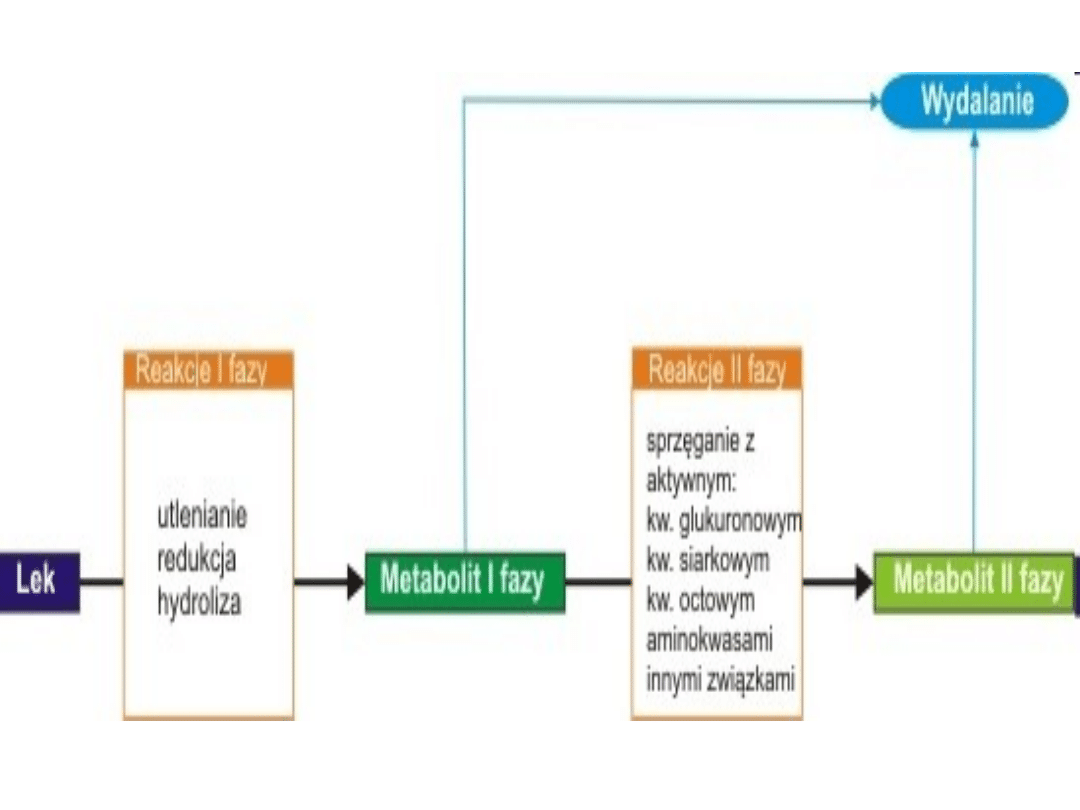
Metabolizm leków można podzielić na dwie fazy. Faza
pierwsza obejmuje procesy utleniania, redukcji i
hydrolizy, w wyniku której leki ulegają przekształceniu w
bardziej polarne związki. Natomiast faza druga polega
na łączeniu leków ze związkami endogennymi (np.
kwasem glukuronowym) i prowadzi do powstania
zazwyczaj związków nieaktywnych, przygotowanych do
wydalenia z organizmu z moczem lub żółcią. Głównym
celem obu faz jest zwiększenie rozpuszczalności leków w
wodzie, a co za tym idzie ułatwienie ich wydalania.
Rysunek 2 przedstawia uproszczony schemat przemian
jakim może ulegać lek w procesach biotransformacji.

• Większość reakcji utleniania (głównej reakcji fazy pierwszej) jest
przeprowadzana przez zawierające hemoproteinę enzymy grupy
cytochromu P450. Największe stężenie tych enzymów stwierdza się w
wątrobie i w jelicie cienkim. Cytochrom P450 nie jest pojedynczą
jednostką, ale w rzeczywistości jest to bardzo duża rodzina
pokrewnych izoenzymów. Około 30 z nich zostało odkrytych w tkance
wątroby człowieka. Za najbardziej istotne izoenzymy metabolizujące
90% leków uważa się: CYP1A2, CYP2C9, CYP2C19, CYP2D6, ,
CYP2E1 i CYP3A4, z czego dwa najważniejsze to CYP3A4 i CYP2D6.
Inne enzymy zaangażowane w fazę pierwszą metabolizmu leków
obejmują monoaminooksydazę i hydrolazę epoksydową.
Należy zauważyć, że leki mogą być metabolizowane tylko przez jeden
izoenzym
np. omeprazol/CYP2C19
lub jeden lek może być metabolizowany przez wiele różnych
izoenzymów
np. imipramina/CYP2D6, CYP1A2, CYP3A4, CYP2C19
• Mniej wiadomo jest na temat enzymów odpowiedzialnych za reakcje
sprzęgania drugiej fazy. UDP-glukuronylotransferaza (UGT),
metylotransferaza i N-acetylotransferaza (NAT) są przykładami
enzymów biorących udział w procesach drugiej fazy metabolizmu.

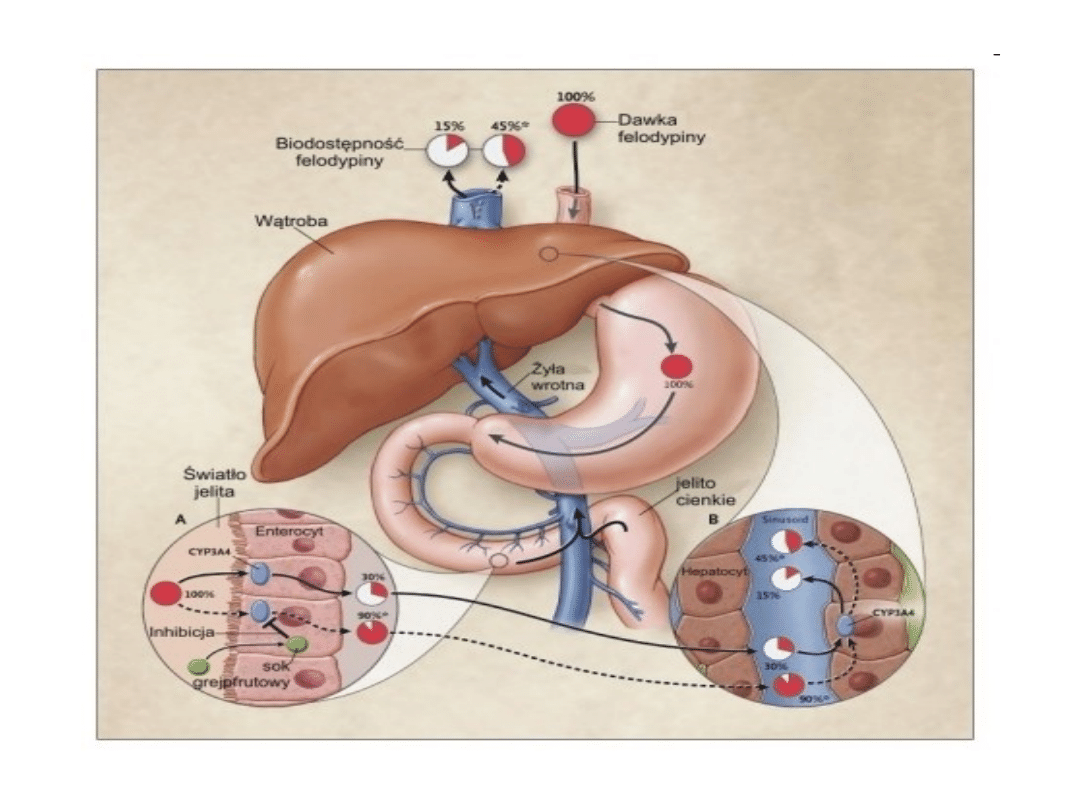
Zmiany w efekcie pierwszego przejścia
• Efekt pierwszego przejścia – zmniejszenie się ilości leku po
jego wchłonięciu z przewodu pokarmowego, a przed
dotarciem do krążenia ogólnego. W komórkach nabłonka
jelit (enterocytach) znajdują się enzymy metabolizujące. Są
to głównie izoenzymy cytochromu P450. Poza zmianami
opisanymi w punkcie 3.1. istnieją dowody, że niektóre leki
mogą wywierać znaczny wpływ na stopień metabolizmu
pierwszego przejścia poprzez inhibicję lub indukcję
izoenzymów cytochromu P450 w ścianie jelit lub w
wątrobie. Przykładem jest efekt działania soku
grejpfrutowego. Zawarte w nim składniki (szczególnie
należąca do fumarokumaryn - 6’7’dihydroksybergamotyna)
hamują aktywność izoenzymu 3A4 cytochromu P450,
głównie w jelicie cienkim. Wynikiem tego działania jest
zmniejszenie metabolizmu statyn (np. symwastatyny),
doustnych blokerów kanałów wapniowych (np. felodypiny,
nifendypiny, nitrendypiny.), cyklosporyny, estradiolu,
diazepamu, triazolamu, midazolamu.

Indukcja enzymatyczna
• Najczęściej indukowanym
szlakiem metabolicznym jest I faza
utleniania, w której pośredniczą
izoenzymy cytochromu P450.
Główne grupy leków
odpowiedzialne za indukcje
najważniejszych klinicznie
izoenzymów cytochromu P450
zostały wymienione w Tabeli 1

CYP2B6
CYP2C9
CYP2E1
CYP3A4,5
,7
Fenobarbital
(Luminal)
Ryfampicyna
(Rifampicyna)
etanol
Karbamazepin
a
(Amizepin,
Tegretol)
Fenytoina
(Epanutin
Parenteral)
Izoniazyd
(Isoniazidum
Fenobarbital
(Luminal)
Ryfampicyna
(Rifampicyna
Fenytoina
(Epanutin
Parenteral)
Ryfampicyna
(Rifampicyna)
Wyciągi z
dziurawca

• Bardziej rozpowszechniona od indukcji enzymów jest ich
inhibicja. Wynikiem inhibicji enzymatycznej jest zmniejszenie
metabolizmu danego leku. Lek taki może zacząć kumulować
się w organizmie, a efekt jest zazwyczaj tak samo istotny jak
w przypadku gdybyśmy zwiększyli dawkowanie. Inhibicja
enzymatyczna występuje bardzo szybko. Zaraz po podaniu
pierwszej dawki inhibitora blokuje on metabolizm
równocześnie podanego leku. Najczęściej hamowanym
szlakiem metabolizmu jest reakcja utleniania I fazy
metabolizmu, która przebiega przy udziale izoenzymów
cytochromu P450. Leki, które powodują istotne klinicznie
interakcje inhibicji izoenzymów cytochromu P450 są
wymienione w tabeli 2. Dla przykładu zastosowanie
cymetydyny w dawce 800mg będącej nieswoistym
inhibitorem cytochromu CYP3A4 jednocześnie z sildenafilem
(Viagra) w dawce 50mg powoduje wzrost stężenia sildenafilu
w surowicy o 56|%. Podobnie sok grejpfrutowy będący
słabym inhibitorem CYP3A4 w ścianie jelit, może powodować
nieznaczne zwiększenie stężenia sildenafilu w surowicy.

Interakcje na etapie wydalania leków
• Wydalanie leku lub jego
metabolitów prowadzi do
zmniejszenia substancji czynnej w
organizmie. Wydalanie może
odbywać się:
• drogą nerkową (z moczem),
• z żółcią lub drogą jelitową (z
kałem),
• drogą oddechową (razem z
wydalanym powietrzem).

• Przez błony kanalików nerkowych dobrze
wchłaniają się zwrotnie leki w postaci
niezjonizowanej, dlatego w moczu
zasadowym (wysokie pH) leki o charakterze
słabych kwasów (pKa od 3 do 7,5 np. kwas
acetylosalicylowy, sulfonamidy, fenylbutazon,
barbiturany) przeważnie istnieją jako
zjonizowane nie rozpuszczalne w tłuszczach
cząsteczki, które są niezdolne do dyfuzji
przez komórki kanalików nerkowych, i w
wyniku tego są wydalane razem z moczem.
Odwrotnie, leki o charakterze słabych zasad
(pKa 7,5 do 10,5 np. kodeina, morfina,
chinina, imipramina) będą ulegały resorpcji
zwrotnej w moczu o zasadowym odczynie
pH.
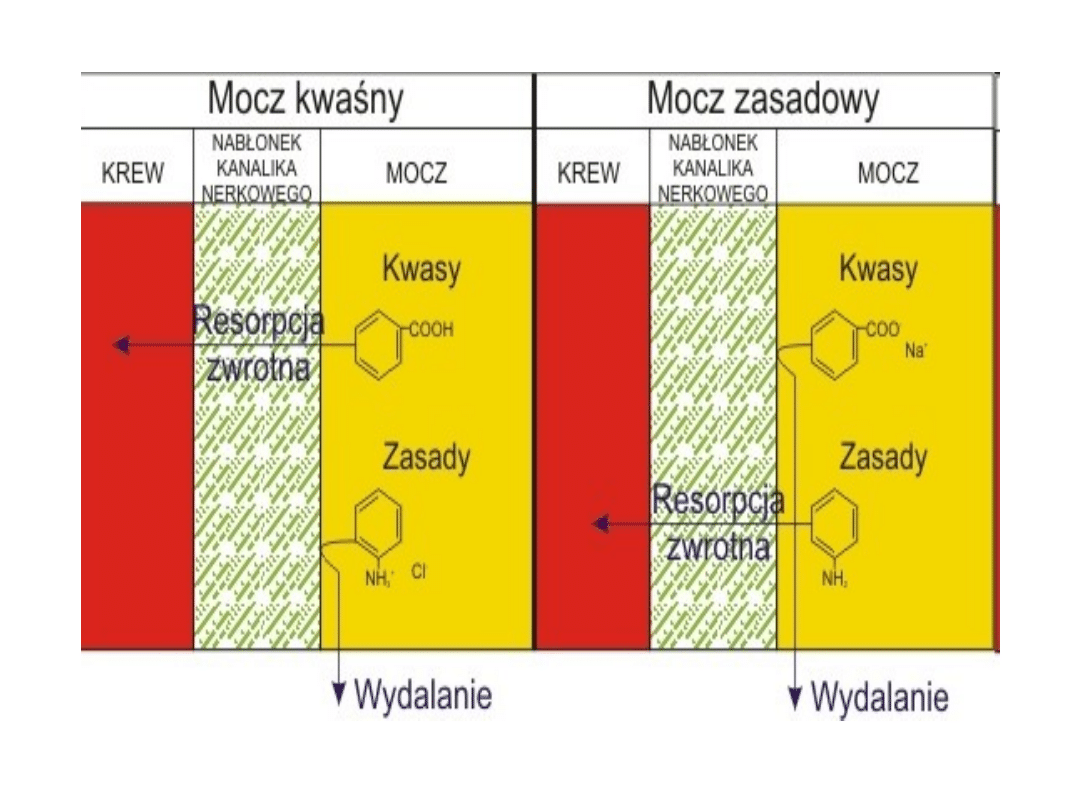

• Z tego powodu zmiana pH moczu, która prowadzi do:
• zwiększenia ilość postaci zjonizowanych cząsteczek leku,
zwiększa jednocześnie wydalanie leku z moczem np. alkalizacja
moczu wywołana podaniem wodorowęglanu sodu, mleczanu
sodu zwiększy wydalanie leków o charakterze kwasów przez
ich jonizację, albo zakwaszenie moczu wywołane podaniem
chlorku amonu przez jonizację leków zasadowych zwiększy ich
wydalanie,
• zmniejszenia ilości postaci zjonizowanych cząsteczek leku
będzie zwiększała resorpcje zwrotną postaci niezjonizowanych.
• Pomimo tego, że przez alkalizację lub zakwaszenie moczu
można zmienić intensywność i czas działania leków, to
kliniczne znaczenie tego typu interakcji jest jednak
niewielkie.

Interakcje leków z
żywnością
• Interakcje leków dotyczą:
- procesów farmakokinetycznych
(uwalnianie, wchłanianie, dystrybucja i
eliminacja leku)
- przemian biochemicznych (w wątrobie i
przewodzie pokarmowym)
- działania synergistycznego lub
antagonistycznego

1. Zmniejszenie
wchłaniania leków
Obecność pokarmu w żołądku istotnie
zmniejsza lub znacznie opóźnia wchłanianie
niektórych leków, zwłaszcza antybiotyków i
sulfonamidów, również leków
przeciwwirusowych, leków stosowanych w
AIDS i HIV oraz lewodopy.
Błonnik pokarmowy, którego źródłem są między
innymi płatki owsiane i otręby wpływa na
zmniejszenie wchłaniania leków
przeciwdepresyjnych oraz nasercowych na bazie
glikozydów naparstnicy.

• Jony wapnia zawarte w produktach mlecznych
zmniejszają wchłanianie antybiotyków i
chemiterapeutyków (tetracykliny).
• Soki owocowe bogate w jony wodorowe mogą
przyczynić się do obniżenia wchłaniania
erytromycyny, penicyliny fenoksymetylowej i
azytromycyny. Skrobia kukurydziana, kazeiniany
zawarte w mleku i olej kokosowy mogą
zmniejszać wchłanianie leków
przecidrgawkowych i przeciwarytmicznych jak
fenytoina, natomiast taniny zawarte w herbacie
obniżają działanie preparatów żelaza.

• Tłuszcze zawarte w posiłku nasilają i
przyspieszają wchłanianie leków o
dużej litofilności. Emulsja tłuszczowa
jest nośnikiem dla leku i przez to jego
wchłanianie wzrasta. Spożycie
niektórych leków z posiłkiem
tłuszczowym może nasilić efekty
uboczne ponieważ wzrost stężenia leku
we krwi może wynosić od 40 do 300%.
Te leki to m. in.: preparaty teofiliny,
leki przeciwpasożytnicze i
przeciwgrzybiczne, trójpierścieniowe
leki przeciwdepresyjne i β-adrenolityki.
2. Zwiększenie wchłaniania leków

3. Zaburzenia metabolizmu
leków
•
Niektóre leki wchodzące w interakcje z
flawonoidami i furanokumarynami soku
grejpfrutowego wywołują 3-12 krotny wzrost
stężenia leku we krwi. Są to m.in.: blokery
kanału wapniowego, statyny, leki
przeciwhistaminowe, leki immunosupresyjne
i leki przeciwwirusowe. Popicie leku
przeciwhistaminowego, stosowanego często
przy alergii, sokiem grejpfrutowym powoduje
zahamowanie, przez składniki soku,
czynności układu enzymatycznego
cytochromu P-450, metabolizującego lek w
wątrobie, co prowadzi do 300-700% wzrostu
stężenia leku we krwi, czego konsekwencją
mogą być komorowe zaburzenia rytmu serca.

• W przypadku spożycia dużej ilości produktów
bogatych w tyrozynę (źródło tyraminy) i zażycie
leków – inhibitorów oksydazy monoaminowej MAO,
tyramina nie ulega przemianom do nieczynnych
metabolitów. Wysokie stężenie tyraminy powoduje
pobudzenie adrenergiczne, które objawia się
wzrostem ciśnienia, tachykardią i przełomem
nadciśnieniowym. Tyramina (w normalnych
warunkach) dzięki działaniu oksydazy
monoaminowej (MAO) przekształcana jest do
nieczynnych metabolitów tyraminy, dzięki czemu
nie następuje pobudzenie adrenergiczne
organizmu

• Tyrozyna zawarta jest w wielu produktach, w
większej ilości m.in. w: dojrzewających serach,
niektórych wędlinach (salami), rybach
marynowanych, solonych i wędzonych, wątróbce,
przejrzałych bananach, awokado i figach,
czekoladzie i niektórych winach (wermut).
• Do leków, które mają zdolność hamowania oksydazy
monoaminowej (MAO) należą:
- inhibitory MAO stosowane w leczeniu zespołów
depresyjnych
- furozalidon stosowany w leczeniu zakażeń
żołądkowo-jelitowych (np. salmonellozy)
- izoniazyd stosowany w leczeniu gruźlicy płuc

4. Działanie synergistyczne i
antagonistyczne leków i składników
żywności
• synergizm addycyjny, w którym reakcja
organizmu równa jest sumie działania leku i
konkretnego składnika żywności.
Przykładem jest działanie teofiliny i kofeiny,
mających podobny mechanizm działania.
Kofeina zmniejsza metabolizm teofiliny w
wątrobie, co powoduje wzrost jej stężenia
we krwi. U osób z astmą oskrzelową
leczonych preparatami teofiliny
spożywających 2-3 filiżanki kawy dziennie
może dojść do objawów ubocznych takich,
jak ból głowy, niepokój, tachykardia,
zaburzenia snu itp.

• synergizm hiperaddycyjny, w którym działanie
leku i składnika żywności jest większe niż suma
działania każdego z tych czynników oddzielnie.
Glicyryzyna zawarta w lukrecji, stosowana m.
in. jako środek wykrztuśny i przeczyszczający,
powoduje zwiększenie wydalania przez nerki
potasu. Jednoczesne stosowanie diuretyków
pętlowych (np. Furosemid) może przyczynić się
do nadmiernego wydalenia jonów potasu, czego
konsekwencją jest osłabienie, bolesne skurcze
mięśni, porażenia, zaburzenia przewodzenia i
rytmu serca.

• Natomiast przykładem antagonistycznego
działania leków i składników żywności
może być zmniejszenie działania leków
przeciwzakrzepowych stosowanych w
profilaktyce zakrzepicy naczyń (np.
acenokumarolu hamującego syntezę
witaminy K) przy jednoczesnym
spożywaniu produktów bogatych w
witaminę K (brokuły, fasola, kalafior, jaja).
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
Wyszukiwarka
Podobne podstrony:
Interakcje leków 2
FARMAKOKINETYCZNE INTERAKCJE LEKÓW I ŻYWNOŚCI, KOSMETOLOGIA, ZDROWIE USTAWY I MEDYCYNA
Interakcje lekow ze skladnikami Nieznany
Interakcje leków z żywnością
Interakcje leków psychotropowych 2
Interakcje leków w praktyce stomatologicznej
Interakcje leków stosowanych w chorobach układu krążenia, Farmacja
Interakje leków stosowanych w chorobach układu krążenia
INTERAKCJE LEKOW drLuszczyna id Nieznany
Interakcje leków i diety z metodami lab materiały dla studentów dietetyki
Interakcje leków z żywnością, Farmakologia
Interakcje leków, ❒ DOKUMENTY, ▣ TECHNIK FARMACEUTYCZNY, • Farmakologia
Interakcje leków
INTERAKCJE LEKÓW OTC mat CW
INTERAKCJE lekow z zywnoscia
INTERAKCJE LEKÓW - notatka, Ratownictwo Medyczne, FARMAKOLOGIA, 1 ROK, 1
Interakcje leków
więcej podobnych podstron