
IMMUNOLOGIA
TRANSPLANTACYJN
A

NOMENKLATURA HLA
Podwójna nomenklatura
serologiczna
genetyczna
zatwierdzona przez Komitet
Nomenklatury HLA przy WHO

Nomenklatura
serologiczna
• Konieczne jest określenie układu
genetycznego, czyli HLA, dodanie myślnika i
locus, a następnie numeryczne oznaczenie
antygenu, np. HLA-B16, HLA-B39
• Jeśli w danym locus wykryto dwa antygeny, to
ich oznaczenia numeryczne oddziela się
przecinkami, a jeśli badano więcej niż jedno
locus, to kolejne loci należy dopisywać po
średniku. Na końcu zapisu fenotypu osoby
badanej należy postawić kropkę, np.:
HLA-A1, 2; b7, 13; Cw7.
Zapis ten oznacza, że metodą serologiczną
wykonano typowanie loci A, B i Cw, w których wykryto
odpowiednie antygeny, przy czym w locus Cw wykryto
tylko jeden antygen.

Nomenklatura
genetyczna
• Zapis rozpoczyna się od nazwy układu genetycznego,
tj. „HLA” (którą można ominąć, jeśli nie ma
wątpliwości, że opisujemy gen HLA).
• Następnie wpisujemy myślnik, oznaczenie locus
gwiazdkę oraz cyfrowe lub cyfrowo-literowe
oznaczenie allelu.
• Dwie pierwsze cyfry po gwiazdce (np. A*02) oznaczają
grupę alleli najczęściej odpowiadającą antygenowi
serologicznemu o tym samym numerze (A2). Zapis
dwucyfrowy dotyczy wyniku genotypowania o
niskiej rozdzielczości.
• Cyfry trzecia i czwarta po * oznaczają numer
konkretnego allelu w tej samej grupie (np. A*0201,
A*0205).
• Zapis czterocyfrowy jest możliwy po otrzymaniu
wyniku genotypowania o wysokiej rozdzielczości.
• Piątą i szósta cyfra oznacza substytucję nukleotydu w
genie, która prowadzi do zmiany sekwencji
aminokwasów w cząsteczce antygenu HLA (tzw.
sybstytucja synonimowa).

Czynniki wpływające na
wynik transplantacji:
• Stopień zgodności HLA biorcy i
dawcy
• Rozpoznanie choroby i jej faza
• Wiek pacjenta (do niedawna górna
granica to 40 lat)
• Przebyte zakażenia, głównie CMV
• Różnice w grupach krwi
• Przygotowanie chorych do
transplantacji
• Przygotowanie przeszczepu

Źródła komórek
krwiotwórczych do
przeszczepiania:
Dawcą klasycznym jest całkowicie
zgodny brat lub siostra.
Dawcy alternatywni to:
1. Całkowicie zgodni pod względem HLA
– rodzice, dzieci, dalsi krewni, krew
pępowinowa od zgodnego rodzeństwa
oraz dawcy niespokrewnieni.
2. Częściowo niezgodni – członkowie
rodziny, krew pępowinowa i dorośli
dawcy niespokrewnieni oraz dawcy
haploidentyczni.

Dobór dawcy rodzinnego
spośród
rodzeństwa
Dotyczy 4 lub 5 loci HLA : A, B, Cw, DRB1 i
ewentualnie DQB1.
Dobór obejmuje następujące etapy:
1. Wstępne oznaczenie HLA w zakresie A, B, (Cw) met.
Serologiczną lub A, B, DRB1 met. Genetyczną na
poziomie niskiej rozdzielczości u chorego i jego
rodzeństwa, a także rodziców lub dzieci.
2. Wybór potencjalnego dawcy (a raczej wszystkich
dostępnych całkowicie zgodnych dawców).
3. Typowanie potwierdzające z nowych próbek, tj.
uzupełnienie i potwierdzenie wyników oznaczania HLA
osób zgodnych (dawcy/dawców i biorców) metodą
genetyczną w zakresie A, B, Cw, DRB1 (DQB1).
4. Analiza haplotypów wszystkich dostępnych członków
najbliższej rodziny i wydanie opinii dotyczącej
całkowicie zgodnych potencjalnych dawców w rodzinie
chorego.

Poszukiwanie rodzeństwa
zgodnego w HLA,
analiza haplotypów
RODZICE
Haplotyp
MATKA
A*01-B*08-Cw*07-DRB1*15
(a)
A*02-B*1501-Cw*03-
DRB1*13 (b)
OJCIEC
A*01-B*08-Cw07-DRB1*03
(c)
A*02-B*27-Cw*01-DRB1*01
(d)
DZIECI
Haplotyp
Chory
A*01-B*08-Cw*07-DRB1*15 (a)
A*01-B*08-Cw07-DRB1*03 (c)
Brat 1
A*02-B*1501-Cw*03-DRB1*13 (b)
A*02-B*27-Cw*01-DRB1*01 (d)
Brat 2
A*01-B*08-Cw*07-DRB1*15 (a)
A*02-B*27-Cw*01-DRB1*01 (d)
Siostra 1
A*02-B*1501-Cw*03-DRB1*15
(b+a)
A*01-B*08-Cw07-DRB1*03 (c)
Siostra 2
A*01-B*08-Cw*07-DRB1*15 (a)
A*01-B*08-Cw07-DRB1*03 (c)

• Szczególnym przypadkiem
transplantacji od rodzeństwa jest
wykorzystanie rodzinnej krwi
pępowinowej
• Istnieje Bank Krwi Pępowinowej
Bank Komórek
Macierzystych
• Bardzo skuteczny sposób
transplantacji
•
Prawdopodobieństwo zgodności
krzyżowej kolejnego dziecka z
dzieckiem chorym wynosi 25%

Dobór dawcy komórek
krwiotwórczych spośród
krewnych I stopnia
(rodziców lub dzieci)
• Może być przeprowadzony równolegle ze wstępną
analizą przydatności rodzeństwa.
• Wstępne typowanie 2 lub 3 loci udaje się
najczęściej stwierdzić, czy ktoś z krewnych I
stopnia może być dalej rozważany jako
potencjalny dawca.
• Wstępne typowanie rodziców lub potomstwa może
wykazać częściową zgodność.
• Osoby z niezgodnym drugim haplotypem są
przeważnie dyskwalifikowane jako dawcy, a w
przypadku wysokiej zgodności drugiego
haplotypu (2-4 sposród 5 loci) rozważa się
wykonanie przeszczepiania haploidentycznego.
• Podczas doboru istotny jest również wiek chorego
i dawcy, rozpoznanie i faza choroby, techniczna
możliwość eliminacji limfocytów T z przeszczepu
lub przeprowadzenie tzw. minitransplantacji ).

Dobór dawcy komórek
krwiotwórczych
spośród dawców
niespokrewnionych
• Celem jest znalezienie w zakresie 5
loci: HLA-A, B, Cw, DRB1, DQB1 na
poziomie alleli.
• Dopuszczalna jest niezgodność
jednego allelu większa ich liczba
lub niezgodności antygenowe
powinny być rozważone przez
transplantologów.

Etapy doboru dawcy
niespokrewnionego:
1. Potwierdzające typowanie pacjenta (na podstawie
innej próbki niż próbka użyta do badania
wstępnego, metodą o wysokiej rozdzielczości w
zakresie 5 loci).
2. Przegląd bazy BMDW (światowa baza dawców
szpiku) i analiza możliwości znalezienia zgodnego
dawcy.
3. Wybór rejestru i prośba o jego wstępne
przeszukiwanie
4. Wybór potencjalnie najlepszego dawcy na podstawie
wstępnych informacji otrzymanych bezpośrednio z
rejestrów.
5. Sprowadzenie próbki dawcy na typowanie
potwierdzające.
6. Wykonanie potwierdzającego typowania dawcy (w
nowej próbce, metodą o wysokiej rozdzielczości w
zakresie 5 loci ).
7. Raport do ośrodka transplantacji szpiku o dobraniu
zgodnego dawcy.
8. Rezerwacja dawcy w macierzystym rejestrze po jego
wstępnej akceptacji przez ośrodek transplantacji
szpiku.

Dawca w szerokiej
rodzinie chorego
• Brak w pełni zgodnych niespokrewnionych
dawców przed rozpoczęciem poszukiwania
dawcy częściowo niezgodnego, zasadne jest
przeanalizowanie szerokiej rodziny chorego, w
celu znalezienia wśród jej członków całkowicie
zgodnego dawcy.
• Wykorzystanie częstego haplotypu u chorego
wymaga zbadania dużej liczby krewnych, a
rezultat jest niepewny.
• Wykrycie pokrewieństwa małżeństw i istnienia
„obustronnych” krewnych chorego jest znacznie
łatwiejsze- przeprowadzamy wywiad rodzinny.

Testy serologiczne

Test mikrocytotoksyczny
(mikrolimfocytotoksyczny)
(met. zależna od p/ciał
limfocytotoksycznych)
• Jeżeli na limfocytach, które są komórkami
docelowymi występuje Ag zgodny z
odpowiednio zastosowanymi p/ciałami
dochodzi do powstania kompleksu.
Następnie dodawany jest dopełniacz, przy
wystarczającej ilości p/ciał, uaktywniony
dopełniacz uszkadza błonę komórkową i
zwiększa jej przepuszczalność wywołując
lizę komórki.
• Martwe komórki wykrywane są przez
dodanie barwnika (eozyna/błękit trypanu) i
wykorzystanie faktu, że żywe komórki są
oporne na jego działanie.

Test
limfocytotoksyczny
wg
Terasakiego
w modyfikacji
NIH
1. Izolacja żywych limfocytów.
2. Przygotowanie zestawu testowych surowic
o znanych swoistościach HLA i surowic
kontrolnych.
3. Wprowadzenie limfocytów do wszystkich
dołków na płytce Terasakiego z surowicami
diagnostycznymi i inkubacja.
4. Dodanie surowicy króliczej zawierającej
składniki dopełniacza i inkubacja.
5. Dodanie barwnika (eozyna).
6. Zablokowanie
reakcji
cytotoksycznej
(dodanie formaliny).
7. Odczyt reakcji w mikroskopie inwersyjnym
i analiza wyników.
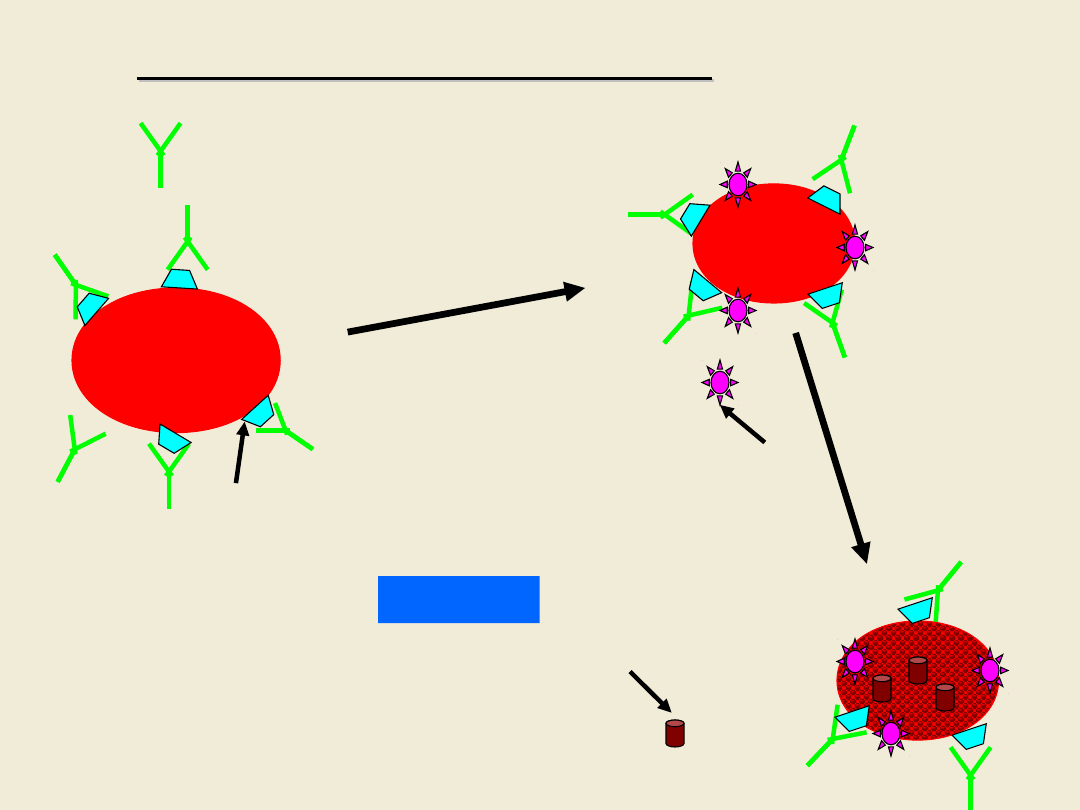
limfocyt
in vitro
p/ciała anty-HLA
w surowicy badanej
Test mikrocytotoksyczny
Test mikrocytotoksyczny
Ag HLA
dopełniacz
eozyna

Metody komórkowe
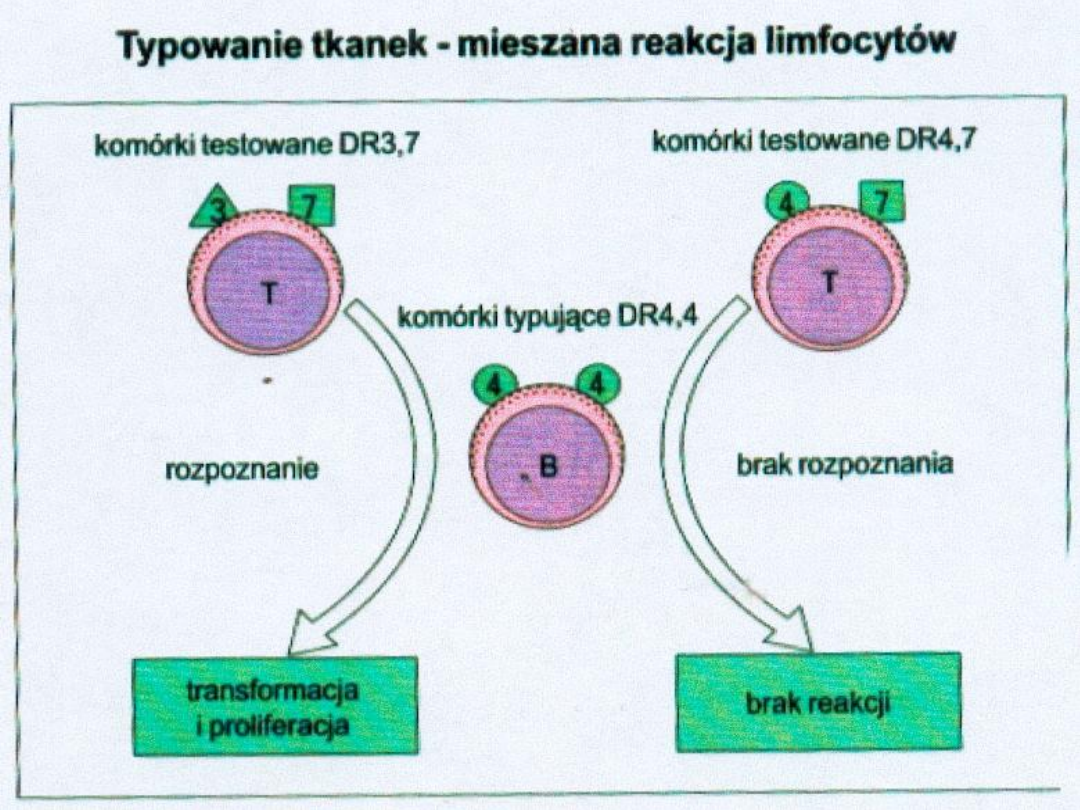
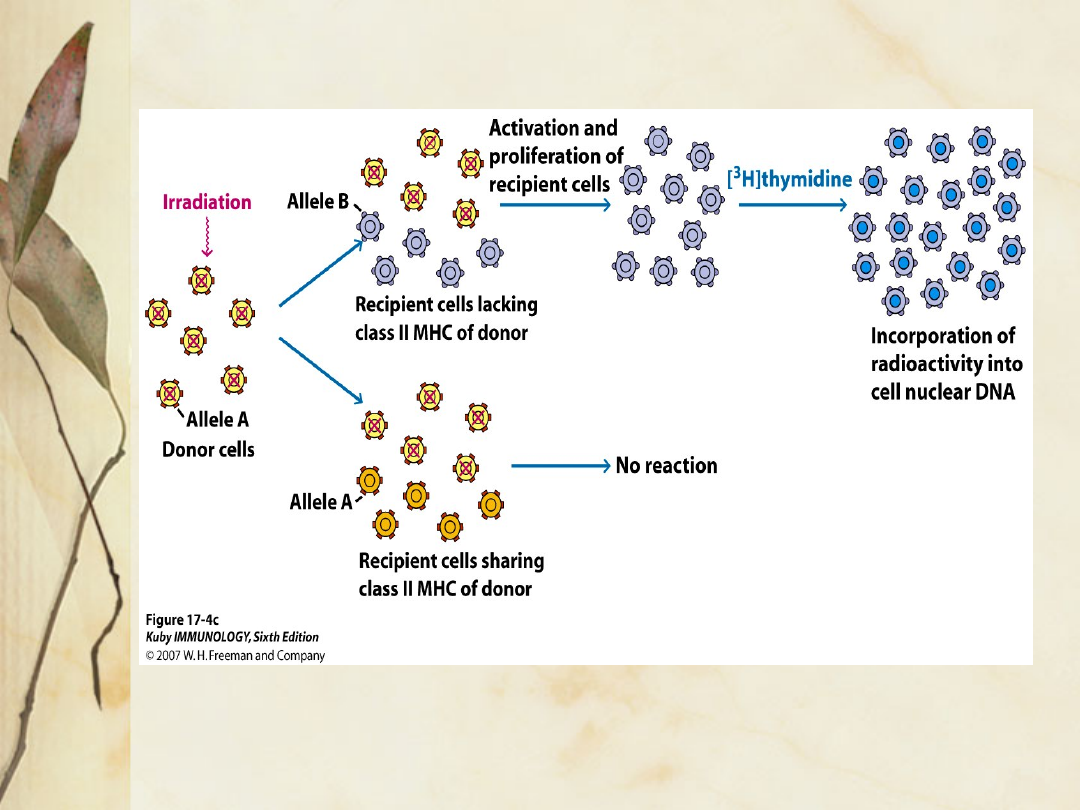
Test mieszanej hodowli leukocytów (MLC/MLR):
-Limfocyty dwóch osób są hodowane razem, co
pozwala na wzajemne oddziaływanie Ag
powierzchniowych
.
Jeżeli Ag HLA-DR i –DQ nie są całkowicie
identyczne, limfocyty ulegają stymulacji,
powiększają się i proliferują w ciągu 5 dni.
Przebieg transformacji blastycznej i syntezę
DNA mierzy się przez dodanie tymidyny
znakowanej trytem- zużycie odczynnika
znakowanego izotopem jest proporcjonalne
do syntezy DNA podczas dzielenia się
komórek.
Im słabsza odpowiedź, tym większa szansa na
utrzymanie się przeszczepu.

Metody genetyczne
• Pozwalają na wykrycie wielu polimorficznych
genów, których nie można zdefiniować
konwencjonalnymi metodami
serologicznymi.
• Techniki z zastosowaniem:
- p/ciał monoklonalnych
- sond oligonukleotydowych
- reakcji łańcuchowej polimerazy
- badanie polimorfizmu metodą
analizy długości fragmentów
restrykcyjnych

Metody badania HLA
na
poziomie DNA

SSP – etapy
genotypowania HLA
metodą swoistych
primerów
1. Izolacja DNA.
2. Amplifikacja DNA, która jest swoista wskutek
reakcji wielu par primerów, będących krótkimi
fragmentami DNA. Primery obejmują tylko
polimorficzne miejsca eksonu, właściwe dla
jednego lub kilku określonych swoistości
allelicznych.
3. Elektroforeza wielu produktów PCR.
4. Odczyt wzrokowy lub archiwizacja fotograficzna.
5. Analiza komputerowa zbioru wszystkich
dodatnich i ujemnych wyników
PCR.
6. Interpretacja immunogenetyczna.

SSOP – etapy
genotypowania HLA
metodą swoistych sond
oligonukleotydowych
1. Izolacja DNA.
2. Amplifikacja DNA, która jest swoista, gdyż opiera
się zwykle tylko na jednej parze primerów, łączącej
się z eksonem poza obszarem polimorficznym i
obejmującej cały ekson.
3. Hybrydyzacja swoista produktu amplifikacji z
użyciem wielu sond swoistych dla kilku określonych
alleli, utrwalonych na pasku nitrocelulozy.
4. Barwienie produktów hybrydyzacji.
5. Odczyt wzrokowy lub automatyczny.
6. Komputerowa analiza komputerowa allelicznych
swoistości sond, które hybrydyzowały z badanym
DNA, wraz z eliminacją swoistośći allelicznych tych
sond, które nie hybrydyzowały.
7. Interpretacja immunogenetyczna.

SBT – etapy
sekwencjonowania
genów HLA
1. Izolacja DNA.
2. Amplifikacja obejmująca najczęściej fragmenty
jednego lub dwóch eksonów z wykorzystaniem
znakowania tzw. Nukleotydami kończącymi. W
wyniku tak zmodyfikowanego procesu amplifikacji
powstają fragmenty DNA różniące się do siebie
długością dokładnie o jeden nukleotyd, a ostatni
przyłączony nukleotyd jest znakowany jeden z
czterech barwników fluorescencyjnych.
3. Elektroforeza porządkująca fragmenty DNA pod
względem ich długości.
4. Detekcja laserowa, która wykrywa znakowane
nukleotydy kończące fragmentów DNA. Dzięki
elektroforezie fragmenty te ułożone są zgodnie z ich
długością, co umożliwia określenie jaki nukleotyd
kończył każdy z kolejnych coraz dłuższych
fragmentów sekwencjonowanego genu.
5. Analiza porównawcza bibliotek sekwencji alleli HLA.
6. Interpretacja immunogenetyczna.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Seminarium 6 Immunologia transplantacyjna farmacja 2
Fizyka cw 15 cw 32, Transport UTP, semestr 1, ffiza, laborki różne, fizyka laborki, fizyka laborki,
Cw 27maciej, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), Cw 27
Cw 27macie2j, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), Cw 27
Cw 6 Immunodiagnostyka chorób z autoagresji 2 wersja
26. Immunologia transplantacyjna, immunologia, immunologia, Immunologia, streszczenia
Immunologia ćw. 6, Immunologia, notatki
CW 20, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza laborki (rozwiązania), Cw 20
Ćw. 8moje, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), CW8
Imm Cw 6 Immunodiagnostyka chor b z autoagresji
immunosupresja w transplantologii w
immunologia transplantacyjna ok, Immunologia
Ćw 18, TRANSPORT UTP BYDGOSZCZ, III semestr, Mechanika płynów
więcej podobnych podstron