
BIOLOGIA MOLEKULARNA
ĆWICZENIE VII
TRAWIENIE RESTRYKCYJNE DNA
ANALIZA JAKOŚCIOWA I ILOŚCIOWA
KWASÓW NUKLEINOWYCH
Agnieszka Mierek-Adamska
Zakład Genetyki

ENZYMY RESTRYKCYJNE
Enzymy izolowane z różnych szczepów bakterii mające zdolność do rozpoznawania
specyficznej sekwencji DNA i przecinania dwuniciowej cząsteczki DNA
Nazewnictwo enzymów opiera się na literowych skrótach: pierwsza litera oznacza
rodzaj, a dwie następne gatunek bakterii z której pochodzi dany enzym; następna
litera oznacza szczep lub typ, a cyfra rzymska kolejne enzymy z danego szczepu
lub typu
Np.
E
co
R
I
–
pierwszy
enzym z
E
scherischa
co
li szczep
R
Y13
Większość enzymów rozpoznaje cztero- lub sześcionukleotydowe palindromowe
sekwencje (posiadające oś symetrii)
Enzymy restrykcyjne mogą generować „tępe” lub „lepkie” końce
Np. HaeIII 5’ GGCC 3’ 5’ GG CC 3’
3’ CCGG 5’ 3’ CC GG 5’ „tępe” końce
EcoRI 5’ GAATTC 3’ 5’ G AATTC 3’
3’ CTTAAG 5’ 3’ CTTAA G 5’ „lepkie” końce

ZASADY TRAWIENIA RESTRYKCYJNEGO
Jednostka enzymu restrykcyjnego to taka jego ilość, która trawi
kompletnie
1 μg DNA wzorcowego w czasie 1 godziny w warunkach optymalnych.
SKŁAD MIESZANINY DO TRAWIENIA RESTRYKCYNEGO
• DNA (genomowe, plazmidowe)
• odpowiedni bufor (1/10 objętości końcowej; wyjątek YellowTango 2x – 2/10)
• enzym restrykcyjny (objętość nie może przekraczać 1/10 objętości końcowej)
• sterylna woda (do objętości końcowej)
!!!! Niektóre enzymy posiadają aktywność
star
!!!!
Większość enzymów działa w temperaturze 37°C

10X Buffer B (blue)
10 mM Tris-HCl (pH 7.5 at 37°C),
10 mM MgCl2,
0.1 mg/ml BSA
10X Buffer G (green)
10 mM Tris-HCl (pH 7.5 at 37°C),
10 mM MgCl2,
50 mM NaCl,
10X Buffer O (orange)
50 mM Tris-HCl (pH 7.5 at 37°C),
10 mM MgCl2,
100 mM NaCl,
10X Buffer R (red)
10 mM Tris-HCl (pH 8.5 at 37°C),
10 mM MgCl2,
100 mM KCl,
10X Buffer Tango™ (yellow)
33 mM Tris-acetate (pH 7.9 at 37°C),
10 mM magnesium acetate,
66 mM potassium acetate,
0.1 mg/ml BSA
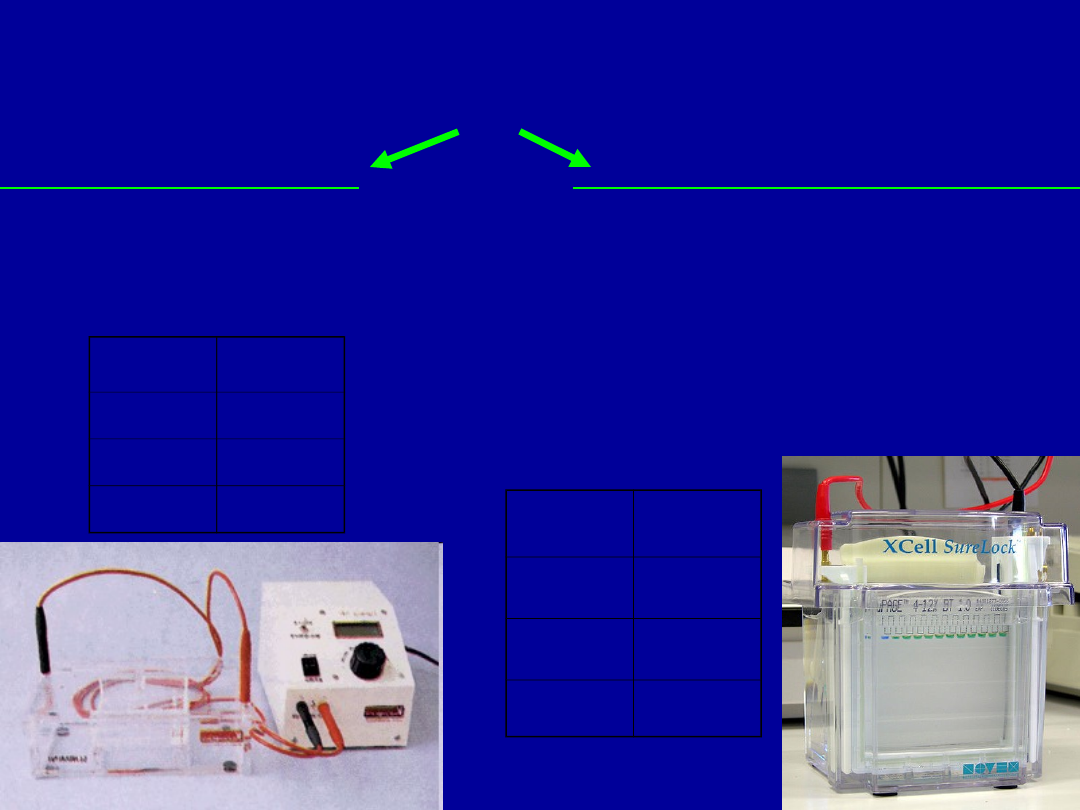
ANALIZA JAKOŚCIOWA KWASÓW NUKLEINOWYCH
ELEKTROFOREZA
w żelach agarozowych
w żelach poliakryloamidowych
• polimer pochodnych galaktozy
• pory 100-300 nm
• aparaty poziome
0,7 %
0,8-10 kb
0,9 %
0,5-7 kb
1,2 %
0,4-6 kb
2,0 %
0,1-2 kb
• polimer akryloamidu z
N,N-metylenobisakryloamidu
• rozdział cząsteczek różniących się
wielkością nawet o kilka nukleotydów
• aparaty pionowe
3,5 %
1000-
2000bp
5,0 %
80-500
bp
12,0 %
400-200
bp
20,0 %
6-100 bp
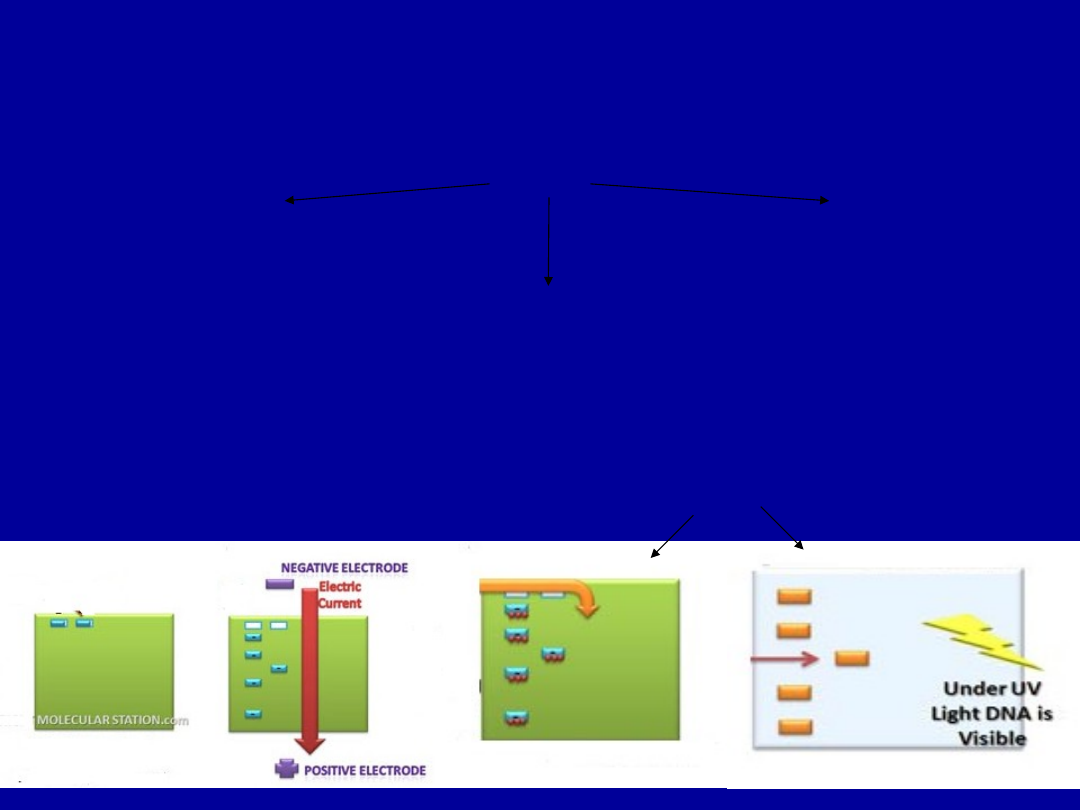
ANALIZA JAKOŚCIOWA KWASÓW NUKLEINOWYCH
ELEKTROFOREZA W ŻELACH AGAROZOWYCH
Bufory do elektroforezy
TAE
TBE
Tris buforowany kwasem octowym
oraz EDTA
Tris buforowany kwasem borowym
oraz EDTA
TPE
Tris buforowany kwasem fosforowym
oraz EDTA
Wizualizacja DNA w żelu
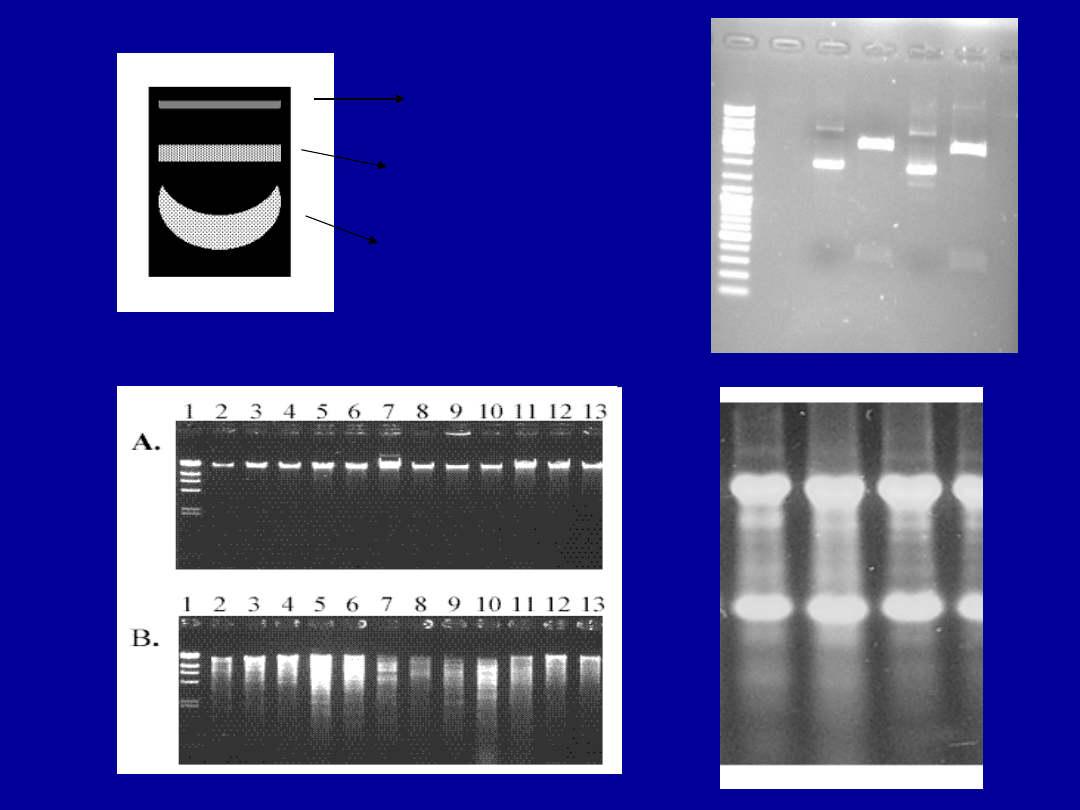
DNA genomowe: A-nietrawione, B-trawione
RNA
DNA plazmidowe:
A,C – nietrawione,
B, D - trawione
A B C D
superzwinięta
forma OC
DNA plazmidowe
liniowa
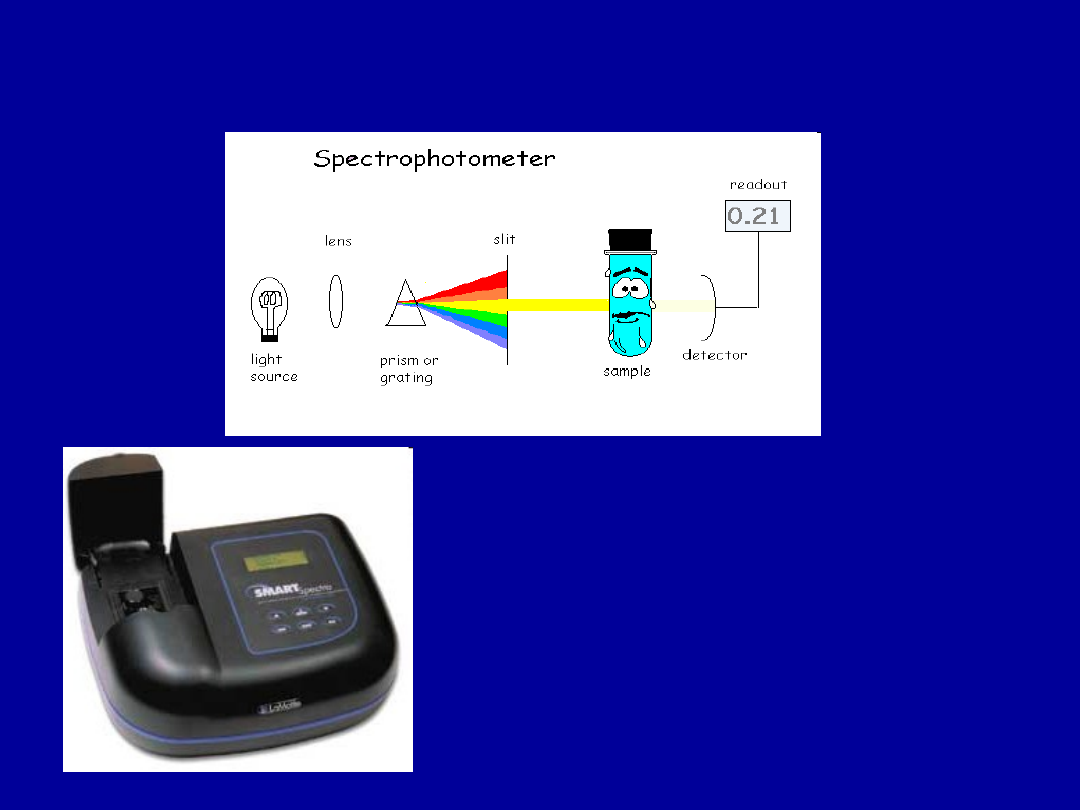
ANALIZA ILOŚCIOWA KWASÓW NUKLIENOWYCH
POMIAR SPEKTROFOTOMETRYCZNY
Absorbancja – 0,200 – 1,000
Ratio (stosunek A
260nm
/A
280nm
)
Stężenie DNA (µg/µl)
Stężenie białek (mg/ml)
Czystość (%)

ZADANIA NA DZISIAJ
•
strawić restrykcyjne DNA plazmidowe
• przygotować żel agarozowy
• przygotować próby do nałożenia na żel
• przygotować próby do pomiaru stężenia
• nałożyć próby na żel
• zmierzyć stężenia DNA wyizolowanych na poprzednich zajęciach
Document Outline
Wyszukiwarka
Podobne podstrony:
3 ćwiczenia BADANIE asfaltów
Cwiczenia 2
Ćwiczenia V
metody redukcji odpadów miejskich ćwiczenia
Ćwiczenia1 Elektroforeza
cwiczenia 9 kryzys
Ćwiczenia 1, cz 1
Ćwiczenie 8
9 ćwiczenie 2014
Cwiczenie 1
Ćwiczenie 2 Polska w europejskim systemie bezpieczeństwa
11 CWICZENIE 1 SEMESTR LETNIid 12747 ppt
więcej podobnych podstron