
Prof. dr hab. inż. Lech Chmurzyński
PROGRAM WYKŁADÓW - semestr pierwszy
PROGRAM WYKŁADÓW - semestr pierwszy
PRZEDMIOT:
PRZEDMIOT:
CHEMIA OGÓLNA
CHEMIA OGÓLNA
I CHEMIA –
I CHEMIA –
specjalności: ANALITYKA I DIAGNOSTYKA,
specjalności: ANALITYKA I DIAGNOSTYKA,
CHEMIA Z PRZYRODĄ, CHEMIA NOWYCH MATERIAŁÓW;
CHEMIA Z PRZYRODĄ, CHEMIA NOWYCH MATERIAŁÓW;
I AGROCHEMIA
I AGROCHEMIA
Poniedziałek
Poniedziałek
9:15 – 11:00
9:15 – 11:00
Piątek
Piątek
10:15 – 11:00
10:15 – 11:00
WYKŁAD WSTĘPNY
WYKŁAD WSTĘPNY
Omówienie spraw związanych z organizacją
zajęć,
warunkami
uzyskania
zaliczeń,
organizacją egzaminu. Podanie literatury.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii
BLOK TEMATYCZNY I
BLOK TEMATYCZNY I
Materia i jej budowa
Materia i jej budowa
Atomistyczna teoria budowy materii. Elementy
radiochemii.
Podstawowe
pojęcia
oraz
prawa
chemiczne. Prawa gazowe.
BLOK TEMATYCZNY II
BLOK TEMATYCZNY II
Równania chemiczne. Stechiometria. Roztwory
Równania chemiczne. Stechiometria. Roztwory
Elementy
stechiometrii.
Równania
chemiczne.
Roztwory – sposoby wyrażania stężeń.

BLOK TEMATYCZNY III
BLOK TEMATYCZNY III
Elektronowa struktura atomu
Elektronowa struktura atomu
Kwantowo – mechaniczny model budowy
atomu. Atomy wieloelektronowe. Rozbudowa
powłok elektronowych. Reguły obsadzania
poziomów energetycznych.
BLOK TEMATYCZNY IV
BLOK TEMATYCZNY IV
Układ okresowy pierwiastków
Układ okresowy pierwiastków
Układ okresowy pierwiastków. Promienie
atomowe i jonowe. Potencjał jonizacji i
powinowactwo elektronowe. Elektroujemność.
Kierunki zmian właściwości pierwiastków w
układzie okresowym.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

BLOK TEMATYCZNY V
BLOK TEMATYCZNY V
Wiązania chemiczne
Wiązania chemiczne
Wiązania metaliczne. Wiązania kowalencyjne
homopolarne i spolaryzowane oraz wiązania
koordynacyjne. Odstępstwa od reguły oktetu
elektronowego. Metody opisu elektronu w
cząsteczkach – teoria wiązań walencyjnych,
teoria hybrydyzacji orbitali atomowych, teoria
orbitali
molekularnych.
Homojądrowe
cząsteczki dwuatomowe.
BLOK TEMATYCZNY VI
BLOK TEMATYCZNY VI
Sposoby opisu cząsteczki
Sposoby opisu cząsteczki
Rząd
wiązania.
Heterojądrowe
cząsteczki
dwuatomowe.
Wiązania
pośrednie.
Elektroujemność w skali Paulinga. Proste
cząsteczki
wieloatomowe.
Cząsteczki
wieloatomowe z wiązaniami wielokrotnymi.
Promienie
kowalencyjne.
Orbitale
zlokalizowane. Wiązania zdelokalizowane.

BLOK TEMATYCZNY VII
BLOK TEMATYCZNY VII
Wiązania chemiczne niskoenergetyczne.
Wiązania chemiczne niskoenergetyczne.
Siły van der Waalsa i wiązania wodorowe. Inne
rodzaje wiązań chemicznych.
BLOK TEMATYCZNY VIII
BLOK TEMATYCZNY VIII
Fazy skondensowane
Fazy skondensowane
Ciała bezpostaciowe a krystaliczne. Sieć
przestrzenna. Wiązania w sieci przestrzennej
kryształów.
Kryształy
molekularne,
kowalencyjne, jonowe i metaliczne. Energia
sieciowa kryształów.
BLOK TEMATYCZNY IX
BLOK TEMATYCZNY IX
Roztwory.
Roztwory.
Rozpuszczalność
substancji.
Prawa
rozcieńczonych
roztworów
nieelektrolitów.
Prawo
Raoulta.
Osmoza.
Ciśnienie
osmotyczne.
Zjawiska
powierzchniowe
i
układy dyspersyjne. Roztwory koloidalne.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

BLOK TEMATYCZNY X
BLOK TEMATYCZNY X
Termodynamika chemiczna
Termodynamika chemiczna
Elementy
termodynamiki.
Ciepło
reakcji
chemicznej. Prawo Hessa. Entalpie wiązań
chemicznych. II i III zasada termodynamiki.
Entropia i entalpia swobodna.
BLOK TEMATYCZNY XI
BLOK TEMATYCZNY XI
Kinetyka i równowaga chemiczna.
Kinetyka i równowaga chemiczna.
Szybkość
reakcji
chemicznej.
Czynniki
wpływające na szybkość reakcji chemicznej.
Prawo
działania
mas.
Zależność
stałej
równowagi od temperatury. Reguła przekory.
Przesunięcia równowagi. Analiza czynników
wpływających na położenie stanu równowagi.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

BLOK TEMATYCZNY XII
BLOK TEMATYCZNY XII
Dysocjacja elektrolityczna. Elektrolity
Dysocjacja elektrolityczna. Elektrolity
Mechanizm dysocjacji elektrolitów właściwych
i potencjalnych. Solwatacja jonów. Woda i jej
struktura. Ciepło solwatacji. Model Borna
obliczania ciepeł solwatacji jonów. Struktura
otoczek
solwatacyjnych
jonów.
Modele
hydratacji jonu wodorowego.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii
BLOK TEMATYCZNY XIII
BLOK TEMATYCZNY XIII
Właściwości roztworów elektrolitów.
Właściwości roztworów elektrolitów.
Zależność
przewodnictwa
od
stężenia.
Przewodnictwo równoważnikowe. Stopień i stała
dysocjacji. Prawo rozcieńczeń Ostwalda. Właściwości
koligatywne
roztworów
elektrolitów.
Elektrolity
mocne. Moc jonowa. Współczynniki aktywności.
Elektrolity
słabe.
Mieszaniny
elektrolitów
(mieszanina dwóch słabych kwasów, mieszanina
mocnego i słabego kwasu).

BLOK TEMATYCZNY XIV
BLOK TEMATYCZNY XIV
Teorie kwasów i zasad
Teorie kwasów i zasad
Teoria Arrheniusa. Protonowa teoria kwasów i
zasad.
Ogólna
teoria
rozpuszczalnikowa.
Elektronowa teoria Lewisa. Twarde i miękkie
kwasy oraz zasady Pearson’a.
BLOK TEMATYCZNY XV
BLOK TEMATYCZNY XV
Właściwości kwasów i zasad w roztworach
Właściwości kwasów i zasad w roztworach
Autodysocjacja i iloczyn jonowy wody. Moc kwasów i
zasad. Mocne i słabe kwasy oraz zasady. Reakcje
protolityczne. Kwasy wieloprotonowe.
BLOK TEMATYCZNY XVI
BLOK TEMATYCZNY XVI
Amfoteryczność substancji.
Amfoteryczność substancji.
Kryterium amfoteryczności wodorotlenków. Kwasy i
zasady w rozpuszczalnikach niewodnych. Zależność
właściwości
kwasowo-zasadowych
od
budowy
cząsteczki. Niektóre prawidłowości zmian mocy
kwasów w roztworach.

BLOK TEMATYCZNY XVII
BLOK TEMATYCZNY XVII
Skala kwasowości i zasadowości roztworów
Skala kwasowości i zasadowości roztworów
wodnych
wodnych
Skala
pH.
Wskaźniki
kwasowo-zasadowe
(jedno- i dwubarwne).
BLOK TEMATYCZNY XVIII
BLOK TEMATYCZNY XVIII
Hydroliza jonowa
Hydroliza jonowa
Reakcje hydrolizy jako równowagi ustalające
się podczas rozpuszczania danej soli w
wodzie. Sole słabych kwasów oraz słabych
zasad. Sole kwasów wieloprotonowych oraz
zasad wielowodorotlenkowych. Amfolity.
BLOK TEMATYCZNY XIX
BLOK TEMATYCZNY XIX
Roztwory buforowe
Roztwory buforowe
Mechanizm działania buforów. Pojemność buforowa.
Wpływ mocy jonowej na pH roztworów buforowych.

BLOK TEMATYCZNY XX
BLOK TEMATYCZNY XX
Równowagi jonowe w roztworach – iloczyn
Równowagi jonowe w roztworach – iloczyn
rozpuszczalności
rozpuszczalności
Wytrącanie osadów. Frakcjonowane strącanie
osadów. Wpływ wspólnego i obcego jonu na
rozpuszczalność osadów.
BLOK TEMATYCZNY XXI
BLOK TEMATYCZNY XXI
Elementy elektrochemii
Elementy elektrochemii
Procesy utleniania i redukcji. Ogniwa galwaniczne.
SEM ogniwa. Elektrody redoks. Elektrody metaliczne.
Elektroda
wodorowa.
Szereg
elektrochemiczny
metali.
Położenie
metalu
w
szeregu
elektrochemicznym a możliwość jego reagowania z
wodą
oraz
kwasami.
Ogniwa
odwracalne
i
nieodwracalne. Szereg potencjałów standardowych.
Przewidywanie kierunku przebiegu reakcji redoks.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

BLOK TEMATYCZNY XXII
BLOK TEMATYCZNY XXII
Elektroliza
Elektroliza
Procesy katodowe i anodowe. Napięcie
rozkładowe. Prawa Faraday’a. Elektroliza
różnego typu kwasów, wodorotlenków i soli.
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii
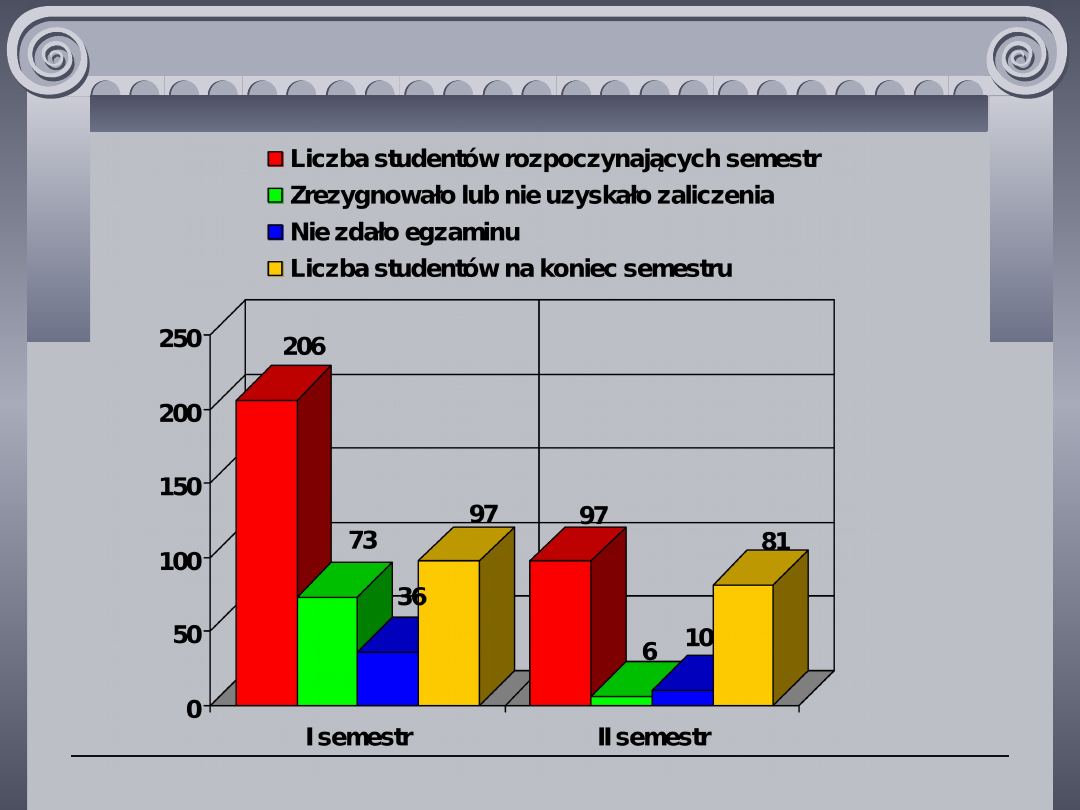
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

LITERATURA
LITERATURA
- A. Bielański - „Podstawy chemii nieorganicznej”
- A. Bielański - „Chemia ogólna i nieorganiczna”
- L. Jones, P. Atkins – „Chemia ogólna”
- J. D. Lee - „Zwięzła chemia nieorganiczna”
- F.A. Cotton, G. Wilkinson, P.L. Gaus - „Chemia nieorganiczna”
- L. Pajdowski - „Chemia ogólna”
- M. J. Sienko, R. A. Plane - „Chemia. Podstawy i własności”
- J. Amiel - „Chemia ogólna”, t. 1, 2
- L. Sobczyk, Adolf Kisza – „Chemia fizyczna dla przyrodników”

- K. Milton, Snyder – „Chemia struktura i
reakcje”
- L. Pauling, P. Pauling – „Chemia”
- R. T. Sanderson – „Podstawy chemii ogólnej”
- A. Ernt – „Podstawy chemii ogólnej i
nieorganicznej”
- W. Trzebiatowski – „Chemia nieorganiczna”
- T. Penkala – „Podstawy chemii ogólnej”
- J. Kaczyński, A. Czaplicki, „Chemia ogólna”
- L. A. Hiller, R.H. Herber – „Podstawy chemii”
- L. Cragg, R. Graham, „Podstawy chemii
ogólnej”
- „Obliczenia z chemii ogólnej”, Praca
zbiorowa, UG, Gdańsk
- „Ćwiczenia laboratoryjne z chemii ogólnej”,
części I i II, Praca zbiorowa, UG, Gdańsk
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

Cotton –
Cotton –
„Basic Inorganic Chemistry”
„Basic Inorganic Chemistry”
Literatura anglojęzyczna
Literatura anglojęzyczna
Cox –
Cox –
„Inorganic Chemistry”
„Inorganic Chemistry”
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii

Ebbing –
Ebbing –
General
General
Chemistry”
Chemistry”
Chang –
Chang –
„General Chemistry”
„General Chemistry”
Prof. dr hab inż. Lech Chmurzyński - Uniwesytet.Gdański - Wydział Chemii
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
spis lab I sem 2010
spis aud I sem 2010
spis lab I sem 2010
Wykład 3 powtórzenie 2010 studenci (1)
Wyklad 14 2010
Makroekonomia wyklad sem 3
Wyklad 11 2010
Metodologia - wykład 5.12.2010 - dr Cyrański, Metodologia nauk społecznych
hodowla kolos - wyklady, sem. 4, Hodowla roślin
MN energetyka zadania od wykładowcy 09-05-14, STARE, Metody Numeryczne, Część wykładowa Sem IV
wykład 8-31.05, WSA, prawo administarcyjne z prawem wspólnot samorządowych, wykłady, sem 2
Program wykładów 1 sem
WYKŁAD 12 2010
chow zwierzat gospodarskich i towarzyszacych wyklady sem III
Budownictwo przemyslowe spis wykładów
HARMONOGRAM ZALICZEŃ II SEM 2010
więcej podobnych podstron