
Właściwości mechaniczne materiałów
• moduł sprężystości,
• granica plastyczności,
• wytrzymałość,
• twardość,
• odporność na pękanie,
• wytrzymałość zmęczeniowa,
• odporność na pełzanie
Zjawiska występujące w
materiałach w trakcie
eksploatacji
• nagłe pękanie
• zmęczenie materiału
• pełzanie
• utlenianie i korozja
• tarcie i zużycie trybologiczne

Korozja jest to proces niszczenia materiałów w wyniku reakcji
chemicznych i elektrochemicznych zachodzących podczas
zetknięcia się materiału z otaczającym je środowiskiem gazowym
lub ciekłym. Proces zaczyna się na powierzchni.
Korozja
Ze względu na przyczyny zjawiska rozróżnia się dwa rodzaje korozji:
• chemiczną (utlenianie)
• elektrochemiczną
Rozpoczęty proces korozji, o ile nie ulegnie
zahamowaniu, prowadzi do całkowitego
zniszczenia detalu.
Odporność na korozję materiałów zależy głównie od:
1. Rodzaju materiału - składu chemicznego
2. Struktury
3. Stanu powierzchni
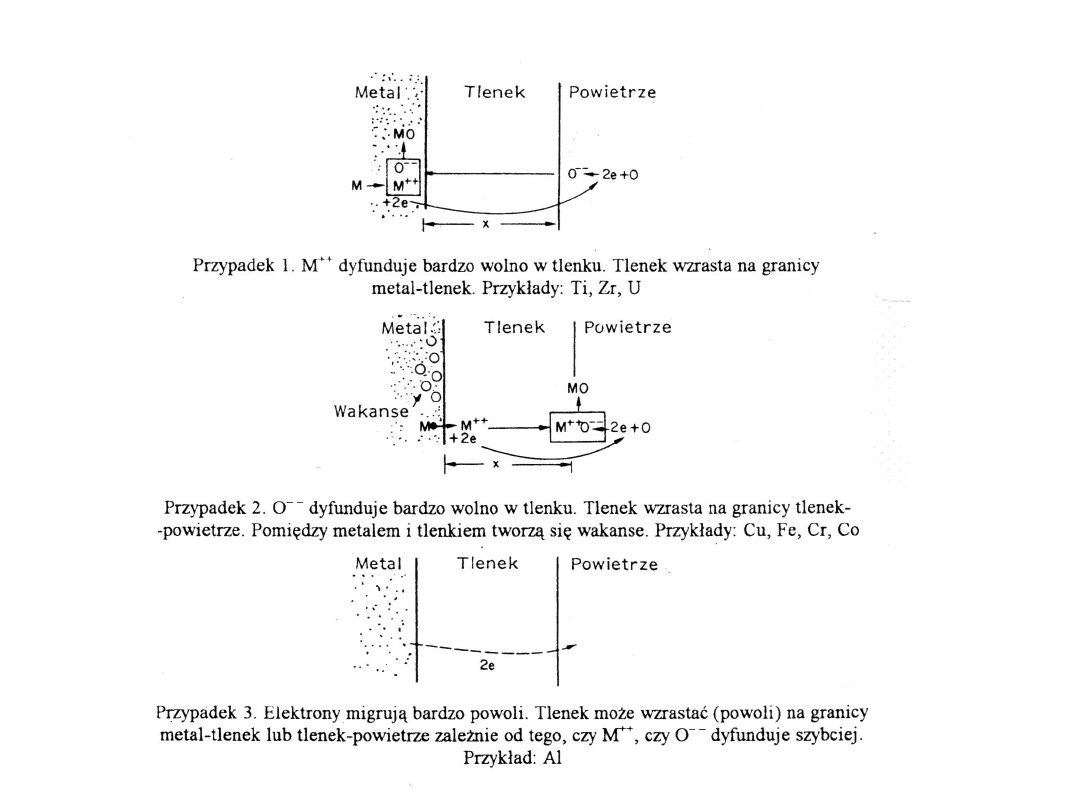
Korozja chemiczna metali - utlenianie - tworzenie tlenków
Szybkość utleniania zależna jest od szybkości dyfuzji jonów tlenu
lub metalu przez powstającą warstwę tlenku, jej przewodnictwa
elektrycznego i szczelności.
Tlenki o właściwościach ochronnych: Cr
2
O
3
, Al
2
O
3
, SiO
2
, TiO
2

Korozja elektrochemiczna zachodzi w cieczach, zwykle w
roztworach wodnych, na skutek przepływu prądu
elektrycznego, z jednej części metalu do drugiej, za
pośrednictwem elektrolitu. Przykładem jej może być
rozpuszczanie metali w kwasach.
Korozja elektrochemiczna
Korozja elektrochemiczna (w środowisku
wilgotnym)
zachodzi znacznie szybciej niż utlenianie
w suchych gazach
Korozja elektrochemiczna jest wynikiem działania lokalnych
ogniw galwanicznych tworzących się na powierzchni metalu.

Lokalne ogniwa korozyjne mogą powstawać:
• wskutek zetknięcia dwóch różnych metali
• w wyniku zetknięcia metalu z wtrąceniami niemetalicznymi
• wskutek częściowej pasywacji metalu, tj. częściowego
pokrycia go tlenkami
• w rezultacie naprężeń mechanicznych, występujących w
metalu
• jako ogniwa stężeniowe tworzące się wówczas, gdy kawałek
metalu styka się z roztworami o różnych stężeniach soli lub
tlenu.

Szereg elektrochemiczny metali:
Na< Mg< Al< Zn<
Fe< Cd< Co< Ni< Pb
< H<
Cu< Hg<
Ag< Au
ujemne potencjały normalne
dodatnie
potencjały normalne
metale “nieszlachetne”
metale
“szlachetne”
Każdy metal tego szeregu wypiera następne metale z roztworu ich
soli.
Im bardziej ujemna jest wartość potencjału normalnego metalu
tym większą posiada on tendencję do przechodzenia do roztworu,
czyli mniejszą odporność na korozję elektrochemiczną.

Przez pasywację rozumiemy zwiększenie odporności
metalu na korozję przez utworzenie na jego powierzchni
szczelnej i silnie przylegającej ochronnej warstewki
tlenków, która chroni metal przed oddziaływaniem
otaczającego środowiska.
Warstewka ochronna może być wytworzona przez
utlenienie powierzchni przez tlen gazowy lub jako wynik
procesu elektrochemicznego.
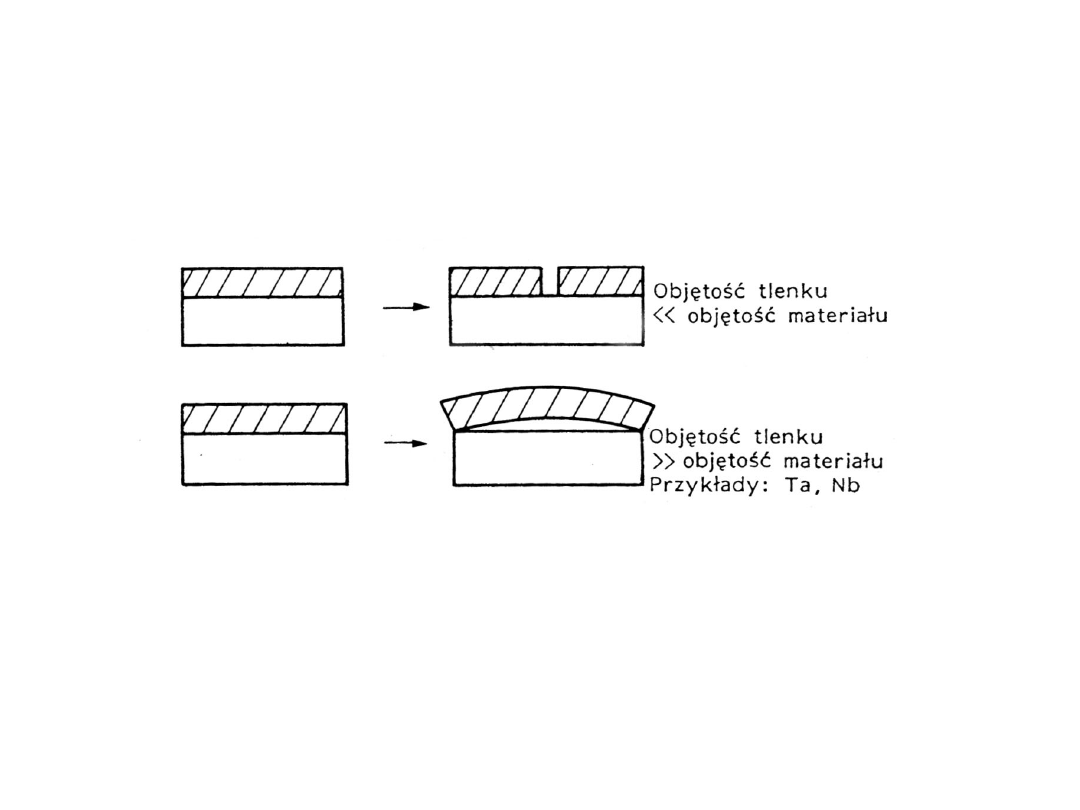
Ze względu na skutki zniszczenia
rozróżnia się korozję:
• równomierną
• międzykrystaliczną
•lokalną:
• wżerową
• naprężeniową
• selektywną
• kontaktową
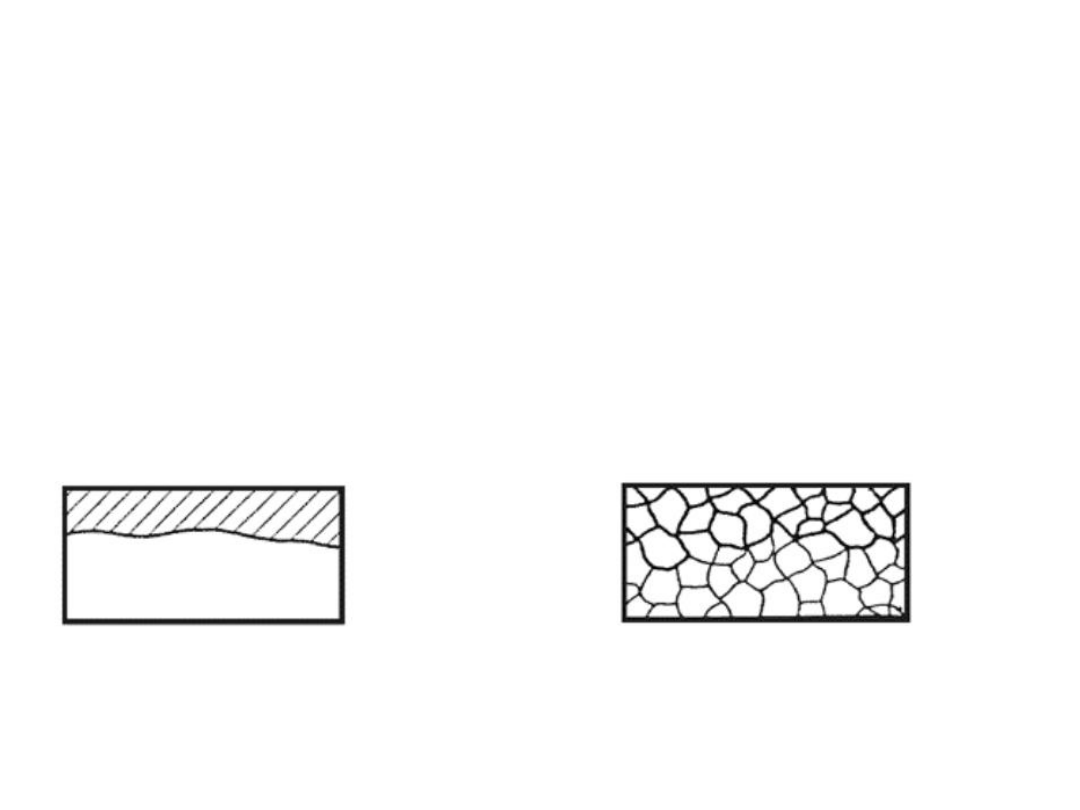
Korozja równomierna
Korozja międzykrystaliczna
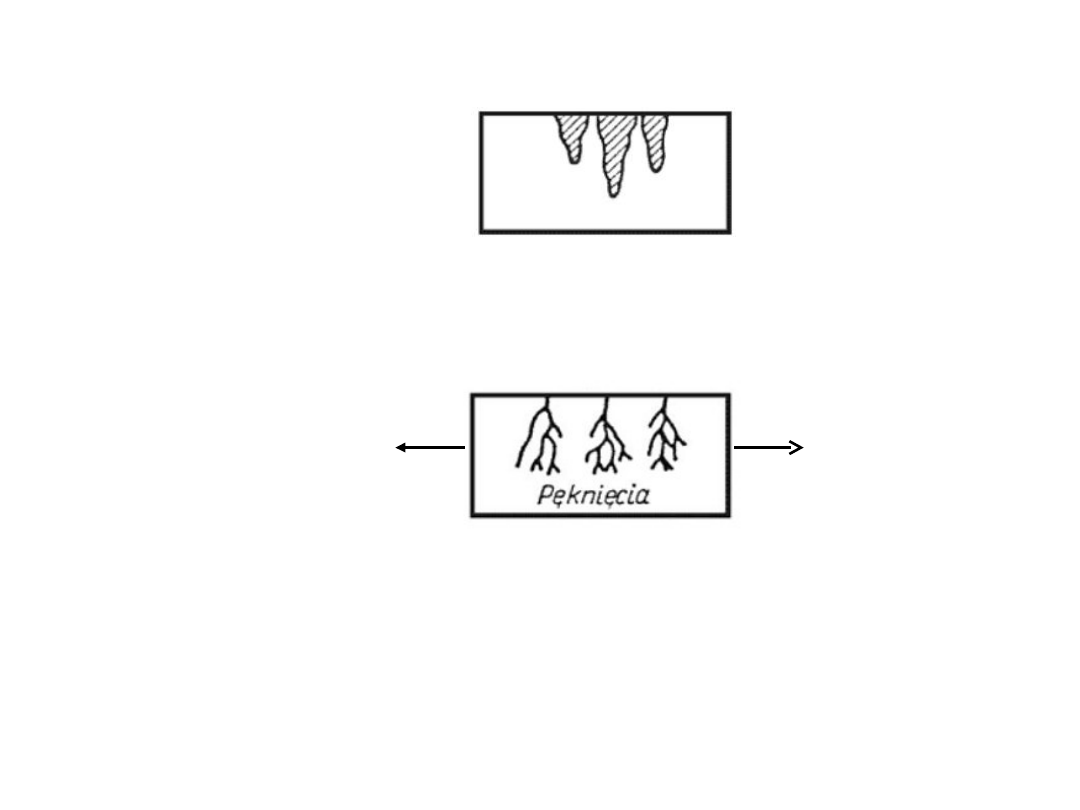
Korozja wżerowa
Korozja naprężeniowa
F
F
Korozja lokalna:
zachodzi na skutek istnienia w metalu naprężeń o kierunku
rozciągającym oraz ośrodka aktywnego.
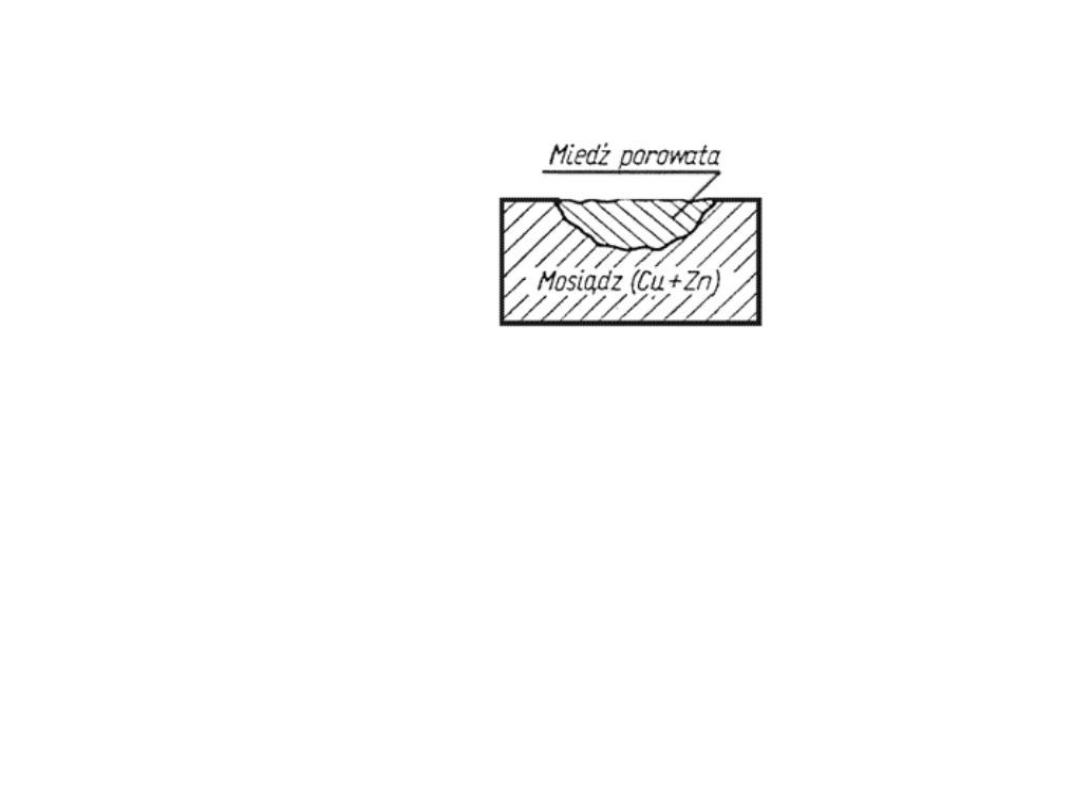
Korozja selektywna
Korozja kontaktowa
zachodzi w miejscu styku różnych stopów metali np. stali
ze stopem miedzi, dzięki czemu powstają lokalne ogniwa
prowadzące do znacznego ubytku metalu.

Ochrona przed korozją
Istnieje kilka sposobów ochrony przed korozją:
1. Dobór odpowiedniego metalu lub stopu.
2. Osłabienie agresywności środowiska.
Sposób ten można stosować, gdy ilość ośrodka atakującego jest
ograniczona.
• przez usuwanie tlenu z elektrolitów o odczynie obojętnym
np. odpowietrzanie wody kotłowej
• stosowanie inhibitorów (opóźniaczy). Są to substancje,
które dodane do środowiska agresywnego, zmniejszają
wybitnie szybkość procesów korozyjnych.
3. Stosowanie ochrony katodowej i
protektorowej
4. Stosowanie powłok ochronnych
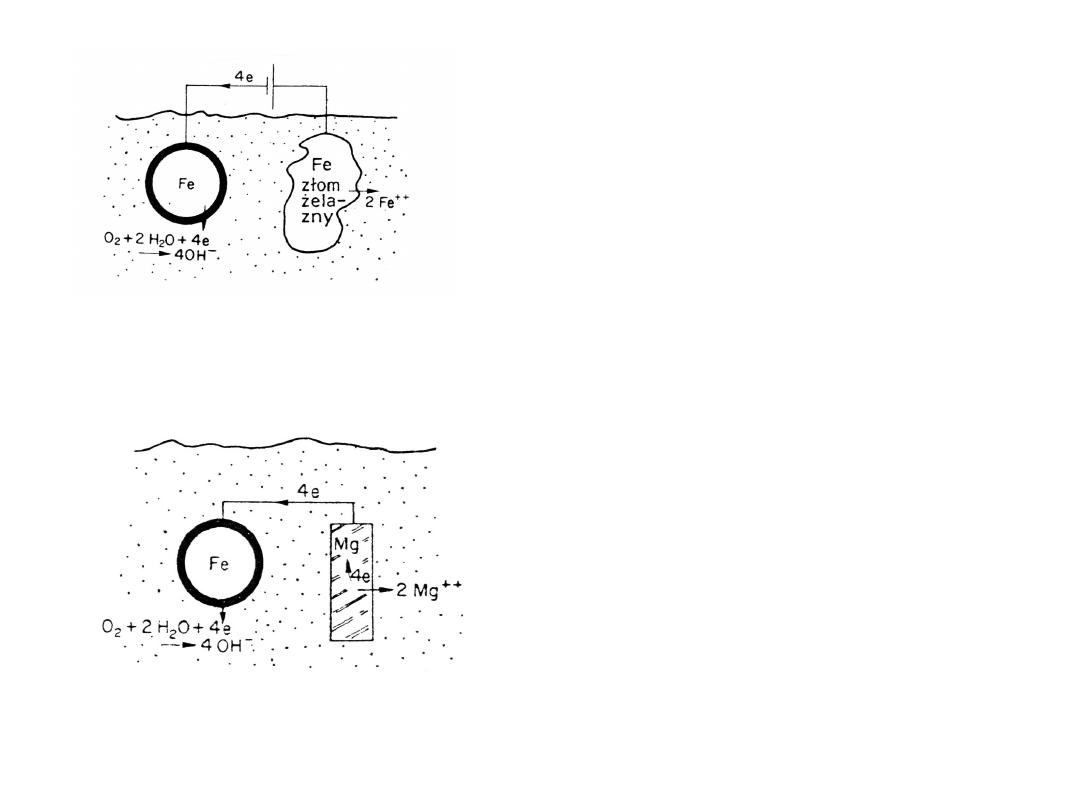
• ochrona katodowa (zewnętrzym
zródłem prądu) - polega na
utrzymywaniu takiej różnicy
potencjałów, aby chroniony metal
był zawsze katodą.
• ochrona protektorowa - jest
odmianą ochrony katodowej przy
użyciu zewnętrzej elektrody o
dostatecznie niskim potencjale w
szeregu elektrochemicznym
Wartości współczynników tarcia:
Idealnie czyste metale w próżni
>5
Czyste metale w powietrzu 0,5 - 2
Stal - stopy łożyskowe
0,1 – 0,5
Stal – ceramika
0,1 – 0,5
Metale i ceramika po polimerach
0,04 –
0,5
Smarowanie graniczne metali
0,05 –
0,2
Smarowanie hydrodynamiczne
0,001 –
0,005
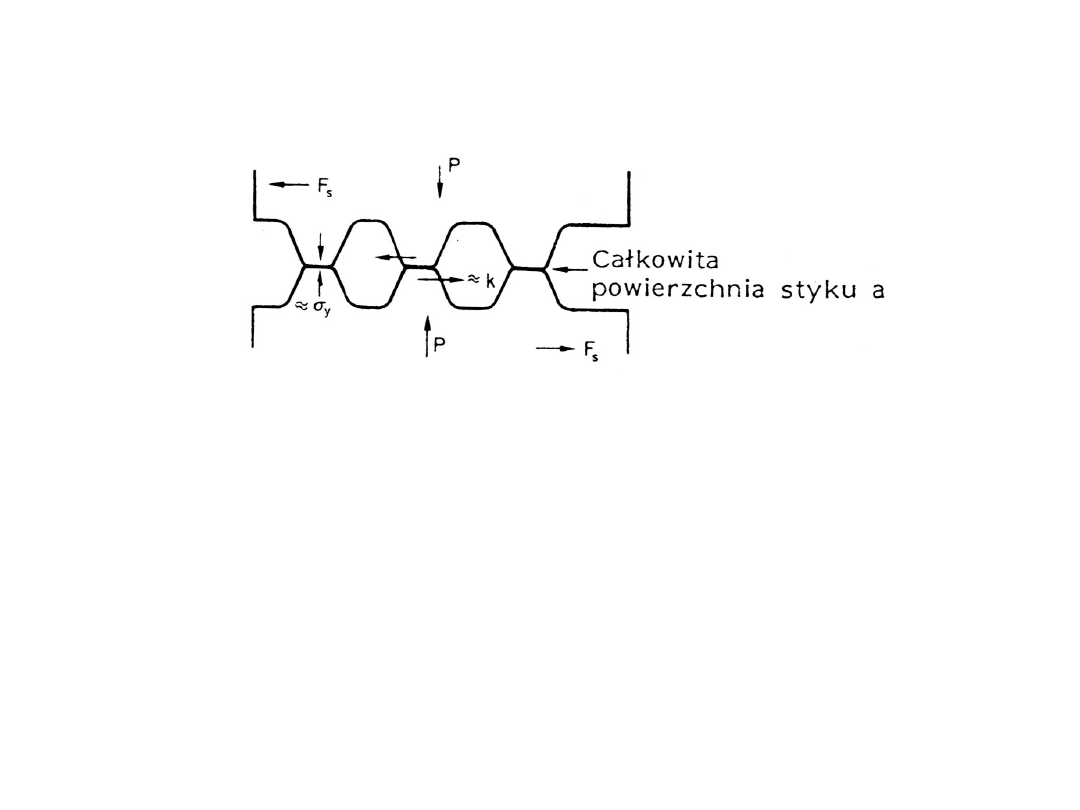
Tarcie i zużycie trybologiczne
F =
P
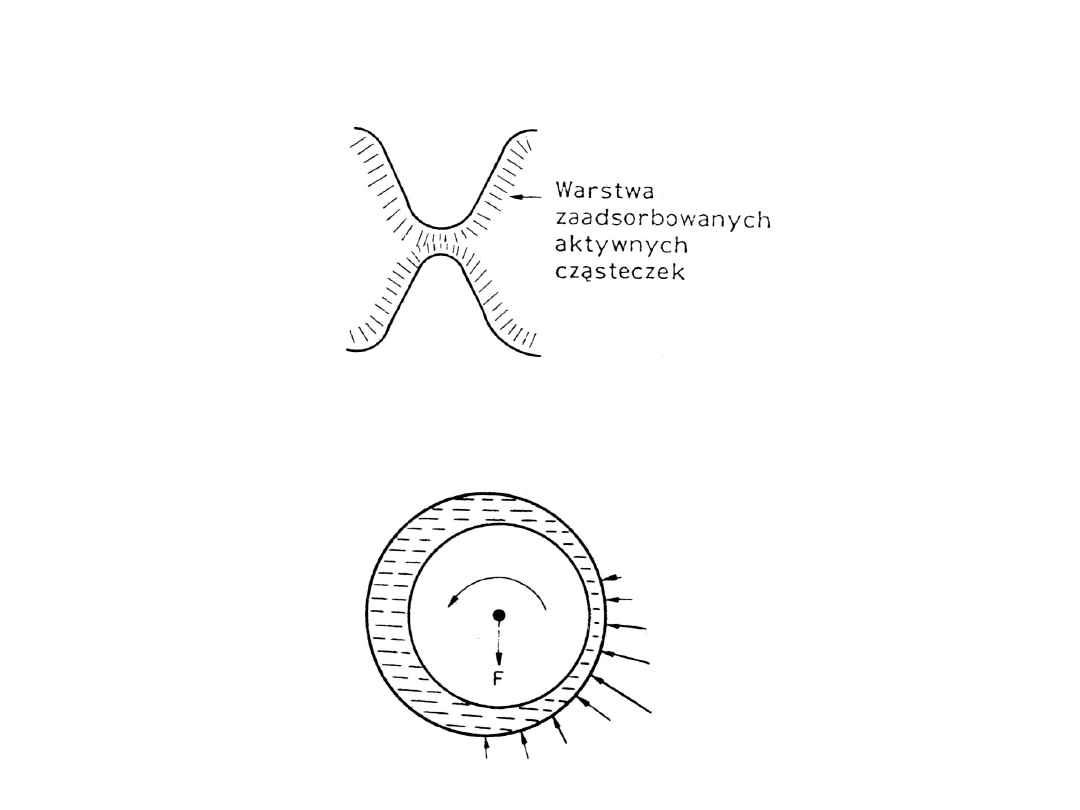
Smarowanie graniczne
Smarowanie hydrodynamiczne
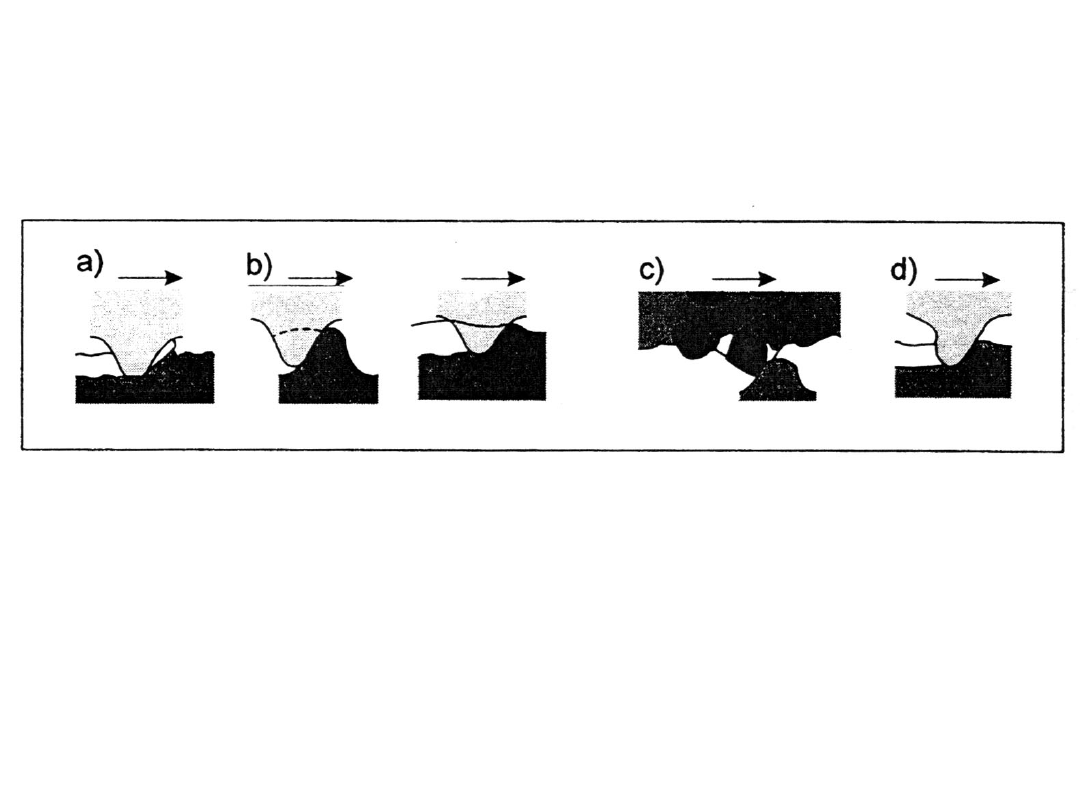
Zużycie trybologiczne spowodowane jest procesami tarcia.
Intensywność tego zużycia zależy od odporności obszarów tarcia
warstw wierzchnich i od rodzaju oddziaływania
a) Bruzdowanie
b) Ścinanie nierówności
c) Ścinanie nierówności ścierniwem
d) Odkształcenie plastyczne materiału

Zużycie zmęczeniowe
Występuje na skutek oddziaływania cyklicznych naprężeń
kontaktowych w warstwie wierzchniej.
Zmęczenie materiału w warstwie wierzchniej powoduje miejscowe
ubytki materiału
Zużycie adhezyjne
Polega na lokalnym sczepianiu się powierzchni trących, na
wierzchołkach nierówności powierzchni i następnym ich
rozrywaniu.
Występuje dla materiałów o dużym powinowactwie
chemicznym.
Warstwa tlenków na powierzchni zmniejsza oddziaływanie
adhezyjne
Zużycie ścierne:
W obszarach tarcia występują cząstki ścierniwa (utwierdzone
lub luźne)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
5 korozja, tarcie,umocnienie IIM(1)
7 korozja i tarcie
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
wyklad 12nowy procesy elektrodowe i korozja
KOROZJA BIOLOGICZNA II
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
TARCIE SMAROWANIE Bazylak
14 Korozja metali i stopów
1 2085 (2316+S) odporna na korozję na formy
4 Tarcie
korozja teoria
korozja teoria(1)
21 Wykonywanie zabezpieczeń przed korozją biologiczną i działaniem ognia
Tarcie, Materiały, Inżynieria Środowiska, Semestr 2, Mechanika techniczna, egzaminy
Korozja metali, Energetyka, Chemia
więcej podobnych podstron